Espectrometría en las escuelas: experimentos prácticos Teach article
Traducido por MariaRosa Quintero Bernabeu. Nataša Gros, Tim Harrison, Irena Štrumbelj Drusany y Alma Kapun Dolinar presentan una selección de experimentos realizados con un simple espectrómetro diseñado especialmente para las escuelas, y dan detalles de como llevar a cabo una de las…

Para motivar a los estudiantes utilizando un punto de vista práctico de la química, nosotros y nuestros colaboradores de proyecto hemos desarrollado una colección de experimentos utilizando un espectrofotómetro de bajo coste a pequeña escala. En este proyecto empleamos un sencillo espectrofotómetro escolar diseñado por una de nuestras colaboradoras (Nataša Gros). El espectrofotómetro puede ser fácilmente actualizado para formar parte de otros tipos de instrumentos analíticos, como por ejemplo cromatógrafos de gases o de líquidos, permitiendo así llevar a cabo un abanico más amplio de experimentos en la escuela (ver la página Web del proyectow1). Un número limitado de instrumentos se encuentra disponible para ser alquilados por escuelas.
Cómo funciona un espectrofotómetro
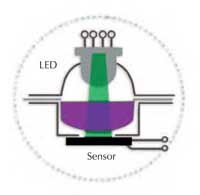
En un espectrofotómetro, la luz blanca que proviene de una fuente de luz (una bombilla) atraviesa un monocromador, de donde sale la luz de la longitud de onda (color) seleccionada. Esta luz pasa a continuación a través de una solución contenida en la celda óptica, llamada cubeta (Figura 1). La solución absorbe una fracción de la luz y un detector mide la reducción de intensidad de luz resultante (la absorbancia). Cuanto más intenso sea el color de la solución, mayor será la medida de absorbancia.

Imagen cortesía de Nicola Graf
del espectrofotómetro
Spektra
Imagen cortesía de Nataša Gros
Las cubetas más comúnmente utilizadas tienen una longitud de 1cm y requieren un volumen mínimo de 3 ml de solución para obtener medidas satisfactorias. El objetivo principal de un espectrofotómetro de uso general es la medida exacta y precisa de la absorbancia. Por tanto, la selección de la longitud de onda debe ser lo más exacto posible y la luz altamente monocromática (es decir de un estrecho rango de longitudes de onda). Consecuentemente la construcción de un aparato de este tipo es complicada y poco obvia para un usuario típico, el instrumento es caro.
En cambio, el objetivo principal del desarrollo del espectrofotómetro SpektraTM fue producir un aparato de bajo coste, portátil y robusto con un diseño y una utilización simple e intuitiva, que permite un bajo consumo de reactivos y el uso de un protocolo experimental simplificado (Gros, 2004). Este espectrofotómetro está principalmente diseñado para fines educativos, especialmente para la introducción de conceptos, pero ha demostrado ser útil para medidas cuantitativas o semi-cuantitativas de muestras sobre el terreno.
Spektra está constituido por dos elementos ópticos: un diodo electro luminiscente (light emitting diode LED) tricolor y un detector luminoso. Se pueden seleccionar tres colores poden ser: azul (430 nm), verde (565 nm) y rojo (625 nm). Esta luz atraviesa directamente la capa líquida y llega al detector (figura 2). Los elementos esenciales (la fuente de luz, la cámara de medida y el detector) están expuestos. De esta forma el instrumento no es una caja negra para los estudiantes, sino un aparato sencillo de entender y de utilizar (figures 3a y b).

espectrofotómetro Spektra. A:
fuente de luz LED; B: cámara
de medida; C: zona de
medida con el detector en la
parte inferior. Haga clic sobre
la imagen para ampliarla
Imagen cortesía de Nataša Gros

Spektra. Éste instrumento es
más compacto, pero los tres
elementos esenciales (A:
fuente de luz; B: cámara de
medida; C: detector) es
encuentran igualmente
expuestos. Haga clic sobre la
imagen para ampliarla
Imagen cortesía de Nataša Gros
Las reacciones y las medidas se llevan a cabo en soportes poliméricos llamados blisteres (similares a los embalajes de plástico de comprimidos farmacéuticos), los cuales permiten trabajar con volúmenes pequeños (0.35ml) de solución, homogeneización rápida de los reactivos y generación de volúmenes pequeños de residuos químicos . El trabajo experimental con el Spektra es simple y seguro, y no requiere formación de laboratorio o material de vidrio especiales. Los volúmenes de solución necesarios son muy pequeños: se puede utilizar incluso un protocolo experimental basado en el uso de gotas de solución si fuera necesario.
El espectrofotómetro se puede adquirir en líneaw2. Alternativamente, la Universidad de Bristolw3, Reino Unido, ofrece un número limitado de Spektra en alquiler para maestros que quieran probar los experimentos con sus estudiantes o bien desarrollar otro investigaciones prácticas. Por maestros que prefieran un instrumento convencional, los colorímetros Mystrica (que emplean cubetas normales) son igualmente asequibles y de buena calidadw4.
Protocolos experimentales en espectrofotometría
Como parte del proyecto, se desarrollaron una serie de actividades prácticas de espectrofotometría destinadas a aumentar el interés en la ciencia e inspirar a los futuros científicos entre los estudiantes de la escuela. Estas actividades cubren temes tan variados como el análisis de aguas, la física de la luz y el color, investigaciones sobre la ley de Lambert-Beer, equilibrio químico, análisis medioambiental, cinética de reacciones químicas y análisis de alimentos.
Los experimentos de análisis de alimentos incluyen la determinación espectrofotométrica de: niveles de hierro en muestras de diferentes hierbas o harinas, contenido de alcohol en licores, niveles de glucosa en mermelada, color de la cerveza, color (calidad) de la pimienta, niveles de fosfato en zumo de manzana, niveles de fosfatos y nitritos en productos cárnicos, y concentración de caseína en quesos. Existe otro protocolo que permite el seguimiento de la fermentación alcohólica.
A continuación se presentan las instrucciones detalladas para la determinación del nivel de glucosa en mermelada. Los detalles de otros experimentos, incluyendo algunos adecuados para actividades al alcance de escuelas de primaria, están disponibles en la página Web del proyectow1. La página Web contiene así mismo instrucciones para actualizar el instrumento Spektra a cromatógrafo de gases o líquidos, así como detalles de experimentos que se pueden realizar con el equipamiento actualizado (ver también Gros & Vrtačnik, 2005).
Determinación espectrofotométrica del nivel de glucosa en mermelada
Algunas reacciones entre azúcares y otros reactivos químicos generan productos con color. La intensidad del color está relacionada con la concentración inicial de azúcares. La absorbancia de soluciones de muestras se puede medir y comparar con la absorbancia de soluciones patrón de concentración de azúcar conocida. En el caso de polisacáridos sólo se conoce un número limitado de reacciones que implican cambios de color, y la mayoría de ellas implican azúcares sencillos, normalmente azúcares reductores (ver tabla).
La determinación de glucosa se escogió principalmente porque los estudiantes saben que son los azúcares, y por tanto la actividad tiene un interés general. Además, la determinación del contenido de azúcares en mermeladas puede tener interés en aplicaciones industriales en cuestiones relacionadas con control de calidad.
Uno de los método para la determinación de la concentración de azúcar en mermelada implica la hidrólisis de muchos de los azúcares no reductores (en mermelada principalmente sacarosa) en glucosa, utilizando ácido sulfúrico (H2SO4) y subsiguiente neutralización con hidróxido de sodio (NaOH). Los azúcares reductores (por ejemplo glucosa y fructosa) generan un producto rojo-marrón cuando son calentados en presencia de ácido 3,5 – dinitrosalicílico (DNSA, también conocido como ácido 2-hidroxi-3 ,5-dinitrobenzoico). Para más detalles sobre esta reacción, consultar Miller (1959).
La concentración del complejo coloreado se puede determinar con el espectrofotómetro usando el LED azul (430 nm). La concentración inicial de azúcar en las muestras de mermelada se puede obtener de la curva de calibración creada a partir de concentraciones de glucosa conocida.
Equipos y reactivos
- Espectrofotómetro Spektra (o otro espectrofotómetro)
- Cubetas o blisteres
- Pipetas
- Matraces aforados de 100 ml
- Erlenmeyers
- Tubos de medida
- Balanza
- Baño de agua
- Embudo
- Filtre de papel
- Muestras de mermelada
- Reactivo DNSA (ácido 3,5-dinitrosalicílico)
- Solución de ácido sulfúrico (H2SO4) (aproximadamente 2 moles/l)
- Solución de hidróxido de sodio (NaOH) (10% en peso)
- Tartrato de sodio y potasio (NaK(CH2OH)2(COO)2.4H2O)
- Glucosa en polvo (C6H12O6)
Preparación de les soluciones
Reactivo DNSA: para preparar el reactivo DNSA, disolver 10 g de DNSA en 200 ml de solución NaOH (aproximadamente 2 moles/l). Calentar la solución y mezclar perfectamente. Disolver 300 g de tartrato de sodio y potasio en 500 ml de agua destilada para obtener un estabilizante de color. Mezclar las dos soluciones, agitar y enrasar a 1 l con agua destilada.
Mermelada (sucres): pesar 1-2 g de mermelada en un erlenmeyer y añadir 10 ml de ácido sulfúrico. Calentar en el baño de agua hirviendo durante 20 min., agitando periódicamente hasta que la hidrólisis sea completa. Dejar enfriar la muestra y añadir cuidadosamente 12 ml de hidróxido de sodio. Agitar y filtrar a un matraz aforado de 100 ml, enrasar con agua destilada a 100 ml. Usando una pipeta, transferir 10 ml de esta solución a otro matraz aforado de 100 ml y enrasar a 100 ml con agua destilada para obtener la solución de medida. Agitar.
Mermelada (azúcares reductores): pesar 3.0 g de mermelada en un erlenmeyer. Añadir 50 ml de agua destilada. Calentar y agitar durante 10 min. Filtrar a un matraz aforado de 100 ml y enrasar a 100 ml con agua destilada. Usando una pipeta, transferir 10 ml a otro matraz aforado de 100 ml y enrasar a 100 ml con agua destilada para obtener la solución de medida. Agitar.
Solución estándar de glucosa (15 mg/ml): poner 1.5 g de glucosa en un matraz aforado de 100 ml y enrasar a 100 ml con agua destilada. Agitar.
Obtención de la curva de calibración
- Etiquetar cinco matraces aforados (100 ml) con letras de la A a la E. En cada matraz etiquetado, pipetear los volúmenes de solución estándar de glucosa y agua destilada especificados en la tabla 1.
| Matraz | A | B | C | D | E |
|---|---|---|---|---|---|
| Volumen de solución estándar de glucosa (ml) | 2 | 3 | 6 | 8 | 10 |
| Volumen de agua destilada (ml) | 98 | 97 | 94 | 92 | 90 |
| Concentración de glucosa (mg/ml) | 0.3 | 0.45 | 0.9 | 1.2 | 1.5 |
2. Etiquetar y llenar seis tubos de muestra tal y como se especifica en la tabla 2.
| Número de la muestra | Blanco | 1 | 2 | 3 | 4 | 5 |
|---|---|---|---|---|---|---|
| Solución estándar de glucosa (matraz) | N/A | A | B | C | D | E |
| Volumen de solución estándar de glucosa (ml) | 0 | 1 | 1 | 1 | 1 | 1 |
| Volumen de reactivo DNSA (ml) | 1 | 1 | 1 | 1 | 1 | 1 |
| Volumen de agua destilada (ml) | 3 | 2 | 2 | 2 | 2 | 2 |

calibración
Imagen cortesía de Irena
Štrumbelj Drusany
- Calentar los tubos de medida y sus contenidos en agua hirviendo durante 5 min. El reactivo DNSA reacciona con los azúcares presentes, generando un producto rojo-marrón.
- Enfriar los tubos de medida, añadir 6 ml de agua destilada a cada tubo y agitar bien.
- Usando la luz azul del LED (430 nm) del espectrofotómetro, medir la transmitancia de cada solución.
Las lecturas del instrumento Spektra son transmitancias expresadas en porcentajes y tienen que dividirse entre 100 para obtener los valores de transmitancia para los cálculos siguientes. La transmitancia está relacionada con la absorbancia por la ecuación: A = –log T. Ver la segunda y tercera columna de la tabla 3.
La imagen de la derecha muestra las soluciones de calibración. Incluso el blanco (agua con DNSA sin glucosa) tiene un color intenso. Por lo tanto es necesario medir todas las muestras, incluyendo el blanco, contra agua destilada. La absorbancia específica de la glucosa en las muestras se calcula restando la medida de absorbancia del blanco de la medida de absorbancia de la muestra (consultar la cuarta columna de la tabla 3).
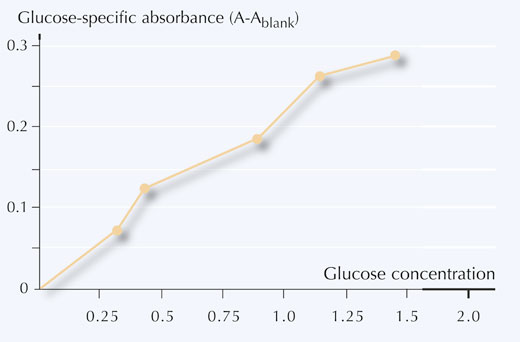
6. Grafico de la concentración de glucosa contra la absorbancia específica de la glucosa, tal y come se muestra en la figura 5.
Medida de las muestras de mermelada
Las muestras de mermelada deben ser tratadas de manera similar a las soluciones de glucosa utilizadas para la curva de calibración.
- Para cada muestra de mermelada a medir, colocar 1 ml de muestra de mermelada preparada (ver “Preparación de soluciones”) en un tubo de medida y añadir 1 ml de reactivo DNSA y 2 ml de agua destilada.
- Calentar los tubos de medida y sus contenidos en agua hirviendo durante 5 min. El reactivo DNSA reacciona con los azúcares presentes, generando un producto rojo-marrón.
- Enfriar los tubos, añadir 6 ml de agua destilada a cada tubo y agitar.
- Utilizando la luz azul LED (430 nm) del espectrofotómetro, medir la transmitancia (T%) de cada muestra de mermelada. Dividir entre 100 para obtener T, convertir T a A usando la ecuación A = –log T, i usar este valor para calcular la absorbancia específica de la glucosa (A- Ablanc).
La tabla 4 muestra un ejemplo de valores de transmitancia obtenidos y los valores de absorbancia específica de glucosa para cada muestra.
| Muestra | Transmitancia (lectura del Spektra, T%) |
Absorbancia (A) |
Absorbancia específica de la glucosa (A – Ablanc) |
|---|---|---|---|
| 1 | 18.6 | 0.73 | 0.17 |
| 2 | 21.3 | 0.67 | 0.11 |
- Utilizando la curva de calibración, convertir les medidas de absorbancia (A) a concentraciones de glucosa (mg/ml) en vuestras muestras.
Siguiendo los ejemplos de la tabla 4, las concentraciones de glucosa obtenidas a partir de la curva de calibración son:
Muestra 1: 0.8 mg/ml
Muestra 2: 0.5 mg/ml
- A partir de les concentraciones de glucosa, calcular la masa de glucosa en 1 g de muestra usando la siguiente ecuación:
Masa de glucosa (g por 1g muestra) = masa concentración (mg/ml) x 10 x 100 ml
Donde:
Masa concentración es el valor leído en la curva de calibración
10 es la dilución (ver “Preparación de soluciones”)
100 ml es el volumen de 1 g de muestra de mermelada.
En nuestro ejemplo,
Muestra 1: masa de glucosa (g per 1 g de muestra) = 0.8 mg/ml x 10 x 100 ml = 0.8 g
Muestra 2: masa de glucosa (g per 1 g de muestra) = 0.5 mg/ml x 10 x 100 ml = 0.5 g.
Estos cálculos están hechos asumiendo que la masa inicial de mermelada es de 1 g. Si, por ejemplo, la muestra hubiera pesado 2 g, los resultados anteriores se dividirían entre 2 para obtener la masa de glucosa en g por 1 g de muestra.
Azúcares reductores y no reductores
En términos químicos, un azúcar reductor es una aldosa, como la glucosa, que contiene un grupo aldehído que puede ser oxidado a ácido carboxílico. El test más común para detectar azúcares reductores es calentarlos en solución de Benedict o de Fehling, que contienen iones de cobre (II) que pueden ser reducidos a óxido de cobre (I) y observados como precipitados de color marrón-naranja.
Los azúcares no reductores, como la sacarosa, pueden tener un grupo cetona en lugar del grupo aldehído, el cual no puede reducir los iones cobre (II). Cuando se tratan con soluciones de Benedict o de Fehling, los azúcares no reductores no producen ningún precipitado coloreado.
Agradecimientos
Los autores quieren agradecer al Directorado General de la Comisión Europea para la Educación y la Cultura por el apoyo económico del proyecto Enfoque práctico a la Química analítica para Escuelas Vocacionales II (AnalChemVoc II, LLP-LDV-TOI-2008-SI-15) a través del programa Leonardo da Vinci.
References
- Gros N (2004) Spectrometer with microreaction chamber and tri-colour light emitting diode as a light source. Talanta 62: 143-150. doi: 10.1016/S0039-9140(03)00420-X
- Gros N, Vrtačnik M (2005) A small-scale low-cost gas chromatograph. Journal of Chemical Education 82: 291-293. doi: 10.1021/ed082p291
- Miller GL (1959) Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analytical Chemistry 31: 426-428.
- Este artículo es de consulta libre en la página web de la Sociedad Americana de Química (American Chemical Society). Consultar: http://pubs.acs.org/doi/pdf/10.1021/ac60147a030
Web References
- w1 – Para más información sobre el proyecto, véase: www.kii2.ntf.uni-lj.si/analchemvoc2/file.php/1/HTML/experiments.htm
- w2 – El instrumento Spektra puede ser adquirido en Laboratorijska tehnika Burnik: www.lt-burnik.si/index.php?newlang=english
- w3 – La Universidad de Bristol ChemLabS (www.chemlabs.bris.ac.uk) ofrece un número limitado de espectrofotómetros Spektra para ser alquilados a maestros que quieran probar los experimentos con sus estudiantes o desarrollar otras aplicaciones prácticas. Los maestros interesados pueden contactar con Tim Harrison (t.g.harrison@bristol.ac.uk).
- w4 – Para más detalles sobre los colorímetros Mystrica, consultar: http://mystrica.com/Colorimeter.aspx. La página Web también describe algunos posibles experimentos, siendo especialmente buenos los relacionados con reacciones enzimáticas.
Review
La química analítica se basa en el análisis espectrométrico fundamentalmente, pero los instrumentos profesionales son caros y por tanto no son fácilmente accesibles para las escuelas promedio de muchos países. Este artículo presenta un espectrofotómetro desarrollado por uno de los autores para llevar a cabo análisis asequibles para todas las escuelas de secundaria. La página web del proyecto detalla varios experimentos escolares en espectrofotometría, y el protocolo de laboratorio por uno de los experimentos se encuentra incluido en este artícul.
Recomendaría este artículo para introducir la química analítica en clases de ciencias (no sólo de química, sino también de biología y ciencias ambientales), particularmente para escuelas de secundaria que no disponen de un laboratorio bien equipado. El enfoque propuesto es simple y suficientemente agradable como para alentar a maestros y estudiantes a probar los experimentos propuestos y explorar otros nuevos.
Los maestros pueden utilizar este artículo para discutir la metodología de la espectrofotometría y la teoría de las medidas espectrofotométricas. El análisis experimental proporciona la oportunidad de obtener datos matemáticamente, ligando así química y estadística.
El artículo puede ser utilizado también para llevar a cabo un ejercicio de comprensión:
- Dado el procedimiento para preparar la curva de calibración de la solución estándar, completar la siguiente tabla:
| Matraz | A | B | C | D | E |
|---|---|---|---|---|---|
| Volumen de solución estándar de glucosa (ml) | |||||
| Volumen de agua destilada (ml) | |||||
| Concentración de glucosa (mg / ml) |
Giulia Realdon, Italia





