La spectrométrie et l’enseignement: expériences appareil en mains Teach article
Traduit par Maurice A. Casimir. Nataša Gros, Tim Harrison, Irena Štrumbelj Drusany et Alma Kapun Dolinar présentent un choix d’expériences avec un spectromètre simple spécialement conçu pour les établissements d’enseignement – et donnent des détails sur la manière de réaliser…

l’aimable autorisation de Maren
Beßler / Pixelio
Pour amener les élèves à apprécier la chimie, nous et nos partenaires au projet avons développé une série d’expériences utilisant des spectromètres miniature peu coûteux. Nous nous sommes servis pour le projet d’un simple spectromètre d’enseignement développé par l’une de nos collègues, (Nataša Gros). On peut facilement valoriser le spectromètre pour créer d’autres instruments d’analyse comme des chromatographes en phase gazeuse et en phase liquide, ce qui ouvre la voie à un éventail complet d’expériences en établissement d’enseignement (voir le site Internetw1 du projet). Un nombre limité d’instruments est disponible pour un prêt aux établissements.
Comment fonctionne un spectromètre
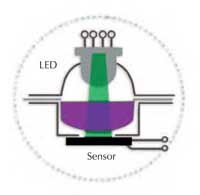
Dans un spectrometer, la lumière blanche d’une source lumineuse (ampoule) entre dans un monochromateur, d’où n’émerge que la lumière d’une longueur d’onde sélectionnée (couleur); celle-ci passe alors à travers la solution qui se trouve dans la cuvette (voir Figure 1). La soluion absorbe une fraction de la lumière et un détecteur mesure la réduction résultante de l’intensité lumineuse (l’absorbance). Plus la solution est de couleur foncée, plus le coefficient d’absorbance est élevé.

Illustration reproduite avec l’aimable autorisation de Nicola Graf
du spectomètre Spektra
Illustration reproduite avec
l’aimable autorisation de
Nataša Gros
Les cuvettes les plus largement utilisées ont un trajet optique de 1 cm et nécessitent au moins 3 ml de solution pour la réussite de la mesure. Le principal objectif d’un spectromètre universel est d’assurer une mesure de l’absorbance juste et précise: la sélection de la longueur d’onde doit être aussi fine que possible et la lumière hautement monochromatique (c’est-à-dire avec un éventail de longueur d’ondes très peu ouvert). Il en résulte que la construction de l’appareil est compliquée et pas du tout évidente pour un utilisateur non spécialiste – et l’instrument lui-même est coûteux.
Tout au contraire, le développement du spectromètre SpektraTMa eu pour objectif principal la production d’un instrument bon marché, portable et robuste à la conception et au fonctionnement simples et intuitifs, permettant une faible consommation de réactifs et une approche expérimentale simplifiée (Gros, 2004). Ce spectromètre est destiné avant tout à des usages éducatifs; en particulier pour l’introduction de concepts, mais il s’est également révélé utile pour des dosages ‘in situ’ d’échantillons de manière quantitative ou semi quantitative.
Le Spektra est composé de deux éléments optiques: une diode électroluminescente (DEL) émettant en trois couleurs et un détecteur de lumière. On peut choisir une lumière bleue (430 nm), verte (565 nm) ou rouge (625 nm); celle-ci passe directement à travers la couche liquide et frappe le détecteur (voir Figure 2). Les composants essentiels (la source lumineuse, la chambre de mesure et le détecteur) sont tous visibles: pour les élèves, l’instrument n’est pas une ‘boîte noire’, mais est il est facile d’en comprendre le principe et d’en assurer le fonctionnement (voir Figures 3a et b).

spectromètre Spektra. A: la
source lumineuse(DEL); B: la
chambre de mesure ; C: la
zone de mesure avec le
détecteur dans le fond.
Cliquer sur l’image pour
l’agrandir
Illustration reproduite avec
l’aimable autorisation de
Nataša Gros

Spektra monté. L’instrument
est plus compact, mais les
trois composants essentiels
(A: source lumineuse ; B:
chambre de mesure ; C:
détecteur) sont encore
visibles. Cliquer sur l’image
pour l’agrandir
Illustration reproduite avec
l’aimable autorisation de
Nataša Gros
Les reactions et les dosages se font sur des supports en polymère appelés « blisters » (similaires aux emballages en matière plastique des pilules), adaptés à de faibles volumes (0.35 ml) de solution à tester, à une rapide homogénéisation des réactifs et générant de petits volumes de déchets chimiques. L’expérimentation à l’aide de Spektra est simple et sans danger, ne requerrant ni formation spéciale au travail de laboratoire ni verrerie de laboratoire. Les volumes de solution nécessaires sont très faibles: on peut même utiliser une approche expérimentale au niveau de la goutte là où cela est approprié.
On peut acheter le spectromètre sur Internetw2. De son côté l’Université de Bristolw3, Royaume Uni, offre en prêt un nombre limité de spectromètres Spektra pour des enseignants voulant soit faire des expériences avec leurs élèves, soit développer d’autres recherches à caractère pratique. Pour les enseignants préférant un instrument plus conventionnel, ils peuvent également se procurer des colorimètres Mystricaw4 de bonne qualité (utilisant des cuvettes de taille normale).
Expériences en spectrométrie sur le tas
Un éventail d’activités pratiques sur la spectrométrie a été développé dans le cadre du projet pour soulever l’intérêt sur la science et inspirer des vocations de scientifiques chez les élèves. Ces activités couvraient des thèmes aussi variés que l’analyse de l’eau, la physique de la lumière et de la couleur, des recherches sur la Loi de Beer-Lambert (ou de Bouguer), l’équilibre chimique, l’analyse de paramètres environnementaux, la cinétique des réactions chimiques et l’analyse des aliments.
Les expériences en analyse d’aliments couvrent la détermination par spectrométrie du taux de fer dans des échantillons d’herbes séchées ou de farine; la teneur alcoolique de spiritueux, le taux de glucose dans de la confiture, la couleur de la bière; la couleur (approche qualitative) du paprika; le taux de phosphate dans des jus de fruits; les taux de phosphates et de nitrites dans des produits carnés; et la concentration en caséine du fromage. Un autre protocole permet de surveiller et contrôler le processus de la fermentation alcoolique.
On présente ci-après les instructions détaillées pour la détermination du taux de glucose dans une confiture; des détails complets sur toutes les autres expériences – y compris certaines adaptées aux besoins des élèves en difficulté des écoles primaires – sont disponibles sur le site Internet du projetw1. Le site contient également des instructions pour faire passer le spectromètre Spektra à l’état de chromatographe en phase vapeur ou en phase liquide, ainsi que des détails sur les expériences réalisables avec l’équipement transformé (voir également Gros & Vrtačnik, 2005).
Dosage par spectrométrie du glucose dans la confiture
Nombre de reactions entre les sucres et des réactifs chimiques donnent des produits colorés; l’intensité de la couleur est fonction de la concentration initiale en sucre. On peut mesurer l’absorbance de solutions échantillons et la comparer à l’absorbance de solutions standard aux concentrations en sucre connues. On ne connaît qu’un nombre limité de réactions avec changement de couleur pour les polysaccharides, et la plupart impliquent des molécules simples, habituellement des sucres réducteurs (voir encadré).
Le dosage du glucose a été choisi avant tout parce que les élèves savent ce que sont les sucres – l’expérience est très bien perçue. En outre, le dosage du sucre dans la confiture peut avoir des applications industrielles dans des domaines comme le contrôle qualité.
Une méthode de dosage de la concentration de la confiture en sucre consiste à hydrolyser un certain nombre des sucres non réducteurs (principalement le sucrose dans la confiture) par addition d’acide sulfurique (H2SO4) puis neutralisation de l’échantillon à l’hydroxyde de sodium (NaOH). Les sucres réducteurs (c’est-à-dire le glucose et le fructose) chauffés avec de l’acide 3.5-dinitrosalicylique (ADNS, aussi connu sous le nom d’acide 2-hydroxy-3,5-dinitrobenzoïque) produisent un composé brun-rouge. Pour plus de détails sur cette réaction, voir Miller (1959).
On peut déterminer la concentration du complexe coloré à l’aide du spectromètre en utilisant la DEL en radiation bleue (430 nm): la concentration initiale en sucre des échantillons de confiture est lue sur une courbe d’étalonnage dressée à partir de concentrations en glucose connues.
Equipement et réactifs
- Spectromètre Spektra (ou autre)
- Cuvettes ou ‘blisters’
- Pipettes
- Eprouvettes graduées de 100 ml
- Fiole d’Erlenmeyer
- Tubes à essai
- Balance
- Bain-marie
- Entonnoir
- Papier filtre
- Echantillons de confitures
- Réactif ADNS (acide 3,5-dinitrosalicylique)
- Acide sulfurique en solution (H2SO4) (approximativement à 2 mol/l)
- Hydroxyde de sodium en solution (NaOH) (w = 10%)
- Tartrate double de sodium et de potassium (NaK(CH2OH)2(COO)2.4H2O)
- Glucose en poudre (C6H12O6)
Préparation des solutions
Réactif ADNS: Pour preparer le réactif ADNS, dissoudre 10 g d’ADNS dans 200 ml de solution de NaOH (à environ 2 mol/l). Chauffer la solution en agitant vigoureusement. Dissoudre 300 g de tartrate double de sodium et de potassium dans 500 ml d’eau distillée pour obtenir un stabilisateur de couleur. Mélanger les deux solutions, bien agiter et compléter à 1 l avec de l’eau distillée.
Confiture (sucres): Mettre 1 à 2 g de confiture dans une fiole d’Erlenmyer et ajouter 10 ml d’acide sulfurique. Chauffer au bain-marie bouillant pendant 20 minutes, en agitant régulièrement jusqu’à hydrolyse complète. Laisser refroidir l’échantillon et ajouter avec précaution 12 ml d’hydroxyde de sodium. Agiter et filtrer dans une éprouvette graduée de 100 ml, et compléter à 100 ml avec de l’eau distillée. Transférer 10 ml de la solution à l’aide d’une pipette dans une autre éprouvette graduée de 100 ml et compléter à 100 ml avec de l’eau distillée pour obtenir la solution test. Bien agiter.
Confiture (sucres réducteurs): Mettre 3.0 g de confiture dans une fiole d’Erlenmeyer, ajouter 50 ml d’eau distillée, chauffer en agitant pendant 10 minutes. Filtrer dans une éprouvette graduée de 100 ml et ajouter 100 ml d’eau distillée. Transférer 10 ml de la solution à l’aide d’une pipette dans une autre éprouvette graduée de 100 ml et compléter à 100 ml avec de l’eau distillée pour obtenir la solution test. Bien agiter.
Solution de glucose contrôlée (15 mg/ml): Mettre 1.5 g de glucose dans une éprouvette graduée de 100 ml et compléter à 100 ml avec de l’eau distillée? Agiter.
Etablissement de la courbe d’étalonnage
- Coller une etiquette avec les lettres A à E sur cinq éprouvettes graduées (100 ml). Injecter à la pipette dans chaque éprouvette étiquetée les volumes de solution de glucose standard et d’eau distillée spécifiés dans le Tableau 1.
| Eprouvette | A | B | C | D | E |
|---|---|---|---|---|---|
| Volume de solution de glucos contrôlée (ml) | 2 | 3 | 6 | 8 | 10 |
| Volume d’eau distillée (ml) | 98 | 97 | 94 | 92 | 90 |
| Concentration en glucose (mg/ml) | 0.3 | 0.45 | 0.9 | 1.2 | 1.5 |
2. Etiqueter et remplir six tubes de test comme indiqué dans le Tableau 2.
| Numéro de l’échantillo | Essai à blanc | 1 | 2 | 3 | 4 | 5 |
|---|---|---|---|---|---|---|
| Solution de glucose standard (éprouvette) | N/A | A | B | C | D | E |
| Volume de solution de glucose standard (ml) | 0 | 1 | 1 | 1 | 1 | 1 |
| Volume de réactif ADNS (ml) | 1 | 1 | 1 | 1 | 1 | 1 |
| Volume d’eau distillée (ml) | 3 | 2 | 2 | 2 | 2 | 2 |

d’étalonnage
Illustration reproduite avec
l’aimable autorisation de Irena
Štrumbelj Drusany
- Chauffer les tubes de test et leurs contenus dans de l’eau bouillante pendant 5 minutes; le réactif ADNS réagira avec tout sucre present en donnant un produit rouge-brun.
- Refroidir les tubes de test, ajouter 6 ml d’eau distillée dans chacun et bien agiter.
- Mesurer le facteur de transmission de chaque solution à l’aide de la DEL en couleur bleue (430 nm) du spectromètre.
Les lectures faites sur le spectromètre Spektra sont celles de facteurs de transmission exprimés en pourcentage et doivent être divisées par 100 pour obtenir les valeurs de facteurs de transmission utilisés dans les calculs suivants. Le facteur de transmission (T) est lié à l’absorbance (A) selon l’équation : A = – Log T. Voir les deuxième et troisième colonnes du Tableau 3.
L’illustration sur la droite montre les solutions d’étalonnage; même l’essai à blanc (eau et ADNS sans glucose) est de couleur intense. Il est donc nécessaire de doser tous les échantillons, y compris celui à blanc, par rapport à de l’eau distillée. L’absorbance spécifique au glucose des échantillons est alors calculée en soustrayant la mesure d’absorbnce de l’essai à blanc de celle de l’échantillon (voir la quatrième collonne du Tableau 3).
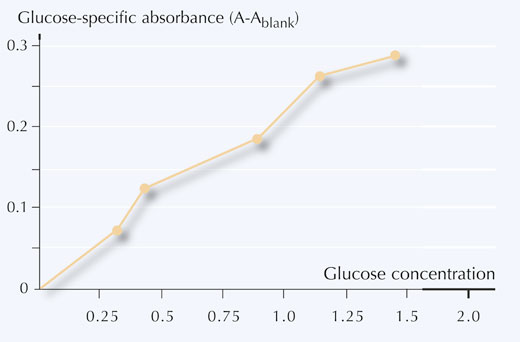
6. Reporter la concentration en glucose en function de l’absorbance spécifique au glucose, comme indiqué sur la Figure 5.
Dosage des échantillons de confiture
Les échantillons de confiture doivent être manipulés comme indiqué pour les solutions de glucose utilisés pour dresser la courbe d’étalonnage.
- Pour chaque confiture à tester, mettre 1 ml d’échantillon de confiture préparé (voir ‘Préparation des solutions’) dans un tube à essai et ajouter 1 ml de réactif ADNS et 2 ml d’eau distillée.
- Chauffer le tube à essai et son contenu dans de l’eau bouillante pendant 5 minutes; le réactif ADNs réagira avec tout sucre présent en donnant un composé rouge-brun.
- Refroidir le tube à essai, ajouter 6 ml d’eau distillée et bien agiter.
- Mesurer à l’aide de la DEL de couleur bleue du spectromètre la valeur du facteur de transmission (T%) de l’échantillon. Diviser par 100 pour obtenir T, convertir T en A en utilisant l’équation A = – Log T, et prendre la valeur de A pour calculer l’absorbance spécifique du glucose (A – Aessai à blanc)
Le tableau 4 montre un exemple des valeurs du facteur de transmission obtenues et l’absorbance spécifique au glucose calculée pour l’échantillon.
| Echantillon | Facteur de transmission (lecture du Spektra, T%) |
Absorbance (A) |
Absorbance spécifique du glucose (A – Aessai à blanc) |
|---|---|---|---|
| 1 | 18.6 | 0.73 | 0.17 |
| 2 | 21.3 | 0.67 | 0.11 |
- Convertir la mesure d’absorbance (A) de l’échantillon en concentration de glucose (mg/ml) en utilisant la courbe d’étalonnage.
Si l’on utilise les exemples du Tableau 4, les concentrations en glucose tirées de la courbe d’étalonnage donnent:
Echantillon 1: 0.8 mg/ml
Echantillon 2: 0.5 mg/ml
6. Calculer la masse de glucose dans 1 g d’échantillon de confiture à partir des concentrations en glucose en utilisant l’équation suivante:
Masse de glucose (en g par g d’échantillon) = concentration en masse (mg/ml) x 10 x 100 ml
où
La concentration en masse est la valeur lue sur la courbe d’étalonnage
10 est la dilution (voir ‘Préparation des solutions’)
100 ml est le volume d’1 g d’échantillon de confiture.
Dans l’exemple,
Echantillon 1: masse de glucose (en g par g d’échantillon) = 0.8 mg/ml x 10 x 100 ml = 0.8 g
Echantillon 2: masse de glucose (en g par G d’échantillon) = 0.5 mg/ml x 10 x 100 ml = 0.5 g.
Les calculs ci-dessus partent de l’hypothèse que l’échantillon initial de confiture était de 1 g. Si, par exemple, le poids de l’échantillon avait été de 2 g, il aurait fallu diviser par 2 les chiffres ci-dessus pour obtenir la masse d eglucose en g par g d’échantillon.
Sucres réducteurs et non réducteurs
Chimiquement parlant, un sucre réducteur est un aldose tel que le glucose, qui contient un groupe aldéhyde oxydable en acide carboxylique. Le test de détection des sucres réducteurs le plus commun consiste à les chauffer avec des solutions de Benedict ou de Fehling qui contiennent des ions de cuivre (II) réduits en oxyde de cuivre (I) repérable sous forme de précipité brun-orange.
Les sucres non réducteurs comme le sucrose peuvent contenir un groupe fonctionnel cétone plutôt qu’un groupe aldéhyde, et ils ne peuvent réduire les ions de cuivre (II). Lorsqu’on les fait réagir avec des solutions de Benedict ou de Fehling, les sucres non réducteurs ne forment pas de précipité coloré.
Remerciements
Les auteurs tiennent à remercier la Direction Générale de l’Education et de la Culture de la Commission Européenne pour l’appui financier apporté à l’Approche sur le tas de la chimie analytique pour le projet des centres de formation professionnelle II (AnalChemVoc II, LLP-LDV-TOI-2008-SI-15) via le programme Leonardo da Vinci.
References
- Gros N (2004) Spectrometer with microreaction chamber and tri-colour light emitting diode as a light source. Talanta 62: 143-150. doi: 10.1016/S0039-9140(03)00420-X
- Gros N, Vrtačnik M (2005) A small-scale low-cost gas chromatograph. Journal of Chemical Education 82: 291-293. doi: 10.1021/ed082p291
- Miller GL (1959) Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analytical Chemistry 31: 426-428.
- Le présent article est disponible gratuitement sur le site Interne de l’American Chemical Society. Voir: http://pubs.acs.org/doi/pdf/10.1021/ac60147a030
Web References
- w1 – Pour plus d’informations sur le projet, voir: www.kii2.ntf.uni-lj.si/analchemvoc2/file.php/1/HTML/experiments.htm
- w2 – On peut acheter le spectromètre Spektra chez Laboratorijska tehnika Burnik: www.lt-burnik.si/index.php?newlang=english
- w3 – Le ChemLabS (www.chemlabs.bris.ac.uk) de l’Université de Bristol propose un nombre limité de spectromètres Spektra en prêt aux enseignants qui veulent soit faire les expériences avec leurs élèves, soit développer d’autres applications pratiques. Les enseignants intéressés doivent contacter (t.g.harrison@bristol.ac.uk).
- w4 – Pour plus de details sur les colorimètres Mystrica, voir: http://mystrica.com/Colorimeter.aspx. The website also describes a number of possible experiments; particularly good are those involving enzymes reactions.
Review
La chimie analytique repose beaucoup sur l’analyse spectrométrique, mais les instruments professionnels sont coûteux et donc pas facilement disponibles pour des établissements d’enseignement de nombreux pays. Le présent article décrit un spectromètre développé par l’un des auteurs pour rendre l’analyse par spectrométrie accessible à chaque lycée. Le site Internet du projet donne des détails sur plusieurs expériences en établissement sur la spectrométrie, et le protocole de laboratoire pour l’une des expériences est inclus dans l’article.
J’aimerais recommander le présent article pour introduire la chimie analytique dans les leçons sur les matières scientifiques (pas seulement la chimie, mais aussi la biologie et les sciences de l’environnement), en particulier pour les lycées ne disposant pas d’un laboratoire bien équipé. L’approche proposée est simple et suffisamment abordable pour encourager les enseignants et les élèves à réaliser les expériences suggérées et à en mettre en place de nouvelles.
Les enseignants pourraient utiliser le présent article pour une discussion sur la méthodologie de la spectrométrie et la théorie des dosages par spectrométrie. L’analyse expérimentale fournit l’opportunité d’analyser mathématiquement les données obtenues, reliant ainsi la chimie aux statistiques.
Le present article pourrait également être utilisé pour un exercice de compréhension. Par exemple:
- Compléter le tableau suivant en fonction de la procédure suivie pour élaborer la courbe d’étalonnage à partir de la solution de contrôle standard:
| Eprouvette | A | B | C | D | E |
|---|---|---|---|---|---|
| Volume de solution de glucose standard (ml) | 2 | 3 | 6 | 8 | 10 |
| Volume d’eau distillée (ml) | 98 | 97 | 94 | ||
| Concentration en glucose (mg/ml) | 0.3 | 1.2 | 1.5 |
Giulia Realdon, Italie





