Fotometrie in der Schule – praktische Versuche Teach article
Übersetzt von Veronika Ebert. Nataša Gros, Tim Harrison, Irena Štrumbelj Drusany und Alma Kapun Dolinar stellen ausgewähltes Repertoire an Experimenten vor, die mit einem einfachen, speziell für Schulen hergestellten Fotometer durchgeführt werden können. Mit detaillierter Arbeitsanleitung…

von Maren Beßler / Pixelio
Um Schüler/innen durch einen Zugang mit praktischen chemischen Experimenten zu motivieren, haben wir gemeinsam mit unseren Projektmitarbeiter/innen mehrere Experimente entwickelt, die mit kleinen, preisgünstigen Photometern durchgeführt werden können. Wir verwenden dazu ein einfaches Fotometer, das von einer unserer Projektmitarbeiterin Nataša Gros entwickelt worden ist. Dieses Fotometer kann problemlos zu anderen analytischen Geräten wie z.B. einem Gaschromatografen, oder einem Flüssigkeitschromatografiegerät aufgerüstet werden (siehe Webseite des Projektsw1), wodurch weitere Schulversuche möglich werden. Eine kleine Zahl von Geräten steht zum Verleih an Schulen bereit.
Das methodische Prinzip von Fotometern
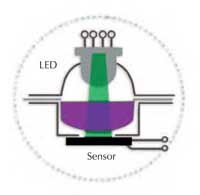
In einem Fotometer wird von einer Lichtquelle, z.B. einer Glühbirne weißes Licht ausgesandt, und in den Monochromator geschickt. Dieser lässt nur das Licht einer ganz bestimmten Wellenlänge (Farbe) durch. Das Licht durchstrahlt die zu messende Lösung in einer optischen Zelle, einer so genannten Küvette (siehe Abbildung 1). Die Lösung absorbiert einen Teil des Lichts und ein Detektor misst die daraus resultierende Reduktion der Lichtmenge (die Absorption). Je intensiver die Farbe, desto größer ist die Absorption.

Mit freundlicher Genehmigung von Nicola Graf
Spektra Fotometers
Mit freundlicher Genehmigung
von Nataša Gros
Der optische Weg der gebräuchlichsten Küvetten ist 1 cm lang. Es werden weniger als 3 ml Probe für eine erfolgreiche Messung benötigt. Die wichtigste Eigenschaft eines für unterschiedliche Zwecke verwendbaren Fotometers ist die Zuverlässigkeit und Präzision der Absorptionsmessung: Die Auswahl der Wellenlänge soll so genau wie möglich sein, und das entstehende Licht soll möglichst monochromatisch (d.h. nur ein möglichst enger Wellenlängenbereich) sein. Aus diesem Grund ist die Konstruktion kompliziert, und nicht für jede/n Nutzer/in offensichtlich, zudem ist das Gerät teuer.
Um einen geringen Reagentienverbrauch und einfache Versuchsvorschriften zu erzielen, lag das Hauptaugenmerk bei der Entwicklung des SpektraTM Fotometers auf der Herstellung eines preisgünstigen, haltbaren Geräts mit einfachem und intuitiv erfassbaren Design und einer ebensolchen Bedienbarkeit (Gros, 2004). Das Fotometer ist primär für Ausbildungszwecke gedacht, vor allem für die Einführung von Konzepten. Es eignet sich aber auch für quantitative oder semiquantitative Vor-Ort-Messungen.
Die Geräte enthalten zwei optische Elemente: (1) eine Leuchtdiode (LED), die drei Farben emittiert – blau (430 nm), grün (565 nm), oder rot (625 nm). Eine davon kann ausgewählt werden. (2) einen Sensor, auf den das Licht, das die Flüssigkeit durchstrahlt hat, fällt. (siehe Abbildung 2). Die wichtigsten Bestandteile (Lichtquelle, Messzelle und Sensor) sind sichtbar. Es handelt sich um keine „black box“; das Gerät kann von den Schüler/innen leicht durchschaut und bedient werden (siehe Abbildung 3a and b).

des Spektra Fotometers; A:
die LED-Lichtquelle; B: die
Messzelle; C: der Messbereich
mit dem Sensor im Boden.
Zum Vergrößern auf das Bild
klicken
Mit freundlicher Genehmigung
von Nataša Gros

Design des Spektra
Fotometers. Das Gerät ist
kompakter, aber die drei
essentiellen Komponenten
sind noch immer sichtbar (A:
Lichtquelle; B: die Messzelle;
C: Sensor). Zum Vergrößern
auf das Bild klicken
Mit freundlicher Genehmigung
von Nataša Gros
Die Reaktionen und Messungen werden auf einer Kunststoffunterlage, Blister genannt, durchgeführt, vergleichbar mit den Kunststoffverpackungen von Tabletten. Dadurch sind sehr kleine Probenvolumina (0,35 ml) und eine rasche Mischung der Reagentien möglich, zudem entstehen nur geringe Mengen chemischen Abfalls. Das Experimentieren mit Spektra ist einfach und sicher, erfordert keine besonderen Laborschulungen oder -glasgeräte. Die erforderlichen Probenvolumina sind extrem klein: Es können auch Versuche mit einzelnen Tropfen durchgeführt werden.
Das Fotometer kann im Internetw2 bestellt werden, außerdem stellt die Universität Bristolw3, Großbritannien Lehrer/innen, die Versuche mit ihren Schüler/innen ausprobieren oder neue Methoden entwickeln wollen, eine limitierte Zahl von Spektra Fotometern leihweise zur Verfügung. Lehrer/innen, die ein konventionelles Gerät bevorzugen, können ein Mystrica Kolorimeter (zur Verwendung mit normalen handelüblichen Küvetten anschaffen. Diese Geräte sind preisgünstig und von guter Qualitätw4.
Praktische fotometrische Experimente
Um das Interesse an Naturwissenschaften zu heben und mögliche zukünftige Naturwissenschafter/innen zu begeistern, wurde – als Teil unseres Projekts – eine Reihe von fotometrischen Messungen entwickelt. Die Versuche decken unterschiedliche Themen ab, und reichten von der Wasseranalyse, über die Physik von Licht und Farbe, Versuche zum Lambert Beer´schen Gesetz, zu Umweltanalysen, der Kinetik chemischer Reaktionen bis zur Lebensmittelanalyse.
Die Lebensmittelanalyse umfasste die fotometrische Quantifizierung des Eisengehalts in getrockneten Kräutern oder Mehl; den Alkoholgehalt von Spiritousen; den Glukosegehalt von Konfitüre; die Farbe des Biers; die Farbe (Menge) von Paprika; den Phosphat- und Nitritgehalt in Fleischprodukten, und den Kaseingehalt von Käse. Eine andere Arbeitsanleitung erlaubt es, die Alkoholbildung bei Gärungsexperimenten zu verfolgen.
In diesem Artikel wird eine Schritt-für –Schritt-Arbeitsanleitung zur Bestimmung des Glukosegehalts in Konfitüre vorgestellt; die detaillierte Beschreibung aller anderen Versuche, darunter auch solche, die sich für weiterführende Versuche in der Volksschule eignen, finden sich auf der Webseite unseres Projekts w1. Dort sind auch Anleitungen für die Aufrüstung des Spektra-Geräts zu einem Gaschromatografen sowie geeignete Versuche für das aufgerüstete Gerät abrufbar (siehe auch Gros & Vrtačnik, 2005).
Spektroskopische Bestimmung des Zuckergehalts in Konfitüre
Zahlreiche Reaktionen zwischen Zuckern und chemischen Reagentien erzeugen gefärbte Produkte; die Farbintensität korreliert dabei mit der anfänglich vorhandenen Zuckerkonzentration. Die Absorption der Probe kann gemessen, und mit der Absorption von Standards mit bekannter Zuckerkonzentration verglichen werden. Für Polysaccharide gib es nur wenige geeignete Farbreaktionen, in der Regel spielen dabei einfache Zucker, meist reduzierende Zucker eine Rolle (siehe Box).
Die Glukosebestimmung wurde in erster Linie ausgewählt, weil der Versuch bei den Schüler/innen auf großen Anklang stößt, da sie Zucker kennen. Außerdem dürfte die Bestimmung des Zuckergehalts in Konfitüre für industrielle Anwendungen bedeutsam sein, z.B. für die Qualitätskontrolle.
Eine Möglichkeit die Zuckerkonzentration in Konfitüre zu bestimmen beruht auf der Hydrolyse vieler nicht-reduzierender Zucker (in Konfitüre hauptsächlich Saccharose) zu Glukose, üblicherweise unter der Verwendung von Schwefelsäure (H2SO4). Anschließend wird die Probe mit Natronlauge (NaOH) neutralisiert. Durch Erhitzen mit 3,5-Dinitrosalicylsäure (DNSA; auch als 2-Hydroxy-3,5-dinitrobenzoesäure bekannt) wird der Zucker unter Bildung eines rotbraunen Produkts reduziert (z.B. zu Glukose und Fruktose). Weitere Details, siehe Miller (1959).
Die Konzentration des gefärbten Komplexes kann mit dem Fotometer unter Verwendung der blauen Leuchtdiode (430 nm) bestimmt werden: die Ausgangskonzentration des Zuckers in der Konfitüre kann aus einer Kalibrationskurve, die durch Messung von Glukosestandards erstellt worden ist, ermittelt werden.
Geräte und Reagentien
- Spektro Fotometer (oder ein anderes Fotometer)
- Küvetten oder Blister
- Pipetten
- 100 ml Messkolben
- Erlenmeyerkolben
- Teströhrchen
- Waage
- Wasserbad
- Trichter
- Filterpapier
- Konfitüreproben
- DNSA Reagens (3,5-dinitrosalicylsäure)
- Schwefelsäure (H2SO4), etwa 2 mol/L
- Natronlauge (NaOH) (w=10%)
- Kaliumnatriumtartrat (NaK(CH2OH)2(COO)2.4H2O)
- Glukosepulver (C6H12O6)
Herstellung der Lösungen
DNSA reagent: Zur Herstellung des DNSA Reagens, 10 g DNSA in 200 ml NaOH (etwa 2 mol/l) auflösen, erhitzen und gut rühren. Zur Herstellung eines Farbstabilisators 300 g Kaliumnatriumtartrat in 500 ml destilliertem Wasser auflösen. Die beiden Lösungen vereinigen, gut mischen und mit destilliertem Wasser auf 1 L auffüllen.
Konfitüre (Zucker): 1-2 g Konfitüre in einem Erlenmeyerkolben einwiegen und 10 ml Schwefelsäure zusetzen. 20 min in einem kochenden Wasserbad erhitzen, regelmäßig rühren bis die Hydrolyse komplett ist. Die Probe abkühlen lassen und vorsichtig 12 ml Natronlauge zusetzen. Rühren, in einen 100 ml Kolben filtrieren, mit destilliertem Wasser auf 100 ml auffüllen. 10 ml davon mit einer Pipette in einen anderen 100 ml Kolben überführen und auf 100 ml auffüllen. Das ist die Testlösung. Gut rühren.
Konfitüre (reduzierende Zucker): 3,0 g Konfitüre in einen Erlenmeyerkolben füllen, 50 ml destilliertes Wasser zugeben, unter Rühren 10 min erhitzen. In eine 100 ml Flasche filtrieren und mit destilliertem Wasser auf 100 ml auffüllen. Mit einer Pipette 10 ml in eine weitere 100 ml Flasche überführen und mit destilliertem Wasser auf 100 ml auffüllen. Das ist die Testlösung. Gut rühren.
Glukosestandard (15 mg/ml): 1,5 g Glukose in einen 100 ml Kolben einwiegen und mit destilliertem Wasser auf 100 ml auffüllen. Rühren.
Erstellung der Kalibrationskurve
- Fünf 100 ml-Flaschen mit den Buchstaben A-E beschriften. In jede beschriftete Flasche die in Tabelle 1 angegebene Mengen an Glukosestandard und destilliertem Wasser hinein pipettieren.
| Tabelle 1: Herstellung der Standardglukoselösung | |||||
|---|---|---|---|---|---|
| Volumen der Glukoselösung (ml) | 2 | 3 | 6 | 8 | 10 |
| Volumen destilliertes Wasser (ml) | 98 | 97 | 94 | 92 | 90 |
| Glukosekonzentration (mg/ml) | 0.3 | 0.45 | 0.9 | 1.2 | 1.5 |
Label and fill six test tubes as specified in Table 2.
| Probennummer | Blank | 1 | 2 | 3 | 4 | 5 |
|---|---|---|---|---|---|---|
| Glukosestandard (Flasche) | N/A | A | B | C | D | E |
| Volumen Glukosestandard (ml) | 0 | 1 | 1 | 1 | 1 | 1 |
| Volumen DNSA-Reagens (ml) | 1 | 1 | 1 | 1 | 1 | 1 |
| Volumen destilliertes Wasser (ml) | 3 | 2 | 2 | 2 | 2 | 2 |

Kalibrationslösungen
Mit freundlicher Genehmigung
von Irena Štrumbelj Drusany
- Teströhrchen mit Inhalt 5 min in kochendem Wasser erhitzen; das DNSA-Reagens reagiert mit in der Probe vorhandenen reduzierenden Zuckern zu einem rotbraunen Produkt.
- Teströhrchen abkühlen, je 6 ml destilliertes Wasser zugeben und gut schütteln.
- Messung der Lichtdurchlässigkeit jeder Lösung mit der blauen LED (430 nm) des Fotometers.
Die vom Spektra-Gerät abgelesenen Werte ist die Durchlässigkeit in Prozent. Sie müssen durch 100 dividiert werden, um die Werte für die Durchlässigkeit für die nachfolgenden Berechnungen zu erhalten. Die Durchlässigkeit (T) lässt sich nach folgender Formel in die Absorption (A) umrechnen: A = –log T. Siehe 2. und 3. Spalte in Tabelle 3.
Das Bild rechts zeigt die Kalibrationslösungen; Sogar der Blindwert (Wasser mit DNSA ohne Glukose) hat eine intensive Färbung. Es ist daher notwendig, alle Proben, auch den Blindwert, gegen destilliertes Wasser zu messen. Die durch die Glukose verursachte Absorption der Proben kann durch Subtraktion der Absorption des Blindwerts von der Absorption der Probe ermittelt werden (siehe 4. Spalte in Tabelle 3).
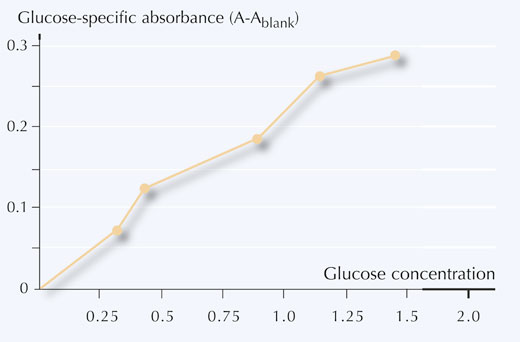
6. Diagramm erstellen: Glukosekonzentration versus Glukose-spezifischer Absorption, siehe Abbildung 5.
Messung der Konfitüreproben
Die Konfitürenprobe sollte genauso behandelt werden wie die für die Kalibrationskurve eingesetzten Glukosestandards.
- Für jede zu testende Konfitüre 1 ml vorbereitete Konfitürenprobe (siehe “Herstellung von Lösungen”) in ein Teströhrchen geben, 1 ml DNSA-Reagens und 2 ml destilliertes Wasser zugeben.
- Proberöhrchen mit Inhalt 5 min in kochendem Wasser erhitzen; das DNSA-Reagens reagiert mit den in der Probe vorhandenen Zuckern unter Bildung eines rotbraunen Produkts.
- Abkühlen der Teströhrchens, 6 ml destilliertes Wasser zugeben und gut schütteln.
- Messung der Durchlässigkeit (T%) jeder Koniftürenprobe mit der blauen LED (430 nm) des Photometers. Durch 100 dividieren, um T zu erhalten. Mit der Gleichung; A = –log T T in A umrechnen, diesen Wert zur Errechnung der Glukose-spezifischen Absorption heranziehen (A – ABlindwert).
Tabelle 4 zeigt ein Beispiel für ermittelte Werte für die Durchlässigkeit und die daraus errechneten Glukose-spezifische Absorption der Proben.
| Probe | Durchlässigkeit (Messwerte des Spektra-Geräts, T%) |
Absorption (A) |
Glukose-spezifische Absorption (A – ABlindwert) |
|---|---|---|---|
| 1 | 18.6 | 0.73 | 0.17 |
| 2 | 21.3 | 0.67 | 0.11 |
- Die Absorptionsmesswerte mit Hilfe der Kalibrationskurve in Glukosekonzentrationen (mg/ml) der Probe umwandeln.
Das in Tabelle 4 verwendete Beispiel ergäbe eine abgelesene Glukosekonzentration von:
Probe 1: 0.8 mg/ml
Probe 2: 0.5 mg/ml
6. Errechnung der Masse der Glukose in 1 g Konfitüre unter Verwendung folgender Gleichung:Masse der Glukose (g pro 1 g Probe) = Massenkonzentration (mg/ml) x 10 x 100 ml
wobei
die Massenkonzentration der in der Kalibrationskurve abgelesene Wert ist
10 die Verdünnung angibt (siehe “Herstellung von Lösungen)
100 ml das Volumen, in dem 1g Konfitüre homogenisiert worden ist.
In unserem Beispiel:
Probe 1: Masse der Glukose (g pro 1g Probe) = 0,8 mg/ml x 10 x 100 ml = 0,8 g
Probe 2: Masse der Glukose (g pro 1g Probe) = 0.5 mg/ml x 10 x 100 ml = 0,5 g.
Alle Berechnungen gehen von der Annahme aus, dass 1 g Probe eingewogen worden sind. Wenn man z.B. 2g Probe einwiegt, muss man die Zahlen von oben durch 2 dividieren um die Masse der Glukose in g pro g Probe zu erhalten.
Reduzierende und nicht-reduzierende Zucker
Aus chemischer Sicht ist ein reduzierender Zucker eine Aldose, z.B. Glukose, dessen Aldehydgruppe zu einer Carbonsäure oxidiert werden kann. Die gebräuchlichere Methode reduzierende Zucker zu messen ist sie mit Benedict´schem Reagens oder Fehling´scher Lösung zu erhitzen. Beide enthalten Kupfer(II)-Ionen, die zu Kupfer(I)oxid reduziert werden und einen braun-orange Niederschlag ergeben.
Nicht-reduzierende Zucker wie die Saccharose haben statt der Aldehyd- eine Ketogruppe als funktionelle Gruppe, die durch Kupfer(II)-Ionen nicht reduziert werden kann. Wenn diese mit Benedict´schem Reagens oder Fehling´scher Lösung behandelt werden, bleibt die Bildung eines gefärbten Niederschlags aus.
Danksagung
Die Autoren danken der Generaldirektion Bildung und Kultur der Europäischen Kommission für die finanzielle Unterstützung des Projekts, das einen praktischen Zugang zur Analytischen Chemie für berufsbildende Schulen II (AnalChemVoc II, LLP-LDV-TOI-2008-SI-15) legen will. Es wurde über das Leonardo da Vinci Programm gefördert.
References
- Gros N (2004) Spectrometer with microreaction chamber and tri-colour light emitting diode as a light source. Talanta 62: 143-150. doi: 10.1016/S0039-9140(03)00420-X
- Gros N, Vrtačnik M (2005) A small-scale low-cost gas chromatograph. Journal of Chemical Education 82: 291-293. doi: 10.1021/ed082p291
- Miller GL (1959) Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analytical Chemistry 31: 426-428.
- Der Artikel kann kostenlos von der Homepage der American Chemical Society herunter geladen werden: http://pubs.acs.org/doi/pdf/10.1021/ac60147a030
Web References
- w1 – Weitere Informationen zum Projekt: www.kii2.ntf.uni-lj.si/analchemvoc2/file.php/1/HTML/experiments.htm
- w2 – Das Spektra-Gerät ist bei Laboratorijska tehnika Burnik erhältlich: www.lt-burnik.si/index.php?newlang=english
- w3 – DasChemLabS der Universität Bristol (www.chemlabs.bris.ac.uk) verleiht eine begrenzte Zahl von spectra Photometern an Lehrer/innen, die mit ihren Schüler/innen Versuche ausprobieren oder neue praktische Anwendungen entwickeln möchten. Interessierte Lehrkräfte können sich an . Tim Harrison (t.g.harrison@bristol.ac.uk).
- w4 – Weitere Informationen über Mystrica Kolorimeter finden sich unter: http://mystrica.com/Colorimeter.aspx. Diese Webseite beschreibt auch verschiedene geeignete Experimente; herausragend sind jene mit enzymatischen Reaktionen.
Review
Die Analytische Chemie ist sehr stark auf spektroskopische Analysen angewiesen. Professionelle Geräte sind teuer, und daher in normalen Schulen in vielen Ländern nicht vorhanden. Der Artikel stellt ein von einer der Autoren/innen entwickeltes Photometer vor, mit dem fotometrische Analysen für jede Schule der Sekundarstufe leistbar werden. Die Projektwebseite beschreibt verschiedene fotometrische Schulversuche, dieser Artikel enthält die Arbeitsanleitung für eines dieser Experimente.
Die hier vorgestellten Aktivitäten eignen sich für die Einführung der analytischen Chemie in den Naturwissenschaftsunterricht (nicht nur in Chemie, sondern auch in Biologie und Umweltkunde), vor allem für Schulen der Sekundarstufe, die über kein gut ausgestattetes Labor verfügen. Die vorgeschlagene Vorgangsweise ist einfach und geeignet Lehrer/innen und Schüler/innen anzuregen, Versuche auszuführen, und neue auszuprobieren.
Lehrende können den Artikel verwenden, um das methodische Prinzip der Fotometrie und die Theorie fotometrischer Messungen zu besprechen. Die experimentelle Analyse erlaubt es, Ergebnisse mit mathematischen Methoden zu generieren, und vereint dadurch Chemie und Statistik.
Der Artikel eignet sich auch für eine umfassende Aufgabenstellung. Zum Beispiel:
- Fülle folgende Tabelle mit Hilfe der Anleitung zur Erstellung einer Kalibrationskurve vollständig aus:
Kolben A B C D E Volumen des Glukosestandards (ml) 2 4 6 8 10 Volumen destilliertes Wasser (ml) 98 97 94 Glukosekonzentration (mg/ml) 0.3 1.2 1.5
Giulia Realdon, Italien





