Еволюция на човека: молекулярен анализ Understand article
Превод Роберт Пенчовскси (Robert Penchovsksi). Във втората от две статии Ярек Брик (Jarek Bryk) описва как учените анализират в дълбочина нашите гени, за да разкрият…

Henrik500 / iStockphoto
ДНК на всеки организъм съдържа информация за неговата скорошна и отдалечена еволюционна история. Чрез изследване на модели и промени в последователността на ДНК – сравнявайки еднакви последователности при различните индивиди или видове – ние можем да открием това, което се е случило с тях. Можем да разкрием кои гени или фрагменти от генома има вероятност да са дали предимство на съдържащите ги индивиди и видове, което е позволило по-лесното им оцеляване и размножаване (вж речника в края).
В предишна своя статия (Bryk, 2010), описах няколко примера за генетични промени в човешкия и в други организмир които им носят предимство. Демонстрирането на това кои генетични промени биха могли да бъдат полезни е трудно – особено при човека – но още по-голямо предизвикателство е да се демонстрира механизмът, чрез които тези промени могат да подобрят оцеляването и възпроизводството на организма.
В тази статия представям един от подходите, прилагани от учените, на първо място за да идентифицират участъци от нашия геном, които е възможно да са ни помогнали да оцеляваме и да се възпроизвеждаме. След това би могло още да се провери как тези участъци евентуално са предоставили на предците ни определено предимство.
Един от начините, чрез които потенциално полезни участъци от генома може да бъдат установени, е просто да се сравнят ДНК- последователностите на много индивиди от различни популации. В един много прост сценарий, ако една от тези популации е била под селективен натиск (например, високо ултравиолетово лъчение в слънчев район), който е отсъствал при други популации, ДНК- последователността отговорна за подходящата адаптация (например, по-тъмен цвят на кожата), би трябвало да е различна.
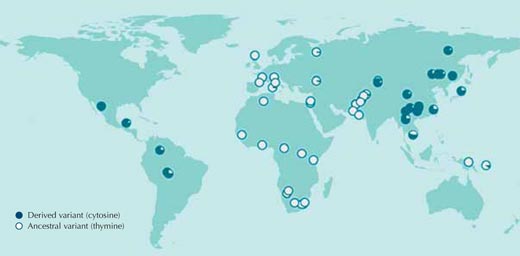
Адаптирана с разрешението на Macmillan Publishers Ltd: Nature, Sabeti et al. (2007), © 2007
В по-голямата част от случаите обаче, ние не знаем на какъв селективен натиск са били подложени популациите в миналото или кои генетични последователности са отговорни за адаптацията. Следователно, нека да започнем със сравняване на ДНК- последователностти между човешки популации, без никакви предположения за това, което може да открием. Фиг. 1 показва едно такова сравнение за единичен нуклеотид от човешкия геном.
Когато различни индивиди имат различни нуклеотиди в определена позиция в ДНК-последователността, наричаме това единичен нуклеотиден полиморфизъм (ЕНП); три милиона такива варианти на човешкия геном са каталогизирани в общодостъпната “hapmap” база данниw1. ЕНП, показан на фиг.1, и обозначен като рс3827760, е открит в два варианта или алела: на тази позиция в секвенцията може да бъде открита една от двете бази – или тимин (Т), или цитозин (С).
Всяко кръгче на фигурата представлява една популация и изобразява честотата в тази полулация на двата възможни алела.
Тимин-съдържащият алел присъства във всички африкански и повечето европейските проби, но почти изцяло липсва в Източна Азия и Северна и Южна Америка, където цитозин е преобладаващ на тази позиция в ДНК (Sabeti et al., 2007, 2006; Xue et al., 2009).
Ако направим това сравнение за всички други три милиона ЕНП- протеини с помощта на базата данни от hapmap -системата, ще видим, че разпределението на рс3827760– варианта сред различните човешки популации е много необичайно. Следователно, рс3827760 определено заслужава по-подробно изследване, въпреки че разпределението не ни казва нищо за потенциалната полза от тези варианти (т.е. за тяхната aдаптивна стойност), или дори дали те изобщо са адаптивни Всичко, което знаем засега е, че поради някаква причина, оригиналният тимин, присъствал на тази позиция в прародителските популации в Африка се е променил на цитoзин и се е разпространил в Източна Азия, Северна и Южна Америка. Даже и преценките за това кога е станала тази промяна са много неточни: някога преди 1000 до 70 000 години, всички индивиди в популациите от Югоизточна Азия са имали цитозиновия вариант.
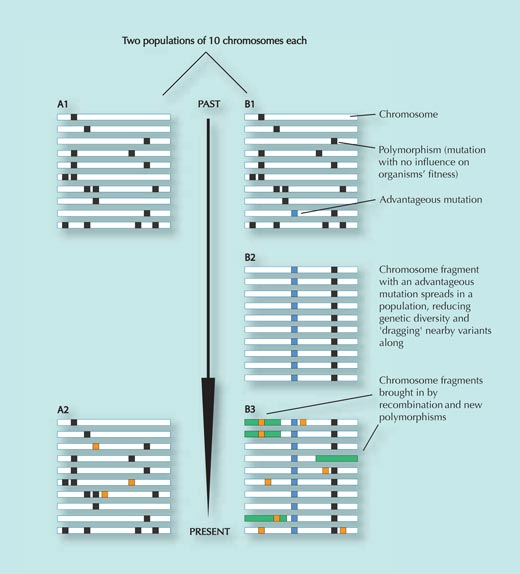
Популация А не е подложена на положителен селективен подбор и остава относително непроменена във времето, с изключение на придобиването на някои случайни генетични промени, които не влияят на приспособимостта. (оранжевите квадрати в панел А2; вариантите, които намаляват приспособимостта, се отстраняват от популацията) – сравнете панели А1 и А2.
Популация В се премества в нова среда, където тя е изправена пред нов селекционен натиск. В тази нова среда определена генетична промяна (сините квадрати в група В1) дава предимство на индивидите, които я носят и тя се разпространява бързо сред популацията (индивидите – нейни носители оставят по-голямо поколение). Генетичните варианти в близост до избрания ЕНП се пренасят заедно с него (колкото по-близо са два варианта, толкова по-малка е възможността те да бъдат разделени по време на рекомбинацията, когато части от ДНК се обменят между майчините и бащините хромозоми – виж фиг. 3).
В резултат на това бързо разпространение на ДНК- последователността сред популацията се намалява генетичното разнообразие в този район; повечето индивиди ще имат даващия предимство ЕНП заедно с генетични варианти в близост до него (сравнете панели B1 и B2). Този процес протича бързо.
След известно време обаче, новите генетични промени и рекомбинационни събития въвеждат нови варианти (зелените правоъгълници и оранжевите квадратчета в група B3). Колкото по-дълго време е минало от възникването на оригиналния селектиран вариант, толкова по-трудно е той да се открие, защото моделът на намалено разнообразие (B2) евентуално ще бъде маскиран (B3)
С любезното съдействие на Ярек Брик
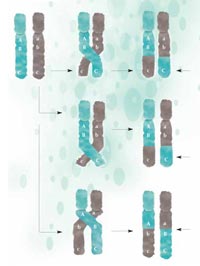
рекомбинация части от ДНК
се обменят между
майчините (зелени) и
бащините (сиви) хромозоми
и се предават на
следващото поколение в
нова конфигурация.
Колкото по-близо се
намират два участъка,
толкова по-малка е
вероятността те да се
разделят по време на
рекомбинация: А и В са
сближени помежду си
повече, отколкото B и C;
затова вероятността А и В да
се разделят е по-малка,
отколкото тази за В и С.
Увеличи снимката
С любезното съдействие на
Никола Граф (Nicola Graf)
Как тогава да решим дали този модел е възникнал вследствие на положителна селекция (т.е., че цитозинът е осигурил предимство в Източна Азия , Северна и Южна Америка), или това се дължи просто на случайност? За да видим дали ДНК-мутацията (замяната на тимин с цитозин) е в резултат на положителна селекция, ние изследваме ДНК- последователността, съдържаща ЕНП. Ако ДНК- последователността около рс3827760 е подобна във всички групи от населението, тогава ние няма да разполагаме с доказателства, че ЕНП оказва въздействие върху Приспособимост на организма. Ако обаче една популация (в Източна Азия, например) е изложена на позитивен подбор ирс3827760 допринася за развитието на адаптация към този селективен натиск, ДНК- последователностите около ЕНП ще се различават между различните популации. За да разберете защо е така вижте фиг 2.
Когато ДНК- последователностите околорс3827760 се сравняват, става ясно, че разнообразието около цитозиновия вариант в населението на Източна Азия е наистина много по-ниско от разнообразието около тиминовия вариант, открито в населението на Африка и Европа (американците не са тествани). Това предполага, че положителният подбор е бил отговорен за разпространението на цитозиновия вариант в източноазиатското население. Но дали този ЕНП наистина е селектиран – има ли той в действителност някаква функция?
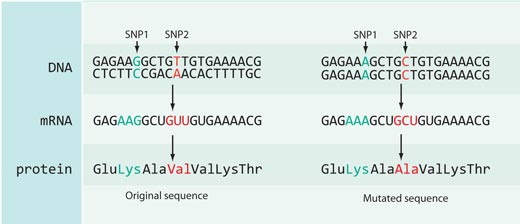
Не всички промени в ДНК оказват ефект върху протеиновите последователности: повечето ЕНП-протеини, описани в базата данни, или се намират в некодиращи части от генома (например, между гени) или са синоними – т.е. те се намират в кодиращата част на генома, но не водят до промяна в протеина, кодиран от последователността (вж. фиг. 4).
С любезното съдействие на Ярек Брик
В случая с рс3827760 ние имаме шанс, защото той се намира в кодиращата част на ген – към края на ген, наречен EDAR, който участва в развитието на космените фоликули, потните жлези и зъбите. Освен това, тимин-цитозиновата ДНК мутация води до промяна на протеиновата последователност: Африканците и европейците (които носят ЕНП вариант с тимин) имат аминокиселината валин на позиция 370 в протеина, докато източно-азиатците и американците (с нуклеотида цитозин) са с аминокиселината аланин. фиг. 5). Това категорично показва, че една аминокиселинна промяна в 370-а позиция не само води до промяна в последователността на протеина, но също така засяга и физическите характеристики на самия организъм.
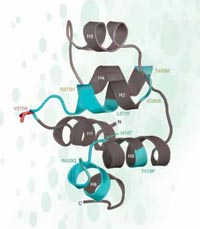
структура на част от
кодирания от EDAR протеин.
Мутациите, маркирани в
зелено, предизвикват
ектодермална дисплазия
при хората.
Предполагаемият
селектиран ЕНП е маркиран
в червено
Адаптирана с разрешението
на Macmillan Publishers Ltd:
Nature, Sabeti et al. (2007), ©
2007
За да видим дали промяната в протеиновата последователност наистина влияе върху неговата функция, ние се насочваме към експеримента върху биохимичните пътища, в които участва кодираният от EDAR-гена белтък. Това са серия от реакции, които са свързани с развитие на космените фоликули, потните жлези и зъбите. Когато тези реакции са извършени в лаборатория, за аланиновия вариант на протеина (срешащ се в източноазиатци и американци, кодиран от цитозиновия вариант на ЕНП) беше установено, че той прави биохимичния път по-активен от валиновия вариант (при африканци и европейци). Това се вписва в сравнението на структурата на косъма, което показва, че хората с аланиновия вариант са с по-дебели косми, отколкото хората с валиновия вариант. За по-пряка демонстрация мишки бяха генетично модифицирани с цел повишаване на активността на EDAR- пътя. Тези мишки са видимо с по-гъста козина и с по-дебел косъм, както и с по-големи слюнчени жлези, отколкото мишките с нормална EDAR- активнос (Chunyan et al., 2008; Chang et al., 2009).
Взети заедно, тези констатации показват, че двата варианта на ЕНП (съдържащи респ. тимин или цитозин, може да се отразяват както на структурата, така и на функцията на кодирания от EDAR белтък. Това може да доведе до физически различия в хората – в дебелината на косата и евентуално в размера на слюнчените жлези.
Разликите в ДНК, които наблюдаваме в момента, са исторически записи на природен експерименти. Ние можем само да гадаем за селекционния натиск, упражнен върху азиатското и американското население, който е довел до разпространението на цитозиновия алел. Комбинацията от геномни изследвания, лабораторни експерименти и животински модели дава възможност за тестване на хипотези за функционалните роли на генетичните различия между популациите или видовете. Използването на тези подходи, може да разкрие молекулярната основа на последните изменения в нашите предци и в други организми, подчертавайки как се адаптираме към непрекъснато променящата се околна среда.
Речник
Адаптивна стойност: един белег има адаптивна стойност, ако прави индивидите по-способни да оцелеят и да се размножават в дадена среда в сравнение с тези, които нямат този белег. Накратко, белегът е адаптивен, ако увеличава приспособимостта.
Приспособимост: труден за дефиниране термин от еволюционната биология и популационната генетика, който описва средния брой потомци от една генерация, асоцирана с един генотип в сравнение с друг генотип в популацията. Следователно, генотиповете, които имат по-голямо поколение, имат и по-голяма приспособимист.
Геном: обикновено това е цялата ядрена ДНК на един еукариотен организъм, за разлика от ДНК в митохондриите и хлоропластите .За повече информация вж “What is the genome” в уеб-сайт Медицина на Националната библиотека на САЩ (US National Library of Medicine уебсайт)w2.
Позитивна селекция: естествената селекция е един от механизмите на еволюцията; тя описва различията между индивидите по отношение на тяхното оцеляване и възпроизводство в дадена среда. Естествената селекция е позитивна, когато помага на индивиди с определени характеристики да оцелеят и да се размножат по-добре от други индивиди.
Селективен подбор: характеристика на средата (например температура, наличие на паразити, хищници или агресия от членове на собствения вид), която обуславя разлика в оцеляването и репродукцията на индивидите.
ЕНП: единичен нуклеотиден полиморфизъм, или единична буква в ДНК- последователността, която е различна в различните индивиди.
References
- Bryk J (2010) Естественият отбор на молекулярно равнище. Science in School14: 58-62.
- Chang SH et al. (2009) Enhanced EDAR signalling has pleiotropic effects on craniofacial and cutaneous glands. PLoS ONE 4(10): e7591. doi:10.1371/journal.pone.0007591
- Тази статия описва фенотипа на различни жлези при мишка с акцент върху EDAR-сигнализацията, с разсъждения кои белези са били селекционилани положително в историята на човека. Статията е на свободен достъп в journal website: www.plosone.org
- Chunyan M et al. (2008) Enhanced ectodysplasin-A receptor (EDAR) signaling alters multiple fiber characteristics to produce the East Asian hair form. Human Mutation 29(12): 1405-1411. doi: 10.1002/humu.20795
- Tази статия детайлизира in vitro – проучванията на EDAR и на трансгенната мишка, с много хубави снимки и картини.
- Pongsophon P, Roadrangka V, Campbell A (2007) Counting Buttons: demonstrating the Hardy-Weinberg principle. Science in School 6: 30-35.
- Sabeti PC et al. (2006) Positive natural selection in the human lineage. Science312(5780): 1614-20. doi: 10.1126/science.1124309
- Tова е един отличен обзор на различните методи, използвани за изследване на положителната селекция от перспективна гледна точка на геномиката.
- Sabeti PC et al. (2007) Genome-wide detection and characterization of positive selection in human populations. Nature 449: 913-918. doi: 10.1038/nature06250
- Снемете статията безплатно тук, или още днес се абонирайте за Nature:www.nature.com/subscribe
- Tази статия описва един от подходите за разширени геномни проучвания върху положинтелната селекция.
- Xue Y et al (2009) Population differentiation as an indicator of recent positive selection in humans: an empirical evaluation. Genetics 183(3): 1065-77. doi:10.1534/genetics.109.107722
- Tази статия съдържа обсъждане относно EDAR и други подобни гени. Тя е на свободен достъп чрез PubMed Central: www.ncbi.nlm.nih.gov/pmc или чрез използване на директния линк: http://tinyurl.com/26xte2h
Web References
- w1 –HapMap – название на партньорски проект между учени и агенции за финансиране от Канада, Китай, Япония, Нигерия, Великобритания и САЩ за разработване на обществен ресурс, който ще спомогне за откриването на гени и лекарства, свързани със заболявания при човека. виж: www.hapmap.org
- w2 – За повече информация относно геномите и Проекта Човешки Геном виж ‘What is a genome’ в US National Library of Medicine website:http://ghr.nlm.nih.gov/handbook/hgp/genome
Review
Въпреки цялото наше познание за секвенцията на човешкия геном , точната функция на големи сегменти от него, както и отговорът на въпроса как и защо ДНК се е променяла на популационно равнище, все още остават в голямата си част неизяснени. Еволюциона адаптация при човека очевидно е имало, но това е много трудно да бъде демонстрирано. Тази статия описва как е било идентифицирано едно такова еволюционно изменение. Експерименти с генетично модифицирани мишки са показали как промяната на една база в ДНК, която видоизменя аминокиселинната последователност на един протеин, води до промени в структурата и функцията на този белтък. Това може да има като последица вариации във фенотипа.
В часовете по биология тази публикация би могла да бъде полезна, когато се обсъждат теми относно използването на генетичния код и неговата изроденост, структурата и функцията на протеините, а така също – популационната генетика. Статията може да бъде използвана и като основа при изучаване на вариациите в човешката популация или като отправна точка при запознаване с Проекта за човешкия геном.
Учениците могат да дискутират еволюционните предимства като се позовават на някоя вариация, описана в тази статия. Това би довело до дискусия за селекцията, популационната генетика и уравненията на Харди-Вайнберг. В допълнение на тази дискусия има един отличен материал в бр.6 на ScienceinSchool (Pongsophon et al., 2007).
Подходящите изчерпателни въпроси включват:
- С ваши думи дайте един пример извън текста, който да описва какво е ЕНП (SNP).
- Обяснете значението на ЕНП (SNPs).
- За кодирането на коя аминокиселина служи нуклеотидния триплет GTT?
- Опишете промените, намерени в мишка с генетично модифициран EDAR – път и предложете начини, чрез които наблюдаваните промени могат да бъдат измерени количествено.
Шели Гудман, Великобритания (Shelley Goodman, UK)





