Supporting materials
Der Bau eines Rasterkraftmikroskops in der Schule (Word)
Der Bau eines Rasterkraftmikroskops in der Schule (Pdf)
Download
Download this article as a PDF

Übersetzt von Hildegard Kienzle-Pfeilsticker. Wäre es nicht faszinierend, einzelne Moleküle zu beobachten und unter dem Mikroskop zu beeinflussen? Patrick Theer und Marlene Rau vom European Molecular Biology Laboratory erklären, wie man das mit einem Rasterkraftmikroskop anstellen kann. Es…
Seit über hundert Jahren begeistern sich Wissenschaftler für die Idee, einzelne Moleküle oder Atome zu beobachten. Dieses ehrgeizige Ziel wurde zum ersten Mal 1981 mit der Erfindung des Rastertunnelmikroskops erreicht, wofür Gerd Binnig und Heinrich Rohrer vom IBM Forschungslabor in Rüschlikon in der Schweiz einige Zeit später, 1986, den Nobelpreis für Physik verliehen bekamenw1. Dieses Mikroskop hat jedoch einen schwerwiegenden Nachteil: Es funktioniert nur mit elektrisch leitenden Objekten, so dass viele interessante Materialien, wie Biomoleküle nicht untersucht werden konnten. Binnig und seine Kollegen suchten weiter nach besseren Lösungen und stellten 1986 das Rasterkraftmikroskop vor (AFM von englisch atomic force microscope), mit dem sowohl leitende als auch nicht-leitende Materialien dargestellt werden können.

Das Instrument ähnelt einem Schallplattenspieler bei dem eine spitze Nadel eine Vinyl-Platte abtastet, um den Ton zu erzeugen (siehe das Bild rechts). Das AFM „spürt“ die Atome eher als dass es sie „sieht“: Die Oberflächenstruktur wird mit einem spitzen Konus abgetastet (er besteht typischerweise aus Silicon oder Siliconnitrid), der sich am Ende eines flexiblen Hebelarms befindet. Dieser kann die kleinsten Änderungen auf der Oberfläche erfassen. Wenn die Spitze aus einem kleinen Atom sich der Probenoberfläche nähert, wird sie durch Kräfte zwischen den beiden abgelenkt: das können mechanische Kräfte durch den Kontakt sein, Van-der-Waals-Kräfte, Kapillarkräfte, chemische Bindungskräfte, elektrostatische Kräfte, magnetische Kräfte, Casimir-Kräfte, Solvatationskräfte oder andere, je nach Probe.
Weil mit dem AFM diese Vielfalt an Kräften gemessen werden kann, ist es sehr vielseitig und wird inzwischen von sehr vielen Wissenschaftlern genutzt – meist aber nicht immer in den Materialwissenschaften und in der Biologie. In jedem Fall ist die Kraft, die die Ablenkung erzeugt, klein und proportional zum Abstand der Spitze von der Oberfläche.
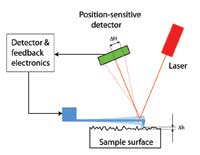
Wie kann man diese kleinen Auslenkungen messen? Die Erfinder machten sich einen cleveren Trick zunutze: ein Laserstrahl wird auf die Spitze des Hebelarms gerichtet. Von dort wird er auf einen Lichtdetektor reflektiert, der die Position feststellen kann. Die Änderung der Position des Laser-Lichtspots im Detektor (siehe linkes Diagramm, ∆H) aufgrund der Ablenkung des Hebelarms (siehe das Diagramm auf Seite 61, ∆h) ist proportional zum Abstand zwischen Detektor und Hebelarm. Sind die Abstände zwischen ihnen groß genug, können sogar winzige Ablenkungen gemessen werden. So kann man Oberflächenstrukturen Atom für Atom untersuchen.

Es gibt unzählige Anwendungen für das AFM. Gehen wir nur einige von ihnen durch. Ursprünglich wurde das AFM für die Beobachtung und Analyse von winzigen Oberflächenstrukturen entwickelt – das ist nicht nur zu Forschngszwecken interessant, sondern es kann direkte ökonomische Vorteile bieten: Biofouling meint die unerwünschte Ansammlung von Mikroorganismen, Pflanzen, Algen und/oder Tieren (wie Rankenfußkrebse, Cirripedia) auf feuchten Untergründen. Viel Bewuchs kann auf Schiffsrümpfen den Wasserwiderstand und dadurch den Kraftstoffverbrauch erheblich erhöhen. Biofouling spielt aber auch eine Rolle in Membranbioreaktoren, Kühlkreisläufen von Kraftwerken und bestimmten Ölpipelines. Wissenschaftler nutzen das AFM, um das Ausmaß von Biofouling zu messen und so Substanzen gegen Biofouling zu vergleichen, um die beste Substanz zu ermitteln (Finlay et al., 2010).

Auf ähnliche Weise wird das AFM in der Landwirtschaft genutzt: Ananasplantagen leiden oft unter einer Pilzkrankheit namens Fusariose. Wissenschaftler verglichen die Oberflächenstrukturen der Zellen von Ananassorten, die resistent gegen diese Krankheit sind, mit denen von anfälligen Sorten und fanden, dass sie unterschiedliche mechanische Eigenschaften haben. Dies kann nun für die Selektion und Verbesserung von resistenten Sorten mit den nötigen mechanischen Eigenschaften genutzt werden (de Farias Viégas Aquije et al., 2010).
Spielen Oberflächenstrukturen auch eine Rolle für die menschliche Geundheit? Die Antwort lautet: Ja. AFM-Studien werden oft in der Zahnheilkunde durchgeführt, beispielsweise, um die Effektivität verschiedener Methoden der Entfernung von Plaques und Verfärbungen zu vergleichen; um die Oberflächenrauigkeit von Zahnspangen zu messen und zu erkennen, wie diese den Erfolg korrekter Zahnstellung beeinflusst; oder um die Erosion des Zahnschmelzes durch Säure in Softdrinks zu messen und die Wirksamkeit verschiedener Zahnpasten zur Reparatur dieser Beeinträchtigung zu testen (Kimyai et al., 2011; Lee et al., 2010; Poggio et al., 2010).
Weitere Anwendungen sind die Entwicklung von neuen Biomaterialien in der regenerativen Medizin: ihre Oberflächeneigenschaften wie Benetzbarkeit, Rauigkeit, Oberflächenenergie, Oberflächenladung, chemische Eigenschaften und Zusammensetzung können das Verhalten der Zellen, mit denen sie in Kontakt kommen, steuern. Daher kann das AFM beispielsweise für die Konstruktion von Biomaterialien genutzt werden, die vom Körper toleriert werden und für medizinische Implantate wie künstliche Hüften (Al-Ahmad et al., 2010; Kolind et al., 2010; Padial-Molina et al., 2011).
Ein weiteres größeres Anwendungsgebiet für AFM in der medizinischen Biologie beschäftigt sich mit der Fehlfaltung oder Aggregation von Proteinen wie α-Synuclein, Insulin, Prionen, Glucagon and β-Amyloid. Von diesen Phänomenen ist schon lange bekannt, dass sie eine Rolle bei degenerativen Erkrankungen wie Typ-II-Diabetes, Parkinsonscher Krankheit, spongiformer Enzephalopathie (Rinderwahnsinn) und Alzheimer-Krankheit spielen. Hierzu hat das AFM bereits mit wichtigen Informationen über die nanoskaligen Strukturen der Aggregate beigetragen und man hofft, dass Wissenschaftler mit Hilfe des AFM aufdecken können, warum sich das Protein zuerst falsch faltet und warum es umgebende Proteine dazu bringt, dieselbe fehlgefaltete Struktur anzunehmen (Lyubchenko et al., 2010; eine Erklärung für Prionen-Fehlfaltung findet man unter Tatalovic, 2010).

Zu den weiteren biologischen Interaktionen, die mit dem AFM untersucht wurden, gehört die Interaktion menschlicher Trophoblasten (der Zellen, die die äußere Schicht der Blastozyste bilden, den Embryo mit Nährstoffen versorgen und später einen großen Teil der Plazenta bilden) mit Epithelzellen des Uterus – die Basis erfolgreicher Einnistung des Embryos (Thie et al., 1998).
Es war nur ein kleiner Schritt von der Verwendung des AFM für Beobachtungszwecke bis zur Manipulation von Atomen, Molekülen oder anderen nanoskaligen Strukturen. Benutzt man beispielsweise die Spitze als Nanopinzette, kann man ganz bestimmte Regionen der zellulären Plasmamembran untersuchen; einzelne Proteinschleifen können entfernt werden, um die Proteinstruktur innerhalb des Moleküls freizulegen; und einzelne Moleküle können in neue Konformationen gezogen werden, um ihre Elastizität zu bestimmen.
Der nächste große Schritt wird sein, das AFM für die Nanochirurgie einzusetzen: Dabei geht es um die Einführung oder Extraktion einzelner Moleküle in das bzw. aus dem Zytoplasma von einzelnen Zellen, um die zelluläre Homöostase oder subzelluläre Medikamentenabgabe zu untersuchen (Lamontagne et al., 2008; Müller et al., 2006).
Modifizierte AFM-Spitzen können auch als Bohrer oder Stifte benutzt werden: Nano-Fräsen entfernen Material in Form von langen Spiralen (Gozen & Ozdoganlar, 2010), wohingegen die Dip-Pen-Nanolithographie die kontrollierte Abgabe von molekularer flüssiger „Tinte“ bedeutet. Diese Technologie wird in der Chemie und den Life Sciences genutzt, um Sensoren im Nanobereich zu produzieren oder durch Metalldeposition Halbleiter und Metalloxidnanostrukturen, funktionsfähige Nanoschaltkreise oder Nanobauelemente herzustellen (Basnar & Willner, 2009). Diese Anwendungen sollten, zusammen mit einer AFM-Spitze, die Partikel in Nanometergröße an eine gewünschte Position bugsiert, den Weg ebnen für die Miniaturisierung elektronischer Schaltkreise und anderer Strukturen.
Trotz dieser enorm großen Zahl an Anwendungen – die aufgezählten sind nur ein kleines Beispiel – sind die Einsatzmöglichkeiten für das AFM noch nicht ausgereizt. Zu den zukünftigen Trends gehören optimierte Spitzen und die Kombination mit anderen Techniken, beispielsweise die gleichzeitige Bestimmung der Oberflächenstruktur und der Fluoreszenz oder der elektrischen Eigenschaften (Müller et al., 2006). Geschwindigkeit ist ein anderes Thema: neulich wurde ein AFM entwickelt, mit dem man biologische Prozesse wie Replikation der Chromosomen und ihre Segregation, Phagozytose und Proteinsynthese in Echtzeit dargestellt werden können und das bis zu 1000mal schneller als bisher möglich (Ando et al., 2008).
Sind Sie schon ganz begierig auf Ihre eigene AFM-Anwendung? Dann möchten Sie vielleicht versuchen Philippe Jeanjacquots Anweisungenw2 für den Bau eines eigenen Instruments an der Schule zu folgen. Das Projekt kostet viel Zeit, aber er und seine Schüler haben es hingekriegt, mit geringen Kosten ein Mikroskop zu bauen. Es gibt nur einen Haken: man braucht eine vibrationsfreie Umgebung für seinen Aufbau, einen ruhigen Keller etwa. Findet man eine ruhige Umgebung, sind die einzigen Limitierungen der eigene Enthusiasmus und und Einfallsreichtum.
Dieser Artikel würde sich für eine ganze Reihe von Wissenschaftsunterrichtsstunden eignen – nicht nur für Physik, sondern beispielsweise auch für die Behandlung der Tierphysiologie oder der biomedizinischen Wissenschaft. Schüler können Rasterkraftmikroskopie und seine Anwendung weiter recherchieren, da im Internet sehr viel Material über Vorteile und Nachteile verschiedener Mikroskopiertechniken zu finden ist. Sie könnten die Gruppe von Wissenschaftlern nachschlagen, die das Rasterkraftmikroskop erfunden haben (nachdem sie einen Nobelpreis für eine frühere Erfindung gewonnen hatten) und mehr über sie und ihre Arbeit herausfinden.
Zu möglichen Verständnisfragen gehören:
Der Artikel könnte mit Gruppen älterer Schüler verwendet werden oder solchen, die am ehesten zu kreativem Denken fähig sind, vielleicht für eine erweiterte schriftliche Aufgabe in Verbindung mit dem Film Honey I Shrunk the Kids (über einen Wissenschaftler der an einer streng geheimen Maschine arbeitet, die Objekte und – aus Versehen – Menschen verkleinert), um die Schüler dazu zu bringen, über die Betrachtung einzelner Moleküle nachzudenken. Wofür würden sie gerne ein AFM einsetzen? Würden sie ihre Bilder eher zu künstlerischen oder wissenschaftlichen Zwecken einsetzen? Würden sie ihr Wissen zur Heilung von Krankheiten einsetzen wollen oder um zu erkennen, wie schön Wissenschaft auf diesem Niveau sein kann?
Jennie Hargreaves, Großbritannien