Maîtriser les maladies génétiques Understand article
Traduit par Aurélie Bardaji. Sabine Hentze et Martina Muckenthaler racontent à Lucy Patterson leur travail portant sur les maladies génétique et sur les conseils à suivre pour les patients atteints.
/ iStockphoto
Faisant partie de la série de conférences SET-routesw1 Insight Lecturesw2, deux scientifiques allemandes venant d’Heidelberg, nous parlent de leur travail et de leur expérience dans le domaine des maladies génétiques. Sabine Hentze, doctorante en médecine spécialisée en génétique humaine et en conseil génétique, et Martina Muckenthaler, professeur au centre pédiatrique à l’hôpital universitaire d’Heidelberg travaille sur l’hémochromatose, une maladie génétique favorisant le stockage à outrance de fer (voir boîte).
Les maladies génétiques sont causées par des anomalies de l’ADN du patient. Elles peuvent être très simples touchant un seul nucléotide d’un seul gène ou bien au contraire assez complexes comprenant des délétions et des réarrangements de morceaux entiers de chromosomes.

Muckenthaler (right)
Images courtesy of EMBL Photolab
Notre ADN subit constamment des attaques pouvant conduire à des mutations, ces attaques peuvent être des radiations (voir les expériences en classe sur les radiations Peralta & Oliveira, 2009). De plus la réplication de l’ADN durant chaque mitose n’est pas exempte d’erreurs. Afin de parer à ces mutations engendrées, chaque cellule dispose de multiples enzymes réparatrices qui réparent constamment les dégâts. Mais de temps en temps certaines mutations échappent à ce système de réparations et subsistent.
Si ces mutations ont lieu dans des séquences importantes codant pour des gènes précieux, elles peuvent alors induire des maladies. Cependant comme nous possédons deux copies de chaque gène (une maternelle et l’autre paternelle), et que les mutations ne modifient souvent qu’une seule copie, elles ne causent donc pas nécessairement immédiatement de problèmes, puisque nous possédons toujours une copie intacte.
En effet, nous sommes tous porteurs de cinq à dix gènes mutés sans nous en apercevoir. Ce sont seulement les mutations dominantes qui causent des maladies lorsqu’un seul gène est muté. Mais les mutations récessives peuvent s’avérer problématiques. Si les deux parents portent une mutation d’un même gène: il y a alors un risque de transmission d’un gène muté par les deux parents, et donc que l’enfant hérite d’une paire de gène muté et développe une maladie comme la mucoviscidose ou la drépanocytose.
Lorsque toute une partie de chromosome manque ou est échangée ailleurs, ou même, lorsque des chromosomes entiers se sont dupliqués ou absent, ces aberrations souvent létales, c’est-à-dire que l’enfant meurt avant de naître, ou bien naissent mais avec un retard mental, des malformations comme chez le syndrome de Down.
Il est aussi possible d’héritez une hypersensibilité pour certaines maladies. Des mutations particulières, bien qu’elles n’induisent pas directement des maladies, augmentent énormément le risque chez le sujet touché d’en développer, par exemple le fait d’héritez des mutations dans les gènes BRCA1 et BRCA2 augmentent le risque de développer un cancer du sein.
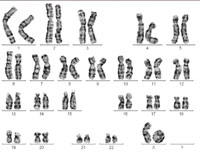
One of the X chromosomes forms
what is known as a ring
chromosome, causing Turner
syndrome. Click to enlarge
Image courtesy of Sabine Hentze
Une partie du travail de Sabine est d’examiner et de diagnostiquer ce genre d’anomalies chez les patients: «Typiquement des parents m’apportent leur enfant et de me dire qu’il n’est pas dans la norme, que l’enfant des voisins qui a le même âge que le leur est plus grand, sait déjà marcher alors que le leur non». Il existe un nombre incroyable d’outils, de test, mais quand il est temps de prononcé le diagnostique, elle ajoute: «Premièrement et avant tout, au centre où nous sommes, le travail des médecins est de regarder, d’écouter, d’examiner et d’évaluer.» Après un examen clinique approfondit, une connaissance détaillée de l’histoire familiale, Sabine peut deviner la cause sous-jacente du syndrome. La prochaine étape est de trouver quel genre de mutation est lié à cette maladie.
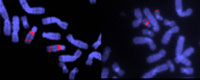
liant des séquences
spécifiques. Notez la délétion
au chromosome 22 dans
l’échantillon de droite. Ceci
cause le syndrome de Di
Georges, qui se matérialise
par une absence de thymus
et des glandes parathyroïdes
ayant des conséquences
nocives dans l’établissement
d’une bonne immunité, une
stature courte, une
déformation faciale du cœur
et des gros vaisseaux
Image reproduite avec
l’aimable autorisation de John
Crolla, Wellcome Images
Le premier a utilisé l’analyse génétique était un généticien français et pédiatre Jérôme Lejeune, qui en 1959 détermina qu’un enfant souffrant du syndrome de Down possédait une copie supplémentaire du chromosome 21. Aujourd’hui encore il y a beaucoup de questions qui peuvent être résolues en utilisant cette technique plutôt qu’avec un test génétique: on prélève des cellules chez un patient que l’on met en culture, puis on les fixe, on les prépare et les teinte afin que leurs chromosomes puissent être étudiés sous microscope.
Certaines maladies sont dues à des réarrangements ou à des délétions trop petites pour être détecter par une analayse chromosomique classique, appelé FISH (hybridation in situ en fluorescence). De petits fluorescents morceaux d’ADN complémentaire sont destiné à s’hybrider et à se coller à des séquences spécifiques dans la région du chromosome touché par l’anomalie, les médecins analyse l’échantillon pour voir si, et où ils se sont hybrider.
Quand faut-il avoir recours à un test génétique? “j’en utilise si je suspecte fortement une maladie particulière dont on connaît le gène et sa mutation » nous dit Sabine.
L’hémochromatose, la maladie dont est spécialiste Martina, n’est pas la plus courante des maladies héréditaire dans le monde occidental, mais près de 85-90% des cas en Europe sont causés par une seule mutation du gène HFE (voir boîte plus bas). Si des patients semblent souffrir de cette maladie ou sont issus d’une famille touchée, il est possible de vérifier la mutation du gène HFE par un test génétique. L’ADN du patient est isolé, normalement à partir d’un prélèvement sanguin, et les nucléotides du gène sont séquencés, puis comparés avec la séquence du même gène appartenant à des sujets sains.
Hémochromatose
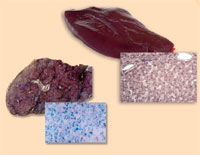
d’hémochromatose (à droite)
à comparer avec un foie sain
( à gauche). Notez l’excés de
fer (coloration du bleu de
Prusse)
Image reproduite avec
l’aimable autorisation de
Martina Muckenthaler
L’hémochromatose est la maladie lhéréditaire la plus fréquente du monde occidental. Elle est à l’origine de l’absorption et de l’accumulation exagérée de fer dan sle foie, le Coeur, le pancreas et dans d’autres tissues. En plus d’un peau anormalement bronzée, l’hémochromatose cause un disfonctionnement hépatique, puisque comme la majorité des animaux les êtres humains doivent excréter l’excés de fer.
Le fer est un composant essentiel de l’hémoglobine, la molecule responsible du transport d’oxygène dans le sang. C’est en plus un co-facteur de cytochrome, qui sont des protéines générant de l’énergie grace à la chaîne respiratoire de chaque cellule. Par le passé l’usage courant de sangsues afin de traiter cette maladie. Et de fait cette technique reste d’actualité, meme si l’on n’utilise plus les sangsues.
La synthèse de nouveaux globules rouges utilise du fer. Initialement la maladie ne touchait que des hommes, et ne devenait appreciable que dans lors de leur quarantaine ou leur cinquantaine. Cependant, nous savons aujourd’hui que les femmes contractent aussi la maladie, mais grâce à leurs règles et aux grossesses aident naturellement à réduler l’excès de fer.
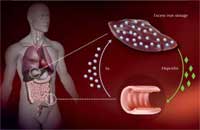
chez le personne atteintes
d’hémochromatose,
conduisant à un excès
d’absorption de fer par les
cellules intestinales et à trop
grande accumulation de fer
dans le foie. Cliquer sur
l’image pour l’agrandir
Dans 85-90% des cas d’Europe, l’hémochromatose est causée par une mutation spécifique du gène HFE, localisé sur le chromosome 6. On pense qu’elle est apparue 500 ans avant JC chez un individu d’une tribue celte vivant dans la vallée du Danube, qui depuis s’est répandue à travers l’Europe, puis avec les migrations est arrivée en Amérique et en Australie. En Australie, lorsque l’on fait l’arbre généalogique de tous les sujets atteind on retombe sur un immigrant qui portait la mutation. Une personne sur huit du monde occidental porte cette mutation, mai spuisque ce phenotype est recessif seulement une personne sur 250 contracte la maladie avec ses divers symptoms.
Les chercheurs comme Martina Muckenthaler pensent que la propagation de la mutation du gène HFE confère un certain avantage: “historiquement, les femmes enfantaient plusieurs enfants. La grossesse provoque des pertes de fer à cause à la fois du développement du foetus et de l’acouchement. De plus on trouvait à l’époque peu de viande à manger, viande qui est la source principale de fer dans notre alimentation, il était dès lors difficile decombler ce manque de fer. D’autre part, dans le passé la durée de vie moyenne étant plus basse les symptômes n’avaient pas le temps de se developer convenablement. Par consequent, la mutation du gene n’avait que des avantages en terme de selection naturelle: les porteurs étaient plus aptent à survivre et donc à se reproduire que les autres.
Afin d’assurer le juste stockage du fer, le foie mesure le taux de fer disponible et convertit cette information par la production d’une hormone, l’hépcidine; plus le taux de fer est grand plus le taux d’hépcidine augmente. Au niveau de l’intestin l’hépcidine détruit la protéine transportrice de fer afin de réduire son absorption.
Afin d’assurer le juste stockage du fer, le foie mesure le taux de fer disponible et convertit cette information par la production d’une hormone, l’hépcidine; plus le taux de fer est grand plus le taux d’hépcidine augmente. Au niveau de l’intestin l’hépcidine détruit la protéine transportrice de fer afin de réduire son absorption.
Lorsque des enfants souffrent d’un retard mental ou physique, des mutations dans une gamme de gènes répartis sur plusieurs chromosomes peuvent être mis en cause. Ici, le méthode de coloration des chromosomes n’ai pas assez précise pour identifier le gène défectueux, cependant, c’est un travail très laborieux de séquencer chaque gène potentiellement touché. Dans ce cas, les généticiens comme Sabine essayent d’utiliser une nouvelle technique: les microarrays ( pour plus d’explication sur cette technique voir Koutsos et al., 2009). Les microarrays ont considérablement accéléré les analyses génétiques; des dizaines voir des centaines de milliers de régions du génome peuvent être testées simultanément, il est donc désormais possible de tester plusieurs anomalies d’un seul coup. Les scientifiques espèrent que dans un futur proche l’on puisse utiliser cette technique pour identifier tous les gènes défectueux et préposés à des déficiences en un seul test.
Image reproduite avec
l’aimable autorisation de
ktsimage / iStockphoto
Aucuns parents ne souhaitent que leur enfant soit touché par une maladie génétique. Jusqu’à maintenant l’échographie prénatale était la seule voie de diagnostique. Cependant, depuis le progrès de la fertilisation in vitro, il est désormais possible d’examiner le matériel génétique d’un embryon avant l’implantation utérine, l’on appelle ceci le diagnostique préimplantatoir.
Aujourd’hui, beaucoup de tests sont disponibles afin de détecter les maladies génétiques, autorisant les parents se sachant à risqué de choisir un embryon sain avant l’implantation. Ceci est vraiment bienvenue aujourd’hui car les parents n’ont plus à passer par les mulpitples examen pré-nataux (pas d’amniocentèse , qui est un examen comportant de nombreux risuqes pour le bébé), ni à patienter pour leurs résultats et ne sont plus en face d’une difficile décsion d’avortement.
Plus nous en apprenons sur les bases génétiques des maladies génétiques et de leurs traits, plus nos methods d’analyses s’améliorent, plus nous analysons. Biensur aucun parents ne souhaitent à son enfant d’être atteint d’une grave déficience génétique mais que dire d’une déficience modérée comme l’hémochromatose, maladie congénitale, ou une simple déficience visuelle? Qui oserait dire qu’un enfant souffrant d’un telle déficience ne viverait pas comme n’importe qui? Cette etude pose donc la question de la normalité. Où positionnons la frontière du génétiquement acceptable et génétiquement réfutable? Allons plus loin, aurons nous le droit de choisir le sexe de notre enfant, sa taille ou meme si niveau d’intelligence?

l’aimable autorisation de
jgroup / iStockphoto
Un autre question resort de ces tests génétiques est de savoir à quel point nous voulons être informé de notre capital génétique. Que se passerait il si vous découvriez que vous avez une grande probabilité de developer une grave maladie? Dans ce cas vous adjusteriez sans doute votre mode de vie à cette découverte afin de réduire le risqué, mais que ressentiriez vous? Que pensons aux compagnies d’asurances qui pourrait prendre en compte ce genre de critères? De plus que penser si cette anomalie serait transmissible? Metteriez vous votre conjoint au courant? Et cela changerait il ses sentiments? Si vous voulez aprofondir ces questions en classe, aller voir Strieth et al. (2008).
C’est à ce moment que les conseillers en génétique comme Sabine Hentze sont nécessaire: “A côté de mon travail au laboratoire, je passé beaucoup de temps à conseiller mes patients, autrement dit, je leur explique ce que veut dire les résultats des tests, ce que cela représente pour moi, pour leur enfant, pour leur famille pour notre future
Et c’est à travers ce travail de conseillers généticiens que nous avons réaliser que l’une des choses les plus importantes dans le domaine de la génétique est le droit de ne pas savoir.
References
- Koutsos A, Manaia A, Willingale-Theune J (2009) A la pêche aux gènes: Les puces à ADN dans la classe. Science in School 12. www.scienceinschool.org/2009/issue12/microarray/french
- Peralta L, Oliveira C (2009) Radioactivité en classe. Science in School 12. www.scienceinschool.org/2009/issue12/radioactivity/french
- Strieth L et al. (2008) Meet the Gene Machine: stimulating bioethical discussions at school. Science in School 9: 34-38. www.scienceinschool.org/2008/issue9/genemachine
Web References
- w1 – Pour plus d’informations sur l’organisation de SET-routes, la promotion des femmes dans le domaine de la science, allez sur www.set-routes.org
- w2 – Les conférences SET-routes sont une série de conférences intéractives à utiliser en classe. Présentés par des femmes scientifiques peu ordinaires, ces conférences nous font découvrir le monde excitant de la science, de l’ingénierie et de la technologie (SET) qui couvre des domaines aussi diversifiés que l’espace, le changement climatiques, les conseils génétiques, l’hémochromatose et les fragments d’ADN, le paludisme, les cellules souches et la régénération, l’archéologie de l’univers, et la cosmologie. Visitez le site: www.set-routes.org/lectures
Resources
- On peut trouver des cartes de jeu Democs afin de débattre sur le diagnostique pré-implantatoire et sur les tests génétiques sur le site de téléchargement gratuit suivant: www.neweconomics.org/gen/democs.aspx
- Pour un exemplaire de Science in school sur les Democs:
- Smith K (2007) Democs: a conversation card activity for teaching science and citizenship. Science in School 4: 27-19. www.scienceinschool.org/2007/issue4/democs
- Le site The Genes are Us offer de courtes vidéos et des activité pédagogiques portant sur les maladies génétiques: www.genesareus.org
- The Genetic Disorders Library introduit les plus grandes maladies génétiques (http://learn.genetics.utah.edu/content/disorders/whataregd) section Learn.Genetics. A voir aussi le centre d’enseignement de la génétique de l’université de l’Utah (Etats-unis): http://learn.genetics.utah.edu
- Pour en savoir plus sur les radicaux oxygénés dans notre corps et comment les combattre: Farusi G (2009) Looking for antioxidant food. Science in School 13: 39-43. www.scienceinschool.org/2009/issue13/antioxidants
- Si cet article vous a donné envie d’en savoir plus, et de lire les derniers articles sur les avancées, les opinions des tests génétiques visitez le blog de Daniel MacArthur la génétique du future: http://scienceblogs.com/geneticfuture
- Si cet article vous a interessé vous aimerez sans parcourir des articles similaires publiés par Science in school: www.scienceinschool.org/medicine
Review
Les maladies et les syndromes héréditaires sont des questions centrales dans les cours de génétique: cet article intéressera donc tous les étudiants et les encouragera à faire leur arbre généalogique. Ceci pourra aussi générer d’intéressantes discussions en classe, si les étudiants sont prêts à parler de maladies rares ou d’aberrations chromosomiques touchant leur famille. L’hémochromatose est une maladie à ne pas négliger, car elle peut être soignée lorsqu’elle est diagnostiquée. C’est aussi un bon exemple d’évolution d’une anomalie au départ bénéfique et qui est aujourd’hui un désavantage. Ceci peut être la source de bonnes réflexions.
De plus, on trouvera dans cet article une description des principales techniques d’investigations du génome, utilisées lors d’analyse des maladies génétiques, dont une technique de pointe, les micro-arrays.
On trouvera plusieurs sujets de discussions : l’éthique en génétique, la fertilisation in vitro, le diagnostique préimplantatoire, la plannification familliale dans le cas de pathologies connues et la question de l’origine de la vie. Tous ces sujets sont bien sur reliées à l’éthique et la religion.
Voici quelques suggestions d’exercices à destination des étudiants basé sur cet article:
- A partir d’un tableau, recenser les différentes techniques, et indiquer leurs indications pour les différentes maladies gééntiques.
- Discuter des différentes applications de chaque technique et de leur validité pour le patient.
- Discuter du droit de savoir et de ne pas savoir et du dilemme éthique auquel est confronté le médecin lors de ses découvertes des mutations génétiques.
- Illustrer l’absorption du fer et sa régulation chez les humains par un schéma.
- Dessiner un diagramme du pattern de mutation dans le gène HFE, en utilisant la génétique mendélienne.
Friedlinde Krotscheck, Autriche





