Nuevas piezas para entender el puzzle de las enfermedades genéticas Understand article
Traducido por: alumnos Máster de Traducción (Universidad de Zaragoza). Sabine Hentze y Martina Muckenthaler hablan con Lucy Patterson sobre su trabajo: detectar enfermedades genéticas y asesorar a pacientes potencialmente afectados.
iStockphoto
Como parte del reciente ciclo de conferencias de SET-routesw1 Insight Lecturesw2 dos científicas de Heidelberg (Alemania) hablaron de su trabajo y experiencia en el campo de las enfermedades genéticas: Sabine Hentze, doctora especializada en genética humana y asesoramiento genético, y Martina Muckenthaler, profesora del Centro de Medicina Pediátrica del Hospital Universitario de Heidelberg, que investiga la hemocromatosis, una enfermedad hereditaria relacionada con la absorción del hierro (ver cuadro).
Las enfermedades genéticas se deben a alteraciones en el ADN de una persona. Pueden ser tan simples como una mutación de un nucleótido en un único gen o tan complejas como la deleción y reorganización de secciones de los cromosomas o de cromosomas enteros.

Martina Muckenthaler
(derecha)
Imágenes cedidas por EMBL
Photolab
Nuestro ADN se encuentra sometido al ataque constante de una serie de factores, como la radiación natural, que pueden causar mutaciones, (para experimentos en clase sobre radiación, véase Peralta & Oliveira, 2009). Además, la copia de la secuencia completa del ADN de una célula durante cada mitosis no es un proceso infalible. Para contrarrestarlo, cada célula de nuestro cuerpo cuenta con un equipo de enzimas reparadoras del ADN que están constantemente subsanando daños. A veces, sin embargo, las mutaciones eluden el proceso de reparación y acaban incorporadas al ADN.
Si estas mutaciones se producen en genes importantes, pueden causar enfermedades graves. Al tener dos copias de cada gen (una procedente de nuestro padre y otra de nuestra madre), las mutaciones que dañan tan solo una de las copias de los genes no tienen por qué causar problemas inmediatos, ya que aún nos queda una copia sana.
Efectivamente, todos somos portadores, sin ni siquiera darnos cuenta, de entre cinco y diez de estos genes con mutaciones recesivas. Solo las mutaciones dominantes se manifiestan como enfermedad cuando una única copia del gen está dañada. Sin embargo, las mutaciones recesivas pueden llegar a dar problemas si se da el caso de que tanto el padre como la madre portan una copia mutante del mismo gen: existe el riesgo de que se puedan heredar ambas. Esto puede dar lugar a enfermedades como la fibrosis quística o la anemia de las células falciformes.
Cuando secciones completas de cromosomas se pierden o cambian de emplazamiento, o incluso cuando cromosomas enteros se duplican o suprimen, se producen anomalías a menudo letales, ya que pueden provocar la muerte prenatal o dar lugar a retraso mental y malformaciones o síndromes, como por ejemplo el síndrome de Down.
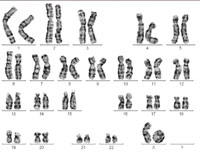
mujer. Uno de los
cromosomas X forma lo que
se conoce como cromosoma
en anillo, que causa el
síndrome de Turner. Haga
doble clic sobre la imagen
para ampliarla
Imagen cortesía de Sabine
Hentze
También es posible heredar una elevada predisposición a sufrir enfermedades. Algunas mutaciones, aunque por sí solas no lleguen a causar enfermedades, aumentan considerablemente el riesgo de que una persona desarrolle determinadas afecciones: por ejemplo, las mutaciones heredadas de los genes BRCA1 y BRCA2 aumentan el riesgo de padecer cáncer de mama.
Parte del trabajo de Sabine consiste en investigar y diagnosticar esta clase de enfermedades en sus pacientes: “Una situación habitual es aquella en la que los padres me traen a su hijo diciendo «Ha crecido poco para su edad. El hijo de nuestro vecino, que es de la misma edad, está mucho más alto y ya gatea. El mío, nada»”. Hay varios instrumentos y pruebas disponibles, pero cuando se trata de realizar un diagnóstico, señala: “En primer lugar, en el centro estamos nosotros, los médicos, y nuestro trabajo es observar, escuchar, examinar y evaluar”. Tras un examen clínico exhaustivo y respaldada por un historial familiar detallado, Sabine ya se encuentra en condiciones de estimar la causa subyacente al trastorno de un paciente. El siguiente paso es descubrir qué clase de mutación ha originado la enfermedad.
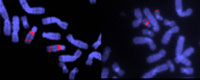
secuencias específicas de
ADN. Obsérvese la supresión
en el cromosoma 22 en la
muestra de la derecha. Esto
causa el síndrome de
DiGeorge, que se caracteriza
por la ausencia del timo y de
las glándulas paratiroides, y
cuyas consecuencias son
deficiencias inmunitarias,
baja estatura y deformidades
en la cara, corazón y grandes
vasos sanguíneos
Cortesía de John Crolla,
Imágenes Wellcome
El primer análisis cromosómico fue realizado por el genetista y pediatra francés Jérôme Lejeune, quien en 1959 determinó que los niños con síndrome de Down tenían una copia adicional del cromosoma 21. Incluso hoy existen muchas preguntas que se pueden contestar de forma más precisa con esta técnica que con una prueba genética: las células extraídas de un paciente se cultivan en el laboratorio, después se fijan, se preparan y se tiñen para poder estudiar sus cromosomas bajo el microscopio.
Sin embargo, algunas enfermedades están causadas por reorganizaciones o deleciones tan pequeñas que no pueden apreciarse por medio de un análisis de cromosomas convencional, por lo que se usa una técnica denominada FISH (siglas en inglés para hibridación fluorescente in situ). Se diseñan minúsculos fragmentos de ADN marcados con fluorescencia para hibridar o adherirse a una secuencia específica en la región del cromosoma supuestamente afectada, y los médicos comprueban si se ha producido tal hibridación en una muestra del cromosoma del paciente y dónde se ha producido.
Bueno, entonces, ¿cuándo debemos recurrir a una prueba genética? “La utilizo si tengo sospechas fundadas de la existencia de una determinada enfermedad, de la que conocemos el gen y la posible mutación”, explica Sabine.La hemocromatosis, enfermedad en la que Martina es especialista, no solo es la enfermedad hereditaria más común en el mundo occidental, sino que en el 85-90% de los casos en Europa central está causada por una mutación específica del gen HFE (ver cuadro a continuación). Si se piensa que algún paciente la padece o está preocupado por sus antecedentes familiares, se puede realizar una prueba genética para buscar mutaciones HFE. Se aísla el ADN del paciente, generalmente mediante una muestra de sangre, se secuencian los nucleótidos del gen HFE donde suelen darse las mutaciones puntuales y se comparan con las secuencias de individuos sanos.
Hemocromatosis
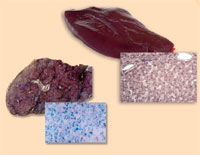
hemocromatosis (derecha),
comparado con un hígado
sano (izquierda). Observese
el exceso de hierro (teñido
con azul de Prusia)
Imagen cortesía de Martina
Muckenthaler
El hierro es un componente esencial de la hemoglobina, la molécula responsable del transporte de oxígeno en los glóbulos rojos. Además es un factor auxiliar de los citocromos, unas proteínas importantes para generar energía en la cadena respiratoria de cada célula. En el pasado se observó que la práctica entonces habitual de sangrar al paciente con sanguijuelas parecía aliviar la enfermedad. De hecho, esta sigue siendo hoy en día la base para el tratamiento de la hemocromatosis aunque, eso sí, sin sanguijuelas.
La síntesis de nuevos glóbulos rojos nos ayuda a deshacernos del hierro sobrante. Al principio se pensaba que esta enfermedad afectaba solo a los hombres y se manifestaba únicamente a partir de los cuarenta o cincuenta años. Sin embargo, ahora sabemos que afecta por igual a las mujeres, aunque la pérdida de sangre debida a la menstruación y al embarazo ayuda de forma natural a aliviar los síntomas.
En Europa central la hemocromatosis está causada en el 85-90% de los casos por una mutación específica en el gen HFE, situado en el cromosoma 6. Se cree que se originó espontáneamente hacia el año 500 a. C. en un individuo de una tribu celta que vivía en el valle del Danubio, desde donde se propagó a toda Europa, y con la emigración, a América y Australia. En Australia, de hecho, se puede rastrear el origen de la enfermedad hasta un único inmigrante, portador inicial de la mutación. Una de cada ocho personas en el mundo occidental es portadora de esta mutación, pero al ser recesiva, solo una de cada 250 desarrollará síntomas de hemocromatosis.
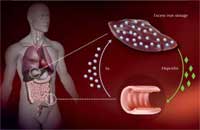
suficientemente en las
personas con
hemocromatosis, lo que
conlleva un exceso de
acumulación de hierro en los
intestinos y su
almacenamiento en el hígado
Imagen cortesía de Martina
Muckenthaler
Algunos investigadores como Martina Muckenthaler piensan que es probable que la mutación HFE se extendiera tanto debido a que confería una ventaja selectiva: “Históricamente, las mujeres daban a luz a muchos hijos. Tanto la gestación como los propios partos, que provocaban la pérdida de sangre, vaciaban las reservas de hierro. Además, había muy poca carne para comer, y como es el alimento que más hierro contiene, era muy difícil reponer estas reservas. Por otra parte, en el pasado, la esperanza de vida era menor, así que los síntomas de la enfermedad no llegaban a desarrollarse. Esto significa que la mutación del gen HFE constituyó una gran ventaja en términos de selección natural: la gente con esta mutación podía reproducirse con más éxito”.”
¿Cómo causa esta mutación una asimilación excesiva de hierro? El organismo absorbe el hierro en el intestino por medio de una proteína de transporte especializada. Entonces, el hierro se almacena dentro de las células hepáticas por medio de una proteína de almacenamiento de hierro, la ferritina, hasta que se hace necesario su transporte. Una cantidad de hierro excesiva puede provocar la producción de radicales de oxígeno, que dañan a las células y causan su muerte.
Para garantizar que no se absorba un exceso de hierro, el hígado regula la cantidad disponible mediante la producción de una hormona llamada hepcidina (cuanto más hierro, más hepcidina). En el intestino, la hepcidina destruye las proteínas transportadoras del hierro para que no absorban más de lo necesario.
Usando el ratón como organismo de referencia, Martina ha desarrollado un biochip especial que contiene 500 genes relacionados con el metabolismo del hierro. Mediante este método su grupo comparó la actividad genética de las células hepáticas de ratones sanos con la de las células hepáticas de ratones modificados para portar la mutación del HFE que causa la hemocromatosis en los humanos. Descubrieron que con dicha mutación la hepcidina no se regula lo suficientemente al alza, incluso cuando ya hay suficiente hierro en el cuerpo, lo que produce un exceso de hierro. A través de su investigación, Martina y otros colegas están intentando ahora comprender este proceso con más detalle.
Las mutaciones en una serie de genes de diferentes cromosomas pueden ser la causa de una discapacidad mental o física no específica en niños. Aquí, las técnicas de teñido de cromosomas no tienen una resolución lo suficientemente alta como para identificar el gen defectuoso; sin embargo, llevaría mucho trabajo secuenciar uno por uno todos los genes potencialmente afectados. En estos casos, los genetistas como Sabine están empezando a utilizar una nueva tecnología: los biochips de ADN (para una explicación detallada de los biochips de ADN y sugerencias sobre cómo abordarlos en el aula, ver Koutsos et al., 2009). Los biochips de ADN aceleran enormemente el proceso de las pruebas genéticas; el análisis paralelo de decenas o cientos de miles de regiones del genoma permite realizar pruebas simultáneas para muchos trastornos. En el futuro, los científicos piensan que será posible desarrollar un biochip que pueda detectar la presencia de cualquier enfermedad genética y su predisposición mediante una única prueba rápida y sencilla.
Imagen cortesía de
ktsimage/iStockphoto
Ningún padre querría que su hijo naciera con una enfermedad genética. Hasta hace poco el screening prenatal era la única opción disponible para determinar si un niño nacería con algún trastorno grave. Sin embargo, la llegada de la fertilización in vitro ha hecho posible examinar el mapa genético de un embrión antes de ser implantado en el útero, a través de una técnica denominada diagnóstico genético preimplantacional.
Hoy en día existen numerosas pruebas para diagnosticar las enfermedades genéticas conocidas, lo que permite a los padres con riesgo de transmitir una enfermedad genética seleccionar un embrión para su implantación. Esto aporta muchas ventajas para los futuros padres, ya que significa que no tendrán que pasar por el proceso de analizar el embrión en el útero (la amniocentesis, que en sí misma entraña un riesgo para el bebé), esperar los resultados y tomar la decisión de interrumpir o no el embarazo si estos no son buenos.
Cuanto más se aprenda sobre la base genética de las distintas enfermedades y sus características, y cuanto más sofisticados se hagan nuestros métodos de detección, más rasgos podremos seleccionar. Es evidente que ningún padre quiere que su hijo sufra una enfermedad grave, pero ¿qué pasa con afecciones menores como la hemocromatosis, la sordera congénita o incluso la miopía? ¿Quién puede decidir que un niño con alguno de estos trastornos no va a tener una vida tan plena como una persona sana? Básicamente, el problema plantea la cuestión de definir qué se considera normal. ¿Dónde se traza la línea que separa las afecciones o rasgos genéticamente determinados que son aceptables y los que no lo son? Además, ¿debería permitirse que los padres elijan el sexo, la altura, el aspecto físico o la inteligencia de sus hijos?

iStockphoto
Otra cuestión que se plantea con los análisis genéticos es si realmente deseamos saber qué nos deparan nuestros genes. ¿Qué pasaría si uno descubriese que tiene un alto riesgo de desarrollar una enfermedad grave? Podría ajustar su estilo de vida para retrasar la aparición o mitigar los síntomas, pero ¿cómo se sentiría si supiera que está en peligro? Y, ¿qué pasaría si las compañías de seguro o las empresas tuvieran acceso a esta información? ¿Y si existiera el riesgo de que su hijo heredara su enfermedad? ¿No querría saberlo su pareja? ¿Podría esto afectar a sus sentimientos? Para más sugerencias sobre cómo abordar el debate sobre estos temas en clase, véase Strieth et al. (2008).
Es en este punto cuando el trabajo de los asesores genéticos como Sabine Hentze se hace esencial: “Además de mi trabajo de laboratorio, dedico la mayor parte del tiempo a asesorar a los pacientes, es decir, a comunicarme con ellos: ¿Qué significan los resultados de esta prueba? ¿Qué significan para mí, para nuestro hijo, para nuestra familia, para nuestro futuro?”
La labor de estos asesores en genética nos ha hecho darnos cuenta de que uno de los aspectos más importantes del análisis genético es que la gente tiene también derecho a no saber.
References
- Koutsos A, Manaia A, Willingale-Theune J (2009) Fishing for genes: DNA microarrays in the classroom. Science in School 12: 44-49. www.scienceinschool.org/2009/issue12/microarray
- Peralta L, Oliveira C (2009) Radioactivity in the classroom. Science in School 12: 57-61. www.scienceinschool.org/2009/issue12/radioactivity
- Strieth L et al. (2008) Conoce la Máquina del Gen: estimulando discusiones bioéticas en el colégio. Science in School 9. www.scienceinschool.org/2008/issue9/genemachine/spanish
Web References
- w1 – Para más información sobre la organización SET-routes, que promociona el papel de las mujeres en la ciencia, véase www.set-routes.org
- w2 – Las Insight Lectures de la organización SET-routes son unas conferencias científicas interactivas con fines educativos. Presentadas por científicas de talla excepcional, las conferencias nos introducen en el apasionante mundo de la ciencia, de la ingeniería y de la tecnología (por sus siglas en inglés, SET), y abarcan campos tan diversos como la ciencia espacial, el cambio climático, el asesoramiento genético, la hemocromatosis y el biochip, la malaria, las células madre y la regeneración, la arqueología del universo y la cosmología. Véase: www.set-routes.org/lectures
Resources
- Se pueden descargar tarjetas para realizar actividades de debate (Democs) sobre los diagnósticos de preimplantación y las pruebas genéticas “a gusto del consumidor”, en esta dirección web: www.neweconomics.org/gen/democs.aspx
- Para un artículo de Science in School sobre las Democs, ver:Smith K (2007) Democs: a conversation card activity for teaching science and citizenship. Science in School 4: 27-19. www.scienceinschool.org/2007/issue4/democs
- El sitio web The Genes are Us ofrece vídeos cortos y actividades de clase sobre las enfermedades genéticas, véase: www.genesareus.org
- Para una introducción a la mayoría de las enfermedades genéticas más comunes, véase el apartado Genetic Disorders Library (http://learn.genetics.utah.edu/content/disorders/whataregd) de la web Learn.Genetics (http://learn.genetics.utah.edu), del Centro de Aprendizaje de la Ciencia Genética de la Universidad de Utah, EE.UU (esta web tiene una sección en español).
- Para aprender más sobre los radicales de oxígeno en el organismo y cómo contrarrestar su efecto, véase: Farusi G (2009) Buscando alimentos antioxidantes. Science in School 13. www.scienceinschool.org/2009/issue13/antioxidants/spanish
- Si este artículo ha despertado su curiosidad, puede encontrar más información y artículos de opinión sobre los últimos avances en pruebas genéticas y genómica personal en el blog científico de Daniel MacArthur, Genetic Future: http://scienceblogs.com/geneticfuture
- Si este artículo le ha parecido interesante y útil, quizás quiera echar un vistazo a los demás artículos relacionados con la medicina publicados en Science in School. Ver: www.scienceinschool.org/medicine
Review
Las enfermedades y síndromes hereditarios son fundamentales para las clases de genética. El tema es relevante para todos los estudiantes y fomentará la participación de sus familias en la “investigación genealógica”. Se abrirán incluso más debates en la clase si los estudiantes están dispuestos a hablar de casos de enfermedades raras o anomalías cromosómicas en su familia. La hemocromatosis es una cuestión que no debería evitarse, puesto que se puede controlar desde el punto de vista médico en cuanto se diagnostica. También es un buen ejemplo de ventaja evolutiva que puede conducir a un callejón sin salida cuando cambia el entorno, lo cual seguramente suscitará muchos debates interesantes.
Además, este artículo describe las principales técnicas empleadas actualmente para el análisis de defectos hereditarios, incluso una técnica puntera: los biochips de ADN.
Entre los posibles temas de discusión se incluyen: la ética genética en general, la fertilización in vitro, la preimplantación genética, la planificación familiar en caso de enfermedades conocidas y la cuestión de cuándo comienza la vida. Todos estos temas están relacionados con la ética y la religión.
Aquí tiene algunas sugerencias sobre tareas que puede mandar a los alumnos, a partir de este artículo:
- En una tabla, enumera las técnicas descritas y su viabilidad para determinar un síndrome o enfermedad hereditarios
- Debatir las características de cada técnica en lo relativo a su validez para el paciente.
- Debatir el “derecho a conocer” o “a no conocer” y el dilema ético al que se enfrentan los médicos cuando descubren mutaciones genéticas graves.
- Ilustra la asimilación del hierro y su regulación en humanos empleando una secuencia de imágenes.
- Dibuja un diagrama del patrón de herencia en la mutación del gen HFE utilizando la genética de Mendel.
Friedlinde Krotscheck, Austria





