Uracil in DNA: Fehler oder Zeichen? Understand article
Übersetzt von Hildegard Kienzle-Pfeilsticker. Uracil ist bekannt als eine der Basen in RNA, aber warum kommt sie nicht in DNA vor – oder etwa doch? Angéla Békési und Beáta G Vértessy verfolgen die Spur.
Thymin gegen Uracil
Unsere genetische Information wird in Form von DNA mit einem Alphabet aus vier Buchstaben gespeichert. Die vier „Buchstaben“ entsprechen den vier chemischen Basen, Teil der DNA-Bausteine, genannt Nucleotide: Adenin (A), Thymin (T), Cytosin (C) und Guanin (G; siehe Abbildung 1). Bekanntermaßen entdeckten James Watson und Francis Crick, dass DNA eine Doppelhelix bildet, in der die vier Basen sich immer auf dieselbe Weise über spezifische Wasserstoff-Brückenbindungen paaren: Adenin bindet an Thymin und Guanin an Cytosin (siehe Abbildung 2 und 3).
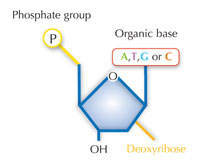
Mit freundlicher Genehmigung von Nicola Graf
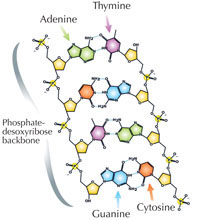
Mit freundlicher Genehmigung von Madeleine Price Ball; Bildquelle: Wikimedia Commons
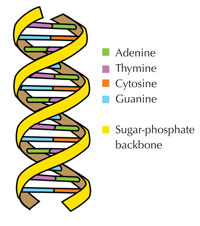
Mit freundlicher Genehmigung von Forluvoft; Bildquelle: Wikimedia Commons
Alternativ jedoch existiert ein fünfter Buchstabe: Uracil (U), der dieselben Wasserstoff-Brücken mit Adenin ausbildet (siehe Abbildung 4). Aber obwohl Uracil üblicherweise in RNA eingebaut wird, kommt es in DNA nicht vor. Dort wird stattdessen Thymin benutzt. Warum könnte das so sein?
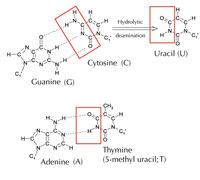
Mit freundlicher Genehmigung von Angéla Békési
Chemisch ist Thymin ein Molekül mit einer zusätzlichen Methyl-Gruppe. Was könnte der evolutionäre Vorteil dieses komplexeren Bauteils in DNA sein? Die Antwort könnte in der zellulären DNA-Reparatur liegen.
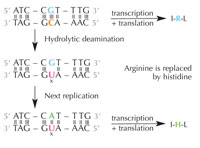
deamination of cytosine can
change the amino acids
encoded by the sequence.
Zum Vergrößern auf das Bild
klicken
Mit freundlicher Genehmigung
von Nicola Graf
Cytosin kann sich durch einen Vorgang, der hydrolytische Desamination genannt wird, spontan in Uracil umwandeln (siehe Abbildung 4). Dadurch gerät Guanin, welches ursprünglich gegenüber diesem Cytosin gebunden war, stattdessen an Uracil (zur Erinnerung: Uracil bindet normalerweise an Adenin). Wenn die Zelle das nächste Mal ihre DNA repliziert, würde der Platz gegenüber diesem Uracil von Adenin anstatt korrekterweise von Guanin eingenommen und so die Information auf diesem DNA-Abschnitt ändern (siehe Abbildung 5). Dieser Prozess der Cytosin-Desaminierung ist eine der häufigsten DNA-Schädigungen, die aber normalerweise effektiv korrigiert werden. Wie macht die Zelle das?
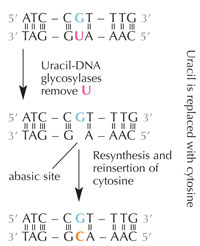
hydrolytischer
Desaminierung. Zum
Vergrößern auf das Bild
klicken
Mit freundlicher Genehmigung
von Nicola Graf
Zellen besitzen ein Reparatursystem, das ein Uracil an der Stelle eines Cytosin feststellen und das den Fehler korrigieren kann, bevor er repliziert und weitergegeben wird. Die zelluläre Maschinerie für diese Aufgabe besteht aus mehreren Enzymen: zunächst erkennen Uracil-DNA-Glycosylasen das Uracil und schneiden es aus der DNA heraus. Danach tragen mehrere Enzyme zur Eliminierung und Resynthese des beschädigten DNA-Teils bei. Dabei wird die Basen-freie Leerstelle in der DNA mit einem Cytosin aufgefüllt (siehe Abbildung 6).
Die am häufigsten vorkommende Form der DNA-Glycosylase kann aber nicht beurteilen mit welcher Base Uracil gepaart sein sollte, also ob Uracil hier an der richtigen Stelle sitzt (wenn es an Adenin gebunden ist) oder ob es ein mutiertes Cytosin ist (und gegenüber Guanin sitzt); sie würde stattdessen beide Uracil-„Typen“ erkennen und ausschneiden. Das würde ganz klar Probleme machen. Man nimmt an, dass die Lösung dieses potenziellen Problems in der Ausbildung eines Mechanismus liegt, bei dem „korrektes“ Uracil (gepaart mit Adenin) durch eine Methyl-Gruppe markiert wurde – und so Thymin entstand. Auf diese Weise schnitt die zelluläre Maschinerie ein entdecktes Uracil heraus und reparierte es, ein mit mit Methyl-Etikett versehenes Uracil – also ein Thymin (siehe Abbildung 4) – ließ es unangetastet. Mit der Zeit wurde daher Thymin in DNA zum Standard und die meisten Zellen verwenden Uracil heute nur in RNA.
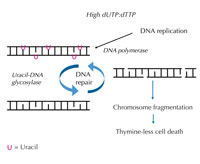
Verhältnis dUTP:dTTP
inkorporiert
DNA-Polymerase häufig
Uracil statt Thymin während
sowohl Replikation und
Reparatur. Uracil-
DNA-Glycosylase entfernt
das Uracil und initiiert
weitere Reparaturschritte, bei
denen in einem
Zwischenschritt
DNA-Strangbrüche auftreten.
Reparatursynthese kann
jedoch wieder Uracil
einfügen, was zu einem
vergeblichen Reparaturzyklus
führt. Durch
Überbeanspruchung des
Systems kann es zu
Chromosomenfragmentierung
kommen, die zum Zelltod
führt. Zum Vergrößern auf
das Bild klicken
Mit freundlicher Genehmigung
von Angéla Békési
Warum wurde Uracil in RNA beibehalten? RNA hat eine kürzere Lebensdauer als DNA und ist bis auf ein paar wenige Ausnahmen nicht der Speicher für genetische Information, so dass Cytosin-Moleküle, die sich spontan in Uracil umwandeln, für die Zelle keine große Bedrohung darstellen. Es gab daher keinen evolutionären Druck um Uracil in RNA durch das komplexere (und wahrscheinlich aufwändigere) Thymin zu ersetzen.
Thymin-Mangel-Tod
Bei der DNA-Synthese können die DNA-Polymerasen (sie katalysieren die Synthese) nicht zwischen Thymin und Uracil unterscheiden. Sie prüfen nur, ob sich die Wasserstoff-Brücken korrekt ausbilden, das heißt ob die Basenpaare richtig gebildet werden. Für diese Enzyme ist es egal, ob Thymin oder Uracil an Adenin bindet. Üblicherweise werden die Konzentationen von Desoxyuridintriphosphat (dUTP, eine Quelle für Uracil) sehr niedrig gehalten im Vergleich zu den Konzentrationen von Desoxythymidintriphosphat (dTTP, eine Thymin-Quelle). So wird verhindert, dass Uracil während der DNA-Synthese eingebaut wird.
Gerät diese genau abgestimmte Regulation durcheinander und das Verhältnis von dUTP zu dTTP vergrößert sich, steigt auch der Anteil von fälschlich eingebautem Uracil in DNA. Dann versucht das Reparatursystem, das anders als die DNA-Polymerasen Uracil von Thymin unterscheiden kann, Uracil mit Hilfe von Uracil-DNA-Glycosylase auszuschneiden und DNA neu zu synthetisieren. Dies verlangt, dass das DNA-Rückgrat zwischendurch gespalten (getrennt) wird. Ist allerdings das Verhältnis von dUTP zu dTTP immer noch erhöht, kann während der Neusynthese wiederum Uracil statt Thymin eingebaut werden. Dieser Zyklus kann zu DNA-Strangbrüchen und Chromosomen-Fragmentierung führen, wenn diese vorübergehenden Schnitte in der DNA schnell nacheinander und zu nahe aneinander passieren (siehe Abbildung 7). Dies führt zu einer speziellen Art von programmiertem Zelltod, dem sogenannten Thymin-Mangel-Tod.
Der Prozess des Thymin-losen Zelltods kann zur Krebsbekämpfung genutzt werden. Weil sich Krebszellen im Vergleich zu normalen Zellen mit einer deutlich höheren Rate teilen, synthetisieren sie mehr DNA pro Zeiteinheit und brauchen daher große Mengen an dUTP. Vergrößert man das Verhältnis von dUTP zu dTTP, kann man diese Krebszellen gezielt angehen und eliminieren.
Es gibt immer noch DNA mit Uracil
Obwohl die meisten Zellen Uracil in RNA und Thymin in DNA einbauen, gibt es Ausnahmen. Manche Organismen tragen nur Uracil statt Thymin in iherer DNA und andere Organismen bauen Uracil nur in einen Teil ihrer DNA ein. Welcher evolutionäre Vorteil könnte daraus entstehen? Schauen wir uns einige Beispiele an.
Uracil in viraler DNA
Infektion eines Bakteriums
durch einen Bakteriophagen
vor
Mit freundlicher Genehmigung
von cdascher / iStockphoto
Von zwei Bakteriophagen-Typen (Viren, die Bakterien infizieren) ist bekannt, dass sie in ihren DNA-Genomen nur Uracil statt Thymin verwenden. Wir wissen noch nicht, ob diese Phagen Repräsentanten einer sehr alten Lebensform sind, die niemals Thymin-DNA bildete, oder ob ihre mit Uracil-tragenden Genome eine neu etablierte Strategie darstellen. Wir wissen auch nicht, warum diese Phagen Uracil statt Thymin benutzen, aber es könnte eine wesentliche Rolle im Lebenszyklus dieser Viren spielen. Falls dies der Fall ist, dann könnte es für diese Viren Sinn machen, sicherzustellen, dass Uracil in ihrer DNA nicht durch Thymin ersetzt wird. Und für einen dieser Phagen wurde tatsächlich gezeigt, dass er ein Gen besitzt, das ein spezifisches Protein codiert, welches die Uracil-DNA-Glycosylase inhibiert. Es verhindert somit, dass sein Uracil durch „Reparatur“ mittels des Wirtsenzyms entfernt wird.
Programmierter Zelltod in Lebenszyklen von Insekten

Beispiel Ameisen, fehlt das
Enzym zur Entfernung von
Uracil aus ihrer DNA
Mit freundlicher Genehmigung
von spxChrome / iStockphoto
and Nicola Graf
Uracil-DNA scheint auch eine Rolle im Lebenszyklus von Endopterygota zu spielen – Insekten, die während ihres Lebenszyklus ein Puppenstadium durchmachen (wie Ameisen und Schmetterlinge, aber nicht Heuschrecken und Termiten). In diesen Insekten fehlt das Gen für Uracil-DNA-Glycosylase, das Uracil aus ihrer DNA enfernen könnte.
Darüberhinaus haben wir mit unseren eigenen Forschungsarbeiten gezeigt, dass in den Larven der Fruchtfliege Drosophila melanogaster das Verhältnis von dUTP zu dTTP auf ungewöhnliche Weise reguliert wird: in allen Geweben, die im adulten Insekt nicht benötigt werden, kommen viel niedrigere Spiegel des Enzyms vor, welches dUTP abbaut und einen Vorläufer der dTTP-Produktion erzeugt. Folglich werden in diesen Geweben während der DNA-Synthese erhebliche Mengen an Uracil eingebaut.
Es wird also während der Larvenstadien Uracil-DNA produziert und in Geweben, die während des Puppenstadiums abgebaut werden, nicht korrigiert. Da diesen Insekten im Puppenstadium das hauptsächliche Uracil-DNA-Glycosylase-Enzyme fehlt, erkennen wahrscheinlich zusätzliche Uracil-DNA-spezifische Faktoren dieses angesammelte Uracil als Signal für programmierten Zelltod. Wir haben bereits ein Insekten-spezifisches Protein entdeckt, das in der Lage zu sein scheint, Uracil-DNA abzubauen und wir untersuchen derzeit, ob dieses Enzym den programmierten Zelltod einleitet.
Nützliche Irrtümer: das Immunsystem der Vertebraten

in den Antikörper-
Gensequenzen löst eine
DNA-Reparaturantwort aus,
die zu Erhöhung der
Antikörperprotein-Vielfalt
führt. Ein umfangreicher
Antikörperpool erhöht die
Wahrscheinlichkeit des
Immunsystems, unbekannte
Eindringlinge zu erkennen
Mit freundlicher Genehmigung
von taramol / iStockphoto
Uracil in DNA findet man jedoch auch bei unserer Verwandtschaft – im Immunsystem von Vertebraten wie uns. Ein Teil unseres Immunsystems, das adaptive Immunsystem, stellt viele verschiedene Antikörper zur Abwehr spezifischer Pathogene her. Um die Zahl der verschiedenen möglichen Antikörper zu erhöhen, tauschen wir die DNA-Sequenzen in den codierenden Bereichen aus, rekombinieren aber nicht nur die bestehenden Sequenzen, sondern schaffen auch neue durch enorm erhöhte Mutationsraten, bekannt als Hypermutation.
Hypermutation beginnt mit einem spezifischen Enzym (einer durch Aktivierung induzierten Desaminase), welches an speziellen DNA-Loci Cytosin in Uracil ändert (siehe Abbildung 4) und damit eine durch Fehler erzeugte Reparaturantwort auslöst, die wiederum der Organismus zu seinem eigenen Vorteil nutzt: „Irrtümer“ erzeugen neue Sequenzen, die zur Herstellung verschiedener Antikörper genutzt werden können. Dieses System ist sehr genau reguliert, da es unkontrolliert zu Krebs führen würde.
Bei der Frage warum Uracil oder warum Thymin müssen wir den evolutionären Kontext betrachten. Lebende Organismen haben sich in einer ständig wechselnden Umwelt entwickelt und waren einer Reihe schnell wechselnder Bedrohungen ausgesetzt. Daher ist eine Lösung, die Einbaufehler in DNA vermeidet, für die meisten Organismen und Zellen vorteilhaft. Das erklärt, warum Thymin zum Normalfall wurde. Unter manchen Bedingungen jedoch können „Fehler“ vorteilhaft sein. Das ist der Grund, warum manche Zellen immer noch Uracil in ihrer DNA benutzen.
Resources
- Mehr über die Arbeit von Beáta Vértessy’s Forschergruppe ist zu finden unter: www.enzim.hu/~vertessy
- Die Zusammenfassung von Villő Muha’s PhD-Arbeit, die sich auf Uracil-DNA in Drosophila melanogaster konzentriert, mit Beáta Vértessy als Doktorvater, kann mit folgendem Link heruntergeladen werden: http://teo.elte.hu/minosites/tezis2010_angol/v_muha.pdf
-
Die vollständige Doktorarbeit bekommt man hier: http://teo.elte.hu/minosites/ertekezes2010/muha_v.pdf
-
Review
Dieser Artikel zeigt, dass sich Wissenschaft immer weiterentwickelt, indem er am Dogma rüttelt, dass Uracil nur in RNA vorkommt. Wie der Beitrag aufzeigt, ist das nicht immer der Fall. Und falls doch, warum sollte es so sein?
Damit die Schüler den Artikel verstehen, könnten ihnen folgende Fragen weiterhelfen:
- Beschreiben Sie die Bindungen zwischen zwei komplemantären Basenpaaren in DNA.
- Welche Base ist in RNA ersetzt?
- Beschreiben und stellen Sie graphisch den ausgelösten Reparaturenzym-Weg dar, wenn Uracil in DNA entdeckt wird.
- Das Verhältnis welcher Moleküle sollte eingestellt werden, um Krebszellen von Wachstum und Teilung abzuhalten?
- Warum wird Uracil in DNA “toleriert“?
- Welche lebenden Organismen nutzen Uracil und wie?
Friedlinde Krotscheck, Österreich





