Supporting materials
Guida alla cura delle planarie
Foglietto informativo sulla planaria
Foglio di lavoro sulla planaria
Foglio delle risposte alle domande della discussione
Download
Download this article as a PDF

Conosceremo la planaria, un affascinante verme piatto con incredibili capacità biologiche e modalità uniche e sorprendenti di rispondere a vari stimoli.
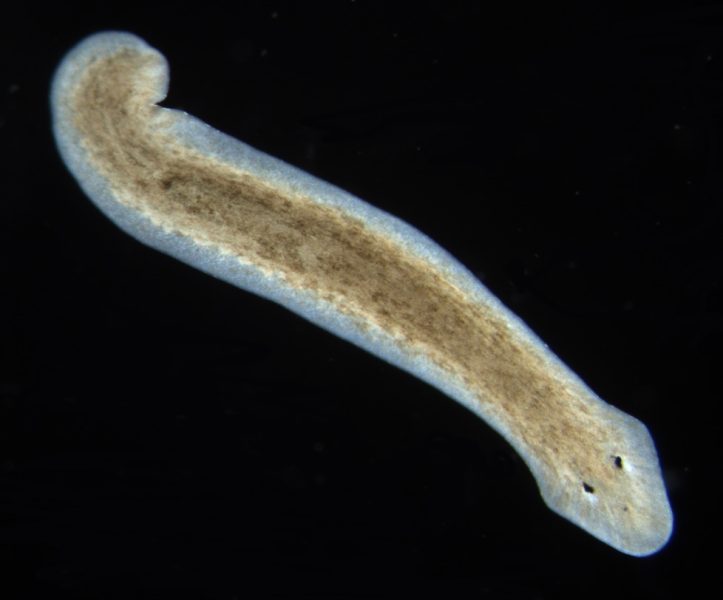
Le planarie d’acqua dolce, animali invertebrati non parassiti appartenenti al phylum dei Platelminti, i vermi piatti, sono organismi molto adatti a scopi didattici. Sono facili da allevare in laboratorio[1] poiché richiedono poche risorse e possono sopravvivere in un ambiente acquatico semplice. Inoltre, il loro allevamento è economico, sono visibili ad occhio nudo (sono lunghe da 1 a 10 mm[2]), e facili da utilizzare.

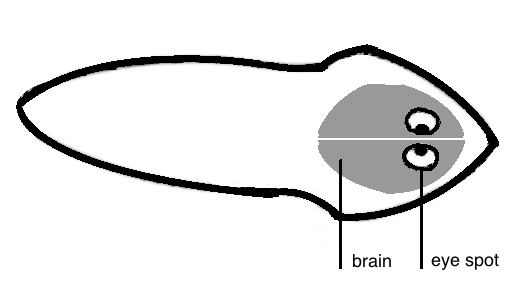
Le planarie sono animali a simmetria bilaterale, con un complesso sistema nervoso centrale e due ocelli (macchie oculari)[3].
L’osservazione e lo studio della natura riveste un ruolo cruciale nello sviluppo del pensiero umano. I metodi di insegnamento pratici sono spesso considerati efficaci in classe, non solo per spiegare i vari processi biologici, ma anche per stimolare la curiosità degli studenti.
Lavorare con le planarie permette agli studenti di comprendere più a fondo i vari aspetti degli organismi viventi. Osservando queste straordinarie creature, gli studenti possono approfondire la conoscenza dei sistemi di organi, delle strategie riproduttive e della relazione tra struttura e funzione negli organismi viventi. Le planarie offrono una possibilità di apprendimento pratico che consente agli studenti di esplorare e comprendere questi concetti biologici fondamentali.
L’approccio sperimentale, che proponiamo, è rivolto a studenti di età compresa tra i 14 e i 19 anni per lo studio delle questioni fondamentali riguardo alla risposta degli animali agli stimoli e alla loro capacità rigenerativa.
Opzione 1. Le planarie d’acqua dolce sono una delle circa 1300 specie che si trovano nei corsi d’acqua e nei laghi non inquinati, di solito situate sotto una roccia o alla base di un tronco. Possono essere facilmente raccolte dirigendo un leggero getto d’acqua sulla roccia e trasferendole in un contenitore con l’aiuto di una pipetta di plastica, evitando di danneggiare l’animale. Dopo la raccolta, devono essere trasportate in contenitori pieni d’acqua (senza aria), ad una temperatura compresa tra 1 e 25°C. In laboratorio, almeno la metà dell’acqua deve essere sostituita con acqua priva di cloro.
Opzione 2. In alternativa si può contattare il dipartimento di biologia di una università. Alcuni ricercatori utilizzano le planarie e sono propensi a fornire gli animali a scopo didattico.
La guida alla cura delle planarie fornisce un vademecum completo sulla preparazione del cibo per le planarie.
In questa attività, gli studenti possono studiare come questi organismi reagiscono agli stimoli della luce, del cibo e del tatto. Ciò permette agli studenti di acquisire conoscenze sulle capacità sensoriali e sugli adattamenti comportamentali delle planarie e può contribuire ad una più approfondita conoscenza della loro biologia e delle loro interazioni con l’ambiente.
L’attività è adatta per studenti di età compresa tra i 14 e i 19 anni; sono necessari dai 30 ai 45 minuti per svolgere l’esercitazione. La scheda informativa della planaria può essere distribuita prima dell’attività o alla fine, prima della discussione, in modo che gli studenti possano acquisire maggiori informazioni su queste creature affascinanti.
Le planarie possono essere trasferite da un contenitore all’altro con l’utilizzo di una pipetta Pasteur di plastica con il foro abbastanza grande per prelevare i vermi senza danneggiarli. Se il foro non fosse abbastanza grande, si può tagliare la punta della pipetta con un paio di forbici.
Esaminare il foglio di lavoro e discutere i seguenti punti. I docenti possono trovare esempi di risposte sul foglio delle risposte nel materiale di supporto per avere a disposizione contenuti pronti all’uso.
Infine, sfidate gli studenti a progettare un proprio esperimento con uno stimolo sulle planarie.
Sebbene tutti gli organismi multicellulari necessitino di cellule staminali per sopravvivere e riprodursi, le planarie sono capaci di rigenerare qualsiasi regione del corpo mancante[4] in un tempo relativamente breve. Questa capacità rigenerativa deriva dall’abbondanza di cellule staminali, le uniche cellule capaci di dividersi e differenziarsi in qualsiasi tipo cellulare.[5] Le planarie sono studiate soprattutto per la loro capacità di rigenerarsi rapidamente da qualsiasi frammento del corpo. Hanno un numero elevato di cellule staminali adulte chiamate neoblasti, che rappresentano il 20-30% delle loro cellule e che sono in grado di dividersi e differenziarsi in qualsiasi tipo cellulare.
La rigenerazione è un processo affascinante che permette di sostituire strutture danneggiate o perse e che richiede non solo la produzione di nuovi tessuti, ma anche la riorganizzazione dei tessuti pre-esistenti per garantire le dimensioni e le proporzioni corrette dell’animale rigenerato.[6] La forma del corpo è mantenuta indipendentemente dal tipo di lesione, conservando le proporzioni corrette anche quando l’animale appena rigenerato è molto più piccolo dell’originale.[7] In seguito all’amputazione, la muscolatura si contrae per chiudere il taglio e ridurre al minimo l’area della ferita e l’esposizione dei tessuti interni.[8] Il frammento tagliato continuerà a muoversi; probabilmente questo meccanismo consente alla planaria di sfuggire ad un eventuale predatore.[7] Dopo 30 minuti, si verifica la migrazione di un sottile strato di cellule nell’area colpita.[9] In seguito, le cellule staminali aumentano il loro tasso di rigenerazione e, a livello della zona lesionata, generano un nuovo tessuto privo di pigmentazione, il blastema, e si differenziano per sostituire le parti perse.[10] La rigenerazione è completa quando l’animale raggiunge le proporzioni corrette e la pigmentazione è omogenea. Dopo due settimane, le planarie sono in grado di nutrirsi regolarmente. Si può monitorare l’evoluzione della rigenerazione con una lente di ingrandimento stereoscopica e una ripresa fotografica.
L’attività è adatta per studenti di età compresa tra i 14 e i 19 anni; sono necessarie due lezioni per completare l’esercitazione.


Discutere le seguenti domande. Si possono trovare esempi di risposte sul foglio delle risposte nel materiale di supporto.
Le planarie si restringono anche in condizioni di scarsa nutrizione. Si può studiare questa situazione attraverso un’attività di approfondimento, come descritto nel materiale di supporto.
[1] Merryman MS, Sánchez Alvarado A, Jenkin JC (2018) Culturing planarians in the laboratory. In Rink JC (ed.) Planarian Regeneration. Methods and Protocols pp 241–258. Humana Press. ISBN: 9781493978007
[2] Dean MRP, Duncan EM (2020) Laboratory maintenance and propagation of freshwater planarians. Current Protocols in Microbiology 59: e120. doi: 10.1002/cpmc.120.
[3] Reho G, Lelièvre V, Cadiou H (2022) Planarian nociception: Lessons from a scrunching flatworm. Frontiers in Molecular Neuroscience 15: 935918. doi: 10.3389/fnmol.2022.935918
[4] Wu J-P, Li M-H (2018) The use of freshwater planarians in environmental toxicology studies: Advantages and potential. Ecotoxicology and Environmental Safety 161: 45–56. doi: 10.1016/j.ecoenv.2018.05.057
[5] Felix DA et al. (2019) It is not all about regeneration: Planarians striking power to stand starvation. Seminars in Cell & Developmental Biology 87: 169–181. doi: 10.1016/j.semcdb.2018.04.01
[6] Rink JC (2018) Stem cells, patterning and regeneration in planarians: Self-organization at the organismal scale. In Rink JC (ed.) Planarian Regeneration. Methods and Protocols pp 57–172. Humana Press. ISBN: 9781493978007
[7] Reddien PW, Sánchez Alvarado A (2004) Fundamentals of planarian regeneration. Annual Review of Cell and Developmental Biology 20: 725–757. doi: 10.1146/annurev.cellbio.20.010403.095114
[8] Levin M, Pietak AM, Bischof J (2018) Planarian regeneration as a model of anatomical homeostasis: Recent progress in biophysical and computational approaches. Seminars in Cell & Developmental Biology. 87: 125–144. doi: 10.1016/j.semcdb.2018.04.003
[9] Noreña C, Damorenea C, Brusa F (2014) Phylum Platyhelminthes. In Thorp JH, Rogers DC (eds) Ecology and General Biology: Thorp and Covich’s Freshwater Invertebrates 4th edition, Chapter 10. Academic Press. ISBN: 9780123850263
[10] Pascual-Carreras E et al. (2023) Wnt/β-catenin signalling is required for pole-specific chromatin remodeling during planarian regeneration. Nature Communications 14: 298. doi: 10.1038/s41467-023-35937-y
L’articolo fornisce una preziosa lettura di base quando si insegna l’evoluzione e la biologia dello sviluppo o quando si spiega perché dobbiamo mangiare e fornire sostanze organiche alle nostre cellule attraverso il cibo, o come un organismo è in grado di rispondere alle sollecitazioni ambientali. Mostra anche come un semplice organismo invertebrato possa servire a chiarire alcuni processi presenti in organismi molto più complessi, che non possiamo utilizzare in laboratorio.
E’ una novità in una classe delle superiori poter vedere come funzionino i blasti o come un organismo risponda alle sollecitazioni ambientali o come un organismo sia in grado di regolare la propria crescita in base alla presenza o all’assenza di cibo.
Alina Giantsiou Kyriacou, docente di Biologia presso la Kykkos B High School a Nicosia, Cipro.