Supporting materials
Download
Download this article as a PDF

Los comprimidos de lactasa para tratar la intolerancia a la lactosa pueden utilizarse en el aula para explorar la bioquímica de los azúcares y las propiedades de las enzimas.
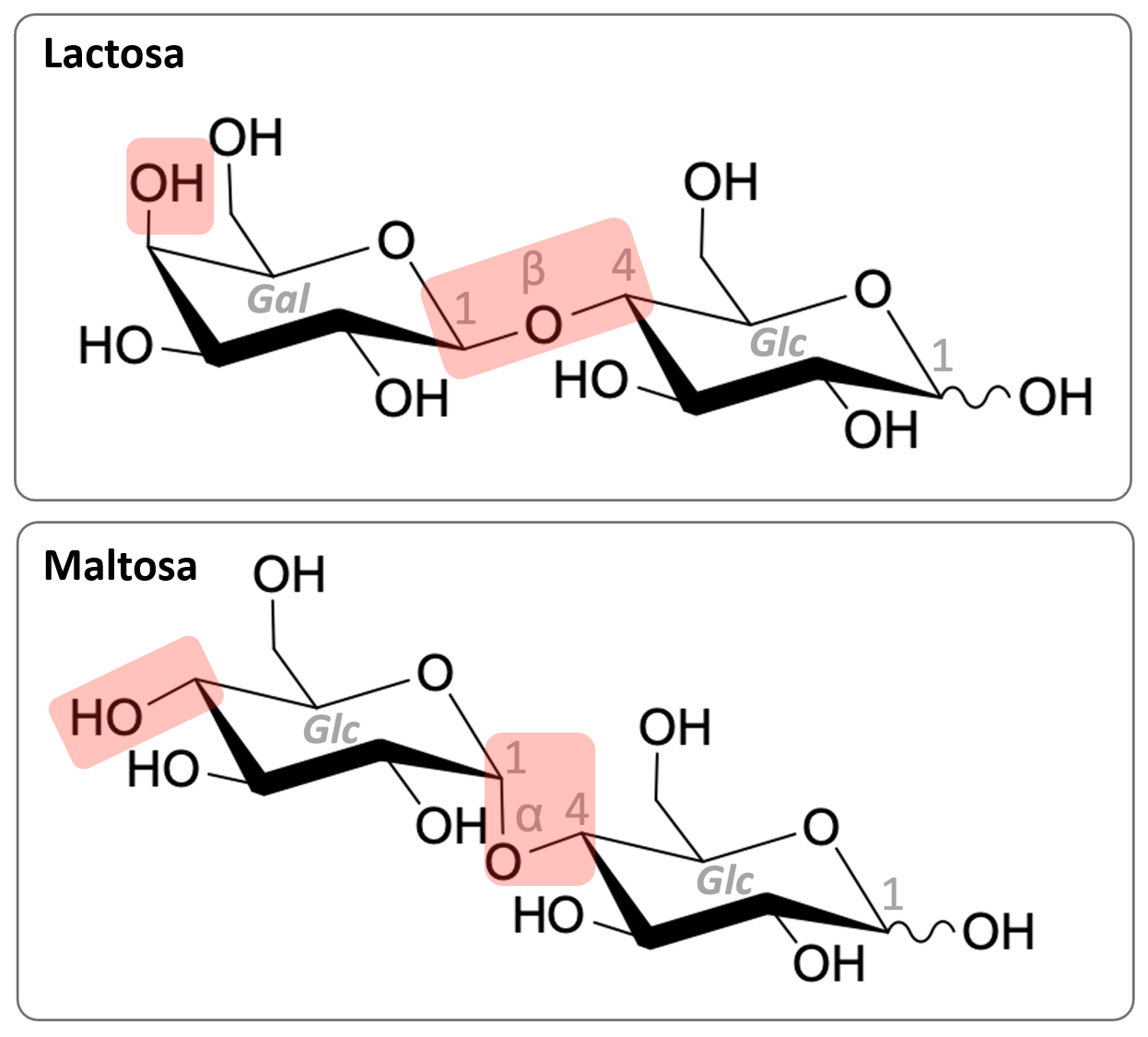
La intolerancia a la lactosa es un fenómeno frecuente,[1] basado en la ausencia o producción insuficiente de la enzima digestiva β-galactosidasa (lactasa)[2]. Las personas afectadas son incapaces de descomponer el disacárido lactosa (figura 1, arriba) en sus subunidades de monosacáridos, glucosa (Glc) y galactosa, y pueden sufrir diarrea y flatulencia[3] tras ingerir alimentos que contienen lactosa. Como respuesta, ha surgido un mercado creciente de alimentos sin lactosa. Las personas afectadas pueden optar también por tomar lactasa en forma de comprimidos para ayudarles a digerir los alimentos que contienen lactosa. En las alternativas lácteas, como la leche de avena, se encuentra la maltosa (figura 1, abajo). Las diferencias estructurales menores entre la lactosa y la maltosa son la posición espacial de un único grupo hidroxilo y el tipo de enlace glucosídico entre las unidades de monosacáridos (figura 1, resaltado en rojo).
Aquí presentamos actividades que abordan los temas curriculares de la enzimología y los azúcares utilizando métodos científicos que son adecuados para alumnos de 14 a 18 años. Los alumnos investigan la actividad de los comprimidos de lactosa en dos azúcares estrecha y estructuralmente relacionados, la lactosa y la maltosa, tanto disueltos como en leche entera y leche de avena. Estos experimentos demuestran que la enzima lactasa es específica del sustrato lactosa, mientras que la maltosa no puede descomponerse. Otros experimentos abordan por qué las personas intolerantes a la lactasa no deben tomar comprimidos de lactasa con el estómago vacío, revelando así la dependencia del pH de las enzimas. Además, los alumnos pueden investigar el efecto de la temperatura sobre las enzimas y por qué estos medicamentos deben protegerse del calor, de ese modo, explorarán el impacto de las enzimas, o la falta de ellas, en la vida cotidiana.
La prueba de Fearon[4] se utiliza para detectar azúcares durante todos los experimentos, ya que permite una diferenciación fácil, segura y vívida de los azúcares[5].
En esta actividad preparatoria, los alumnos se inician en la detección de azúcares utilizando el reactivo de Fearon en diversas soluciones azucaradas, así como en leche entera y leche de avena.
La reducción de disacáridos ligados a 1,4, como la maltosa, la lactosa y la celobiosa, puede detectarse con el reactivo de Fearon mediante la formación de un colorante rojo brillante. Por el contrario, los monosacáridos, como la glucosa, producirán un tinte amarillo, mientras que los disacáridos β-1,2-ligados, como la sacarosa, no provocarán un cambio de color. El mecanismo de formación del colorante con el reactivo de Fearon no está totalmente explicado, hasta la fecha; sin embargo, existen hipótesis bien fundadas apoyadas por un creciente cuerpo de pruebas empíricas[7].
Esta actividad dura unos 15 minutos.
Equipamiento por grupo:
Productos químicos:
Observaciones:
Los tubos de ensayo 1 (Lac), 2 (Mal), 5 (entero) y 6 (avena) son de color rojo.
El tubo de ensayo 3 (Glc) es de color amarillo.
El tubo de ensayo 4 no parece cambiar de color.

Interpretación: Los resultados experimentales muestran que los disacáridos 1,4-ligados (lactosa, maltosa) pueden detectarse utilizando el reactivo de Fearon mediante un color rojo. Uno o ambos de estos azúcares están presentes tanto en la leche entera como en la de avena. Además, la glucosa (y otros monosacáridos reductores) puede detectarse en solución mediante la formación de un colorante amarillo.
La prueba de Fearon se utiliza como herramienta para investigar la actividad y la especificidad de sustrato de la enzima lactasa, que las personas intolerantes a la lactosa toman en forma de comprimidos como complemento alimenticio. En concreto, en esta actividad exploramos los efectos de la lactasa sobre dos azúcares estructuralmente relacionados, la lactosa y la maltosa (figura 1), así como sobre la leche entera y la leche de avena.
Esta actividad dura unos 20 minutos.
Equipamiento por grupo:
Productos químicos:
Nota: Es importante utilizar agua del grifo y no agua destilada para preparar soluciones enzimáticas, ya que contiene determinadas especies iónicas, por ejemplo, calcio, que puede actuar como cofactor enzimático.
Observaciones: Tras la adición del reactivo de Fearon, aparece un color amarillo en los tubos de ensayo 1 (Lac) y 3 (leche entera) durante la incubación en el baño de agua, mientras que en los tubos de ensayo 2 (Mal) y 4 (leche de avena; figura 3, comparar las imágenes superior e inferior) se forma un colorante rojo.

Interpretación: La ausencia de colorante rojo en los tubos de ensayo 1 (lactosa) y 3 (leche entera) indica la desaparición de los disacáridos 1,4-ligados de estos líquidos, mientras que la aparición de un colorante amarillo señala la presencia de glucosa, producto conocido de la descomposición de la lactosa (figura 1, arriba). Estos resultados demuestran que la lactasa descompone con éxito el azúcar de la leche (lactosa) en glucosa y galactosa.
En cambio, en los tubos de ensayo 2 (maltosa) y 4 (leche de avena) se sigue formando un colorante rojo tras el tratamiento con lactasa. Esto indica que la maltosa no puede ser digerida por la lactasa, demostrando así la especificidad del sustrato de esta enzima y que la leche de avena contiene maltosa, o un disacárido diferente de 1,4 enlaces, que no puede ser digerido por la lactasa.
Las instrucciones que figuran en los envases de los comprimidos de lactasa suelen advertir del peligro de tomarlos con el estómago vacío. En esta actividad, escrutamos experimentalmente este descargo de responsabilidad. La lactasa ingerida en forma de comprimidos tiene que pasar por el estómago humano, un medio ácido que contiene ácido clorhídrico en diferentes concentraciones, según el nivel de llenado. Por lo tanto, simulamos la exposición de la lactasa al “ácido gástrico” en un estómago vacío mediante la preincubación en ácido clorhídrico y evaluamos su rendimiento digestivo tras este tratamiento.
Esta actividad dura unos 25 minutos.
Equipamiento por grupo:
Productos químicos:
Notas
Observación: Al contrario que en un experimento anterior (Actividad 2) sin preincubación con ácido clorhídrico, se observa la formación de un colorante rojo en los cuatro ensayos (figura 4). Estos resultados son idénticos a los obtenidos en las pruebas Fearon con lactosa, maltosa, leche entera y leche de avena sin digestión previa de la lactasa (figura 2, abajo).

Interpretación: La actividad enzimática depende en gran medida del valor del pH ambiental. Al disolver la tableta de lactasa en ácido clorhídrico 0,1 M, simulamos la ingestión de tabletas de lactasa con el estómago vacío. La persistencia de la formación de colorante rojo utilizando el reactivo de Fearon y la ausencia de formación de colorante amarillo – que indica la formación de glucosa como resultado de la descomposición de la lactosa (como se observó durante un experimento anterior sin pretratamiento ácido; figura 3) – demuestran la pérdida de actividad de la lactasa en condiciones de pH bajo como las de un estómago humano vacío. Esto puede explicarse por los cambios en la estructura tridimensional de la enzima debidos a la desnaturalización ácida.
Las instrucciones del envase de los comprimidos de lactasa también suelen advertir contra la exposición de los medicamentos al calor, por ejemplo, tomándolos con bebidas calientes. Como actividad complementaria opcional, puedes explorar la influencia del calor en la actividad enzimática. Los detalles figuran en el material de apoyo.
[1] Autoridad Europea de Seguridad Alimentaria (EFSA, por sus siglas en inglés) (2009) Scientific opinion on the substantiation of health claims related to lactase enzyme and breaking down lactose (ID 1697, 1818) pursuant to Article 13(1) of Regulation (EC) No 1924/20061. EFSA Journal 7: 1236–1249. doi: 10.2903/j.efsa.2009.1236
[2] Swallow DM (2003) Genetics of lactase persistence and lactose intolerance. Annual Review of Genetics 37: 197–219. doi: 10.1146/annurev.genet.37.110801.143820
[3] Ingram CJE et al. (2009) Lactose digestion and the evolutionary genetics of lactase persistence. Human genetics 124: 579–591. doi:10.1007/s00439-008-0593-6
[4] Fearon WR (1942) The detection of lactose and maltose by means of methylamine. The Analyst 67: 130–132. doi: 10.1039/an9426700130
[5] Ruppersberg K et al. (2020) How to visualize the different lactose content of dairy products by Fearon’s test and Woehlk test in classroom experiments and a new approach to the mechanisms and formulae of the mysterious red dyes. Chemistry Teacher International 2: 1–11. doi: 10.1515/cti-2019-0008
[6] Ruppersberg K, Rautenstrauch H (2023) Zucker unterscheiden: Herstellung und Anwendung von Fearon’s Reagenz. Unterricht Chemie 193: 49–50.
[7] Ruppersberg KM, Kussler M (2023) Über die rote Farbe bei Zuckernachweisen. Nachrichten aus der Chemie 71: 68–73. doi: 10.1002/nadc.20234133798
The article exhibits a high degree of rigor, both in its experimental design and in the presentation of results. The methodology appears sound, and the data analysis is robust. This activity can serve as an excellent illustration of the crucial role of chemistry in understanding biological phenomena. By showcasing how a sound understanding of chemistry is integral to the study of biology, it reinforces the importance of a strong foundation in mathematics, physics, and chemistry for students pursuing careers or further studies in the life sciences.
Antonio Pedro Fonseca
Science Teacher/Microbiology Professor (invited)
Download this article as a PDF