Supporting materials
Download
Download this article as a PDF

Cambios gota a gota. Vamos a estudiar la química de los indicadores pH y las reacciones de neutralización; obtendremos colores vistosos mediante el uso de la química a microescala que es barata, rápida y fácil de realizar.
Podemos usar los indicadores coloreados como una estrategia para presentar a los estudiantes la química. Este concepto se seguirá usando a lo largo de los estudios. Los indicadores se usan para valoraciones; en la medicina se estudian las variaciones de pH en la orina causadas por infecciones de riñón; en estudios medioambientales se analiza el agua potable; la de las corrientes, ríos, acuarios y también es estudia el pH del suelo. Las actividades que se proponen son adecuadas para estudiantes de 11-16 años.

Trabajar la química a microescala ahorra tiempo en las actividades de laboratorio y en la limpieza al finalizar. Además, los alumnos están sentados, lo que facilita la gestión de las clases prácticas.
Para esta actividad vamos a usar una plantilla similar a la de la derecha que están en el archivo Plantillas
También hay otro documento, Notas prácticas, que contiene consejos sobre la confección de plantillas e instrucciones para preparar las disoluciones reguladoras.
Se utilizan disoluciones muy poco peligrosas pero hay que utilizar gafas de protección.
El tornasol y el azul de bromotimol viran a pH 7. Pero los estudiantes tienen que tener claro que no todos los indicadores viran a pH 7, aunque sea una disolución neutra con el mismo número de iones hidronio e hidróxido.

Podemos adaptar el trabajo a los productos químicos que dispongamos:
Se pueden usar otros indicadores de síntesis como timolftaleína o azul de bromofenol.
Podemos repetir las reacciones para centrarnos en diferentes aspectos químicos. Los cambios de color son muy atractivos para los estudiantes más jóvenes pero este cambio puede usarse para explicar las reacciones reversibles, un concepto muy difícil.
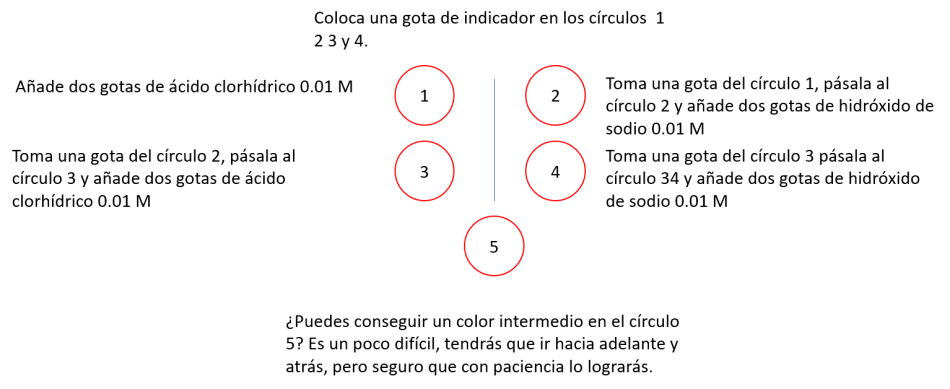
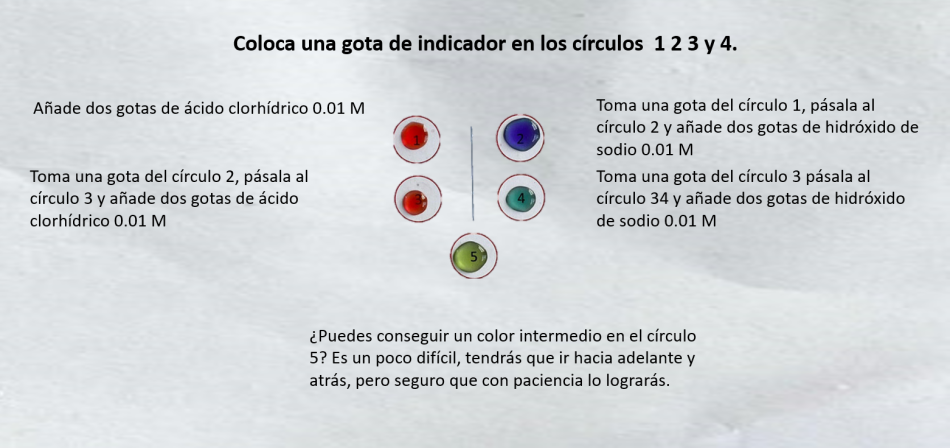
Los indicadores son ácidos débiles en los que el color de la forma ácida (HIn(aq)) es diferente del de su base conjugada (In−(aq)).
Este método permite alternar entre las dos formas del indicador por adiciones sucesivas de ácido y de base.
Esto significa que podemos explicar el cambio mediante el principio de Le Chatelier. Sin embargo, es preferible explicar estos comportamientos utilizando la ecuación de la constante de equilibrio, valor que es constante si no varía la temperatura:
Si aumentamos la concentración de iones hidrógeno, para que Kc permanezca constante, tiene que aumentar el valor de [HIn]eq. Si añadimos iones hidróxido, disminuye [H+]eq por lo tanto [In−]eq tiene que aumentar para que Kc siga siendo constante.
Utilizar indicadores muy diluidos y naturales para ilustrar las reacciones reversibles es un ejemplo de química ‘verde’. Muchas veces se cita en los textos como ejemplo de reacciones reversibles el equilibrio cromato/dicromato que sucede al variar la acidez. Sin embargo, los compuestos de cromo (VI) son muy peligroso y hay que sustituirlos por otros ‘verdes’ para bien de los estudiantes y del medio ambiente.

El naranja de metilo, un indicador sintético, cambia de color muy rápidamente en un estrecho intervalo de pH.
El indicador universal muestra un cambio de color gradual en un intervalo amplio de pH. Se fabrica mezclando diferentes indicadores, así se producen sucesivos cambios en el color. La mezcla comercial está basada en rojo de metilo, azul de timol, azul de bromotimol y fenolftaleína. Los estudiantes pueden hacer una versión con naranja de metilo usando la plantilla adjunta. Los colores, que atraen inmediatamente la atención de los estudiantes, pueden ser el punto de partida para investigar sobre los indicadores naturales.
Esta actividad, realizada a la manera tradicional, necesitaría 20 tubos de ensayo. Con este enfoque los estudiantes pueden trabajar solos. Todas las instrucciones de la actividad se pueden visualizar de un vistazo, lo que reduce la carga de memoria a corto plazo y ayuda a que se retenga información en la memoria a largo plazo.
Las disoluciones presentan muy poco peligro pero se deben usar gafas de protección.
Cuestiones para discutir con los estudiantes:
En esta actividad los estudiantes observarán los siguientes cambios de color:

El azul de bromotimol, el naranja de metilo y la fenolftaleína viran con un salto de una o dos unidades de pH y a veces, con un claro cambio de color, lo que les hace idóneos para valoraciones.
Los cambios de color son debidos a que las moléculas muestran diferentes colores en función del pH de la disolución. El rango de pH para el cambio de color puede variar de unos indicadores a otros:
| Indicador | Rango de pH para el cambio de color |
|---|---|
| Azul de bromotimol | 6.0–7.6 |
| Narnaja de metilo | 3.2–4.4 |
| Fenolftaleína | 8.3–10.0 |
Si mezclamos los indicadores obtendremos diferentes colores al variar el pH. Este es el fundamento de los indicadores universales, que sirven para determinar el pH de una sustancia.
Como actividad de ampliación los estudiantes pueden usar indicadores de origen vegetal.
Cuando se añade indicador a una gota de agua en el plástico sucede una preciosa reacción química. El ácido cítrico y el carbonato de sodio se añaden uno por cada lado. Inmediatamente aparecen colores diferentes perro cuando se juntan los colores comienza la aparición de burbujas de dióxido de carbono.
Las disoluciones y los sólidos presentan muy poco peligro pero se deben usar gafas de protección.
Comenta con tus estudiantes las siguientes cuestiones:
Los estudiantes tienen que observar los siguientes cambios de colores:

Esta es una reacción de neutralización en la que el ácido cítrico reacciona con un carbonato metálico básico -en este caso carbonato de sodio. Se necesita agua para que se produzca la reacción porque tiene que romper las redes iónicas de los reactivos al introducirlos desde ambos lados de la gota cuando comienzan a disolverse. Esto permite que los iones se difundan y suceda la neutralización. Los productos des esta reacción son una sal (citrato de sodio) además de agua y dióxido de carbono.
Hay que hacer notar a los estudiantes que las burbujas de dióxido de carbono aparecen en la zona verde amarillenta, neutra, que es donde sucede la neutralización.
Muchos profesores son reacios a practicar estos métodos. Está bien hablar y escribir sobre estas técnicas de manera teórica pero lo realmente importante es probarlas en el aula. Adrian y yo hemos comprobado que la publicación de fotos y vídeos en las redes sociales como Twitter o grupos de Facebook aumenta el interés por esta técnica.
¿Tienes alguna foto de esta actividad para compartir con nosotros? Etiquétanos en tu red social (Twitter, Facebook, or Instagram), y crearemos una colección en nuestras páginas de Facebook e Instagram.
Los autores quieren agradecer a Beth Sutherland y Pixie Murray su trabajo para probar estos métodos y documentar sus resultados con fotos y también a Howard Tolliday por proporcionarnos plantas que probamos en la Dornoch Academy, Scotland, UK.
La química a microescala es muy barata y permite realizar más actividades prácticas en el aula. Los autores describen actividades de reacciones ácido-base muy atractivas sobre ‘bandejas de reacciones químicas’ fabricadas por vosotros, bandejas que combinan el guión de prácticas con un lugar donde hacer investigaciones químicas sobre él.
Ingo Eilks es profesor de didáctica de la química en la Universidad de Bremen, Alemania.
Download this article as a PDF