Schneller, billiger, CRISPR: die neue Gentechnik-Revolution Understand article
Übersetzt von Oliver Abel. Eine kontroverse neue Technologie macht Genome Editing um vieles billiger und einfacher – vielleicht auch zu einfach?

von Nicola Graf
Beim Schreiben eines Satzes fällt ein Tippfehler auf. Der Fehler verändert den Sinn des Satzes, also positioniert man den Cursor vor dem falschen Buchstaben, drückt die Löschtaste und tippt den korrekten Buchstaben ein. Das ist denkbar einfach. Erstaunlich ist, dass ähnlich simpel wie Autoren Texte korrigieren, Wissenschaftler in Laboren DNA verändern können.
Diese Möglichkeit bietet CRISPR-Cas9, eine neue gentechnische Methode, welche in den letzten Jahren die Wissenschaft im Sturm erobert hat. Einerseits verspricht die Methode entscheidende biomedizinische Fortschritte, andererseits stellt sie uns gegenwärtig vor einige schwierige Probleme. Tatsächlich wurde in den Medien schon so intensiv über die kontrovers diskutierte Technologie berichtet, dass Lehrerinnen und Lehrer, die naturwissenschaftliche Fächer unterrichten, einige Fragen von Schülern über CRISPR-Cas9 zu beantworten haben. Deshalb lesen Sie hier unseren ‚Crashkurs‘ über CRISPR-Cas9 und dessen Relevanz.
Was ist CRISPR-Cas9?
CRISPR-Cas9 ist ein Abwehrmechanismus, der es Bakterien ermöglicht, sich gegen Virusattacken zu verteidigen. Dieser Mechanismus wird jedoch seit kurzem als gentechnische Methode genutzt, um Genome an präzise festgelegten Stellen zu schneiden. Das bakterielle Abwehrsystem umfasst zwei unterschiedliche Komponenten: CRISPR und Cas9. CRISPR steht für clustered regularly interspaced short palindromic repeats und bezeichnet Regionen im Genom, in denen sich DNA-Sequenzen wiederholen. In der Nähe dieser Sequenzen befinden sich sogenannte Cas-Gene, die für wichtige Enzyme des bakteriellen Abwehrsystems kodieren. Eines davon ist die Nuklease Cas9, ein Enzym das Nukleinsäure (DNA oder RNA) schneidet.
Infiziert ein Virus ein Bakterium, injiziert es Nukleinsäure in das Bakterium, welches mit der Produktion von Cas-Enzymen darauf reagiert. Diese schneiden Stücke aus der viralen Nukleinsäure heraus, um sie an den CRISPR-Loci ins eigene Genom zu integrieren (Abbildung 1). Dadurch erwirbt das Bakterium Immunität, die bei einer sekundären Attacke der gleichen Virusart sehr nützlich ist. Bei einem erneuten Angriff werden die CRISPR-Loci, die auch die viralen DNA-Sequenzen enthalten, in kurze RNA-Moleküle kopiert, die zuerst an die Cas9-Enzyme binden und dann den so gebildeten Komplex zur invasiven viralen Nukleinsäure leiten, welche durch die passenden homologen Sequenzen identifiziert wird. Cas9 schneidet dann an der Zielsequenz und so wird das Virus daran gehindert, die Kontrolle über das Wirtsbakterium zum Zweck der eigenen Vervielfältigung zu übernehmen.
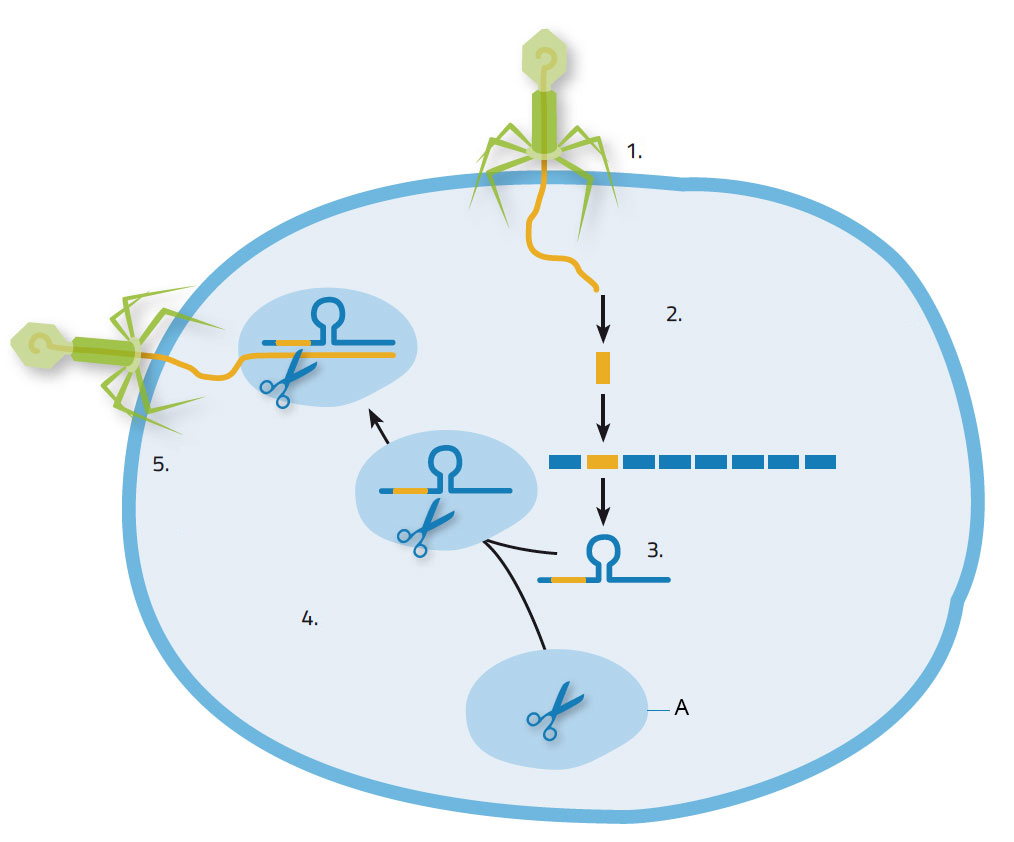
1. Ein Virus infiziert eine Bakterienzelle; 2. Virale Nukleinsäure wird an den CRISPR-Loci in die bakterielle DNA integriert; 3. Bildung der CRISPR-RNA; 4. CRISPR-RNA bindet an das Cas9-Enzym; 5 CRISPR-RNA leitet das Cas9-Enzym zum Virus. Es schneidet und zerstört das Virusgenom.
Mit freundlicher Genehmigung von Nicola Graf
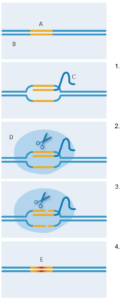
mit CRISPR-Cas9.
A: Zielsequenz;
B: DNA;
C: Leit-RNA;
D: Cas9;
E: Neue DNA-Sequenz
1. Die Leit-RNA bindet an die
Ziel-DNA-Sequenz;
2. Das Cas9-Enzym bindet an
die Leit-RNA;
3. Das Cas9-Enzym schneidet
den DNA-Doppelstrang;
4. Die neue DNA wird durch
das bakterielle
Reparatursystem am
Doppelstrangbruch eingefügt
und ersetzt die ursprüngliche
DNA-Sequenz.
Mit freundlicher Genehmigung
von Nicola Graf
Aber wie wurde das bakterielle Abwehrsystem so verändert, dass es jetzt als neue gentechnische Methode zur Verfügung steht? Die beiden Arbeitsgruppen von Jennifer Doudna (Universität von Kalifornien Berkeley, USA) und Emanuelle Charpentier (damals noch an der schwedischen Umea Universität) veränderten 2012 die kurzen RNA-Moleküle und fügten sie zu einer einzigen Leit-RNA zusammen (Abbildung 2). Diese behielt das an Cas9 bindende Ende, aber die Sequenzen am anderen Ende ließen sich so manipulieren, dass sie an jede beliebige bekannte Ziel-DNA binden konnten. Diese Möglichkeit der individuellen Anpassung ermöglichte CRISPR-Cas9, DNA-Sequenzen an spezifischen Stellen nach Wunsch zu schneiden. Kurz darauf entwickelte Feng Zhangs Arbeitsgruppe am Massachusetts Institute of Technology (USA) CRISPR-Cas9 weiter und wies dessen Fähigkeit nach, präzise genomische Schnitte in menschlichen Zellen sowie Mauszellen durchführen zu können (Cong et al, 2013). Zusätzlich optimierten sie CRISPR-Cas9 so, dass durch eine minimal veränderte Art zu schneiden, spezifische DNA-Reparaturmechanismen in der Zelle aktiviert wurden. Das bedeutet, die Forscher fügten erfolgreich eine neue DNA-Sequenz ganz genau an der zuvor geschnittenen Stelle ein, welche die Originalsequenz ersetzte (Abbildung 2).
Dank dieses entscheidenden Durchbruchs beendete CRISPR-Cas9 sein mikrobiologisches Nischendasein und wurde ein aufregendes Forschungsinstrument, das Forscher in die Lage versetzt, Gene zu verschiedenen Zwecken mit Leichtigkeit sowie hoher Spezifität zu editieren.
Wofür wird CRISPR-Cas9 verwendet?
Um Funktionen von Genen zu erforschen, versuchen Wissenschaftler oft Zelllinien oder Modellorganismen zu erzeugen, bei denen das zu erforschende Gen entweder mutiert oder inaktiviert ist (dieses Verfahren wird auch als knockout bezeichnet). Mit CRISPR-Cas9 lässt sich dies präzise und schnell bewerkstelligen. Auch lässt sich das Cas9-Enzym so verändern, dass es die Fähigkeit, DNA zu schneiden, verliert, aber dank der Leit-RNA immer noch spezifisch an DNA-Zielsequenzen binden kann. So kann das Binden der RNA-Polymerase verhindert werden. Dadurch werden Wissenschaftler in die Lage versetzt, die Transkription von Genen, den Ursprung der genetischen Aktivität, kontrollieren zu können.
Neben diesen wichtigen Anwendungsbereichen in der biomedizinischen Forschung, verspricht CRISPR-Cas9 auch in medizinisch therapeutischen Bereichen, Verwendung zu finden. Wissenschaftlern ist es durch CRISPR-Cas9 Genome Editing bereits gelungen, HIV-Sequenzen aus menschlichen Zelllinien wieder herauszuschneiden und somit das Virus an der Vermehrung innerhalb der Zellen zu hindern. Die Methode wurde auch eingesetzt, um mutierte Duchenne Muskeldystrophie Gen-Sequenzen (Ursache für krankhafte Muskelschwäche) bei Mäusen zu entfernen. Das schürt Hoffnung auf eine Therapie bei von Duchenne oder ähnlichen Erbkrankheiten betroffenen Patienten und Familien. In der Hoffnung, Organe zur Verfügung stellen zu können, die bei Transplantation in den Menschen weniger Immunabwehrreaktionen auslösen, versucht man seit kurzem ganz intensiv, Schweineembryos durch CRISPR-Cas9 Genome Editing zu verändern.
In Schweineembryonen wurden Genome bereits editiert. Wäre das gleiche folglich auch bei menschlichen Embryonen möglich? Genau das haben chinesische Forscher im Jahr 2015 gemacht, indem sie mit CRISPR-Cas9 bei 86 menschlichen Embryonen das Beta-Thalasämie Gen modifizierten (Cyranoski & Reardon, 2015). Die Methode erwies sich als ziemlich wenig effizient, da noch nicht einmal bei einem Viertel der Embryonen die DNA-Sequenz erfolgreich verändert werden konnte. Wegen der ethischen Implikationen hatte die Veröffentlichung dieser Forschungsergebnisse trotzdem heftige Kontroversen zur Folge.
Ethische Aspekte und die Zukunft
Die ethischen Bedenken haben nicht nur Experimente am menschlichen Embryo sondern auch unangenehme Zukunftsszenarien für gezielte Eingriffe in die Keimbahn zum Gegenstand. Mit CRISPR-Cas9 wäre es theoretisch möglich, Geschlechtszellen (Spermien sowie Eizellen) so zu verändern, dass die gentechnischen Manipulationen an die nachfolgenden Generationen vererbt werden. Während dieses Verfahren einerseits ein hohes Potenzial aufzeigt, Erbkrankheiten auszurotten, stellt sich andererseits die Frage, welche genetischen Veränderungen zu medizinisch therapeutischen Zwecken zukünftig erlaubt sein sollten. Könnte die Manipulation von Erbmerkmalen wie Augenfarbe sowie Intelligenz jemals als im therapeutischen Sinne angemessen und notwendig erachtet werden? Diese Befürchtungen mögen weithergeholt erscheinen, jedoch existieren darüber hinaus noch andere Bedenken. Genetische Manipulationen der Keimbahn könnten komplett unvorhersehbare und nicht mehr rückgängig zu machende Auswirkungen auf zukünftige Generationen haben. Das ist besonders deshalb von Relevanz, da die neuere Genforschung zeigt, dass Wechselwirkungen zwischen Genen und anderen Vererbungsmechanismen bei weitem komplexer sind als jemals zuvor erwartet.
Diese Implikationen sind Wissenschaftlern durchaus bewusst. Einige von ihnen sind sich einig, dass gentechnische Veränderungen der Keimbahn ein ethisch moralisches Minenfeld darstellen und vertreten die Überzeugung, jegliche Forschung an menschlichen Embryonen mit CRISPR-Cas9 solle unterbunden werden. Andere meinen jedoch, ein vollständiges Moratorium wäre nicht nur schwer durchzusetzen, sondern würde auch den Fortschritt der Forschung behindern. Trotz dieser Differenzen haben Wissenschaftler weltweit Dialog und Transparenz offensichtlich als wegweisend akzeptiert, was sich an den vielen international abgehaltenen Konferenzen und Tagungen zum Thema zeigt.
Zwischenzeitlich wird die Entwicklung von CRISPR-Cas9 rapide vorangetrieben. Die Pharmaindustrie investiert gegenwärtig in diese Technologie, um die Forschung zum Zweck der Medikamentenentwicklung zu verbessern, weshalb man sich mit technischen Fehlern des Verfahrens sowie deren Verbesserung befasst. Währenddessen spielt sich ein erbitterter Patentsreit unter den Entwicklern des Verfahrens ab (Doudna/Charpentier und Zhang). Ungeachtet dessen Ausgangs ist das erst der Anfang des kometenhaften Aufstiegs von CRISPR-Cas9.
References
- Cong L et al. (2013) Multiplex genome engineering using CRISPR/Cas systems. Science 339: 819–23. doi: 10.1126/science.123
- Cyranoski D, Reardon S (2015) Chinese scientists genetically modify human embryos. Nature 22 April, doi:10.1038/nature.2015.17378
Resources
- Lesen Sie mehr über mögliche Anwendungen von CRISPR zum Zweck des RNA-Editings.
- Lesen Sie mehr über den Patentstreit um CRISPR-Cas9.
- Erfahren Sie mehr darüber, wie man mit CRISPR-Cas9 Duchenne Muskeldystrophie behandeln kann.
- Lesen Sie, wie man mit CRISPR-Cas9 in Schweinen gezüchtete Organe für die Transplantation in den Menschen herstellen kann.
- Lesen Sie einen gut verständlichen Artikel über ethische Fragestellungen zum Genome Editing in Keimzellen.
- Ein Artikel mit Kommentaren von internationalen Gentechnik-Wissenschaftlern über ethische Fragestellungen bezüglich des Genome Editings in der Keimbahn. Siehe:
- Bosley K et al. (2015) CRISPR germline engineering – the community speaks. Nature Biotechnology 33: 478–86
- Lesen Sie mehr über Emmanuelle Charpentiers revolutionäre Genome Editing Methode, und hören Sie ihr zu, wie sie ihre Arbeit diskutiert.
Review
CRISPR-Cas9 ist eine sehr leistungsfähige, ‚GPS-ähnliche‘ Genome Editing Methode. Sie hat das Potenzial, ganz neue Möglichkeiten für Anwendungen in Wissenschaft, Medizin und Landwirtschaft zu eröffnen. Seine relativ einfache Handhabung sowie die niedrigen Kosten des Verfahrens werfen dringende ethische Fragen auf. Zwischen Wissenschaftlern kam es zu einem in der Öffentlichkeit viel Aufmerksamkeit erregenden Rechtsstreit über die begehrten Patentrechte.
Der Artikel beschreibt sehr klar, weshalb sich die repetitiven DNA-Sequenzen als grundlegender Mechanismus des bakteriellen Immunsystems für die Verwendung als programmierbares CRISPR-Cas9 Genome Editing Verfahren eignen. In Kombination mit den Abbildungen kann der Artikel sowohl zur Darstellung dieser molekularbiologischen Methode als auch zur Erklärung, warum CRISPR-Cas9 seine Vorläufer-Genome-Editing-Verfahren verdrängt hat, verwendet werden. Darüber hinaus kann er als Denkanstoß für ethische Diskussionen über gezielte Eingriffe in die Keimbahn sowie als Informationsquelle genutzt werden. Einige Vorschläge für Inhaltsfragen zum Artikel siehe unten:
- Wofür steht CRISPR?
- Wie funktioniert CRISPR-Cas9?
- Welche Krankheiten könnte man mit CRISPR-Cas9 behandeln?
- Welche möglichen Risiken birgt die Anwendung von CRISPR-Cas9?
- Welche ethischen Fragen wirft die Anwendung von CRISPR-Cas9 auf?
- Wer sollte den Nobelpreis für die Entdeckung von CRISPR-Cas9 erhalten?
Mary Brenan, Concord College, Großbritannien





