Van Goghs verdunkelndes Erbe Understand article
Übersetzt von Katharina Nöske. Die leuchtenden Gelbtöne auf van Goghs Bildern werden zu einem hässlichen Braun. Andrew Brown zeigt, wie hochentwickelte Röntgentechnik, zur Verfügung gestellt von der Europäischen Synchrotronstrahlenquelle in Grenoble, Frankreich, erklären kann warum.
Van Goghs (1853-1890) Auswahl an lebhaften und oft unrealistischen Farben, die Stimmung und Gefühl ausdrücken, war, zusammen mit seinem ausgedehnten Pinselstrich, ausschlaggebend für seinen einmaligen Stil, welcher starken Einfluss hatte auf die Entwicklung der modernen Malerei. Die neue Generation von Pigmenten im 19. Jahrhundert ermöglichte es van Gogh beispielsweise das satte Gelb seiner gefeierten Sonnenblumen zu kreieren. Diese bemerkenswerten Farbtöne, die er in vielen seiner Arbeiten verwendete, enthielten eines der neuen Pigmente, genannt Chromgelb.Unglücklicherweise hat sich das Chromgelb, mehr als 100 Jahre, nachdem es van Goghs Pinsel verließ, an manchen Stellen zu einem wenig ansehnlichen Braun verdunkelt, ein Phänomen, das kürzlich die Aufmerksamkeit einer Gruppe von Wissenschaftlern erregte.

Mit freundlicher Genehmigung von the Van Gogh Museum, Amsterdam

Mit freundlicher Genehmigung von Van Gogh Museum, Amsterdam

Mit freundlicher Genehmigung von Acacia217; Bildquelle: Wikimedia Commons

Mit freundlicher Genehmigung von Van Gogh Museum, Amsterdam
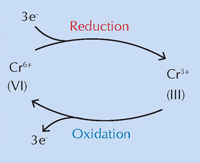
Ein internationales Team unter der Leitung von Koen Janssens von der Universität Antwerpen glaubt, dass chemische Veränderungen des Chromgelb (PbCrO4 · xPbO), verursacht durch ultraviolette (UV) Strahlung, für die Farbveränderung verantwortlich sind (Monico et al., 2011). Die Verdunkelung des Pigments im Sonnenlicht ist seit seiner Erfindung bekannt. Studien der 1950er zeigten, dass sie bedingt ist durch die Reduktion von Chrom von Cr(VI) zu Cr(III) (siehe Abbildung 1, unten). Bis heute war der genaue Mechanismus jedoch unbekannt und die Abbauprodukte waren nicht charakterisiert.
Mit freundlicher Genehmigung von Nicola Graf
Historische Farbtuben
Um diese Unbekannten zu untersuchen, begann Janssens’ Team damit, Proben von Farbtuben zu sammeln, die einem Zeitgenossen van Goghs gehört hatten, dem flämischen Maler Rik Wouters (1882-1913). Einige Tuben enthielten ungemischte Chromgelbfarbe, andere enthielten Farben von hellerem Gelb, hergestellt durch das Vermischen von Chromgelb mit einer weißen Substanz. Die Wissenschaftler ließen die Proben künstliche unter UV-Licht altern und erwarteten eine Farbveränderung nach mehreren Monaten. Zu ihrer Überraschung hatte sich bereits nach drei Wochen eine dünne Schicht an der Oberfläche der helleren gelben Farbe erheblich zu einem Schokoladenbraun verdunkelt. Die ungemischten Proben veränderten sich entweder vergleichsweise wenig oder gar nicht. „Wir waren verblüfft“, sagt Janssens.

Nachdem das Team die Probe identifiziert hatte, die am wahrscheinlichsten die fatalen chemischen Reaktionen durchläuft, führten sie anspruchsvolle Analysen auf der Basis von Röntgenstrahlen durch. Ein Großteil der Arbeit wurde an der Synchrotronstrahlenquelle (European Synchrotron Radiation Facility ESRF)w1 in Grenoble, Frankreich, durchgeführt, wo zwei Methoden, XRF und XANES, benutzt wurden um mit extremer Empfindlichkeit die räumliche Verteilung und den Oxidationszustand der einzelnen Elemente in den Farbproben aufzuspüren (siehee Box).
Analysen haben gezeigt, dass die Verdunkelung der dünnen Oberflächenschicht mit der Reduktion von Chrom von Cr(VI) zu Cr(III) im Chromgelb zusammenhängt; das passt zu den Beobachtungen, die zu Industriefarben auf der Basis von Bleichromat gemacht wurden. Darüber hinaus wurde das Cr(III)-haltige Abbauprodukt zum ersten Mal als Cr2O3 · 2H2O identifiziert, besser bekannt als das Pigment Viridiangrün. Aber wie kann die Anwesenheit eines grünes Pigments die braune Verfärbung erklären, die in den Versuchen der Forscher beobachtet wurde? Die Wissenschaftler vermuten, dass das reduzierte Chrom im Viridiangrün während der Oxidation von Ölkomponenten der Farbe entsteht. Diese oxidierte Form des Öls könnte, zusammen mit der Mischung aus Grün und den verbleibenden gelben Pigmenten, die Ursache für die braune Färbung sein.
Mithilfe der Strahlenmethode konnten die Wissenschaftler ebenfalls zeigen, dass die gemischte, hellere Farbe Schwefelverbindungen enthielt. Sie folgerten, dass diese Verbindungen irgendwie in der Reduktion des Chroms involviert waren, was erklären würde, warum es relativ wenig Verfärbungen in den ungemischten Farbproben gab.
Röntgenscheinwerfer auf van Gogh

Vordergrund. Zum
Vergrößern auf das Bild
klicken
Mit freundlicher Genehmigung
von the Van Gogh Museum,
Amsterdam
Nachdem sie die Chemie der Reaktion in isolierten Farbproben aufgedeckt hatten, wollten die Forscher herausfinden, ob die Verdunkelung auf der oberflächlichen Gelbschicht auf zwei von van Goghs Gemälden, Blick auf Arles mit Iris im Vordergrund (1888) und Seineufer (1887), dem gleichen Phänomen zugeschrieben werden konnte.
Mithilfe von Röntgenfluoreszenzanalyse (englisch X-ray fluorescence spectroscopy, XRF spectroscopy) wurde die Chemie der Region erfasst, die die Grenze zwischen der dunklen Oberfläche und der darunterliegenden unveränderten gelben Schicht umgibt. Röntgen-Nahkanten-Absorptions-Spektren (englisch X-ray absorption near-edge structure spectroscopy, kurz XANES-Spektrokopie) wurden an bestimmten Punkten in dieser Region gesammelt. Die Ergebnisse bestätigten die der vorhergehenden Experimente: die reduzierte Form des Chroms, Cr(III), wurde in der dunkleren Oberflächenschicht gefunden, was nahelegt, dass sie für die braune Färbung verantwortlich ist. Des Weiteren war das Cr(III) nicht gleichmäßig verteilt, sondern kam an Stellen vor, die auch Sulfat- und Bariumverbindungen aufwiesen.
Chemisch gesehen ähnelten diese Regionen den hellgelben Farbproben der früheren Experimente, was die Vermutung der Forscher stützt, dass Schwefelverbindungen an der Reduktion von Chrom beteiligt sind (siehe Gleichung unten). Wegen seiner weißen Farbe mischte van Gogh Pulver, das solche Verbindungen enthielt, mit Chromgelb, um die helleren Farbtöne zu erzeugen, die so unerlässlich waren für die Erschaffung der hell erleuchteten Szenen, die charakteristisch für eine bestimmte Phase seines Lebens waren.
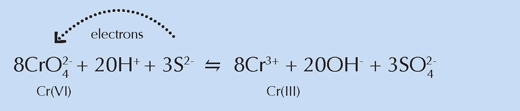
Mit freundlicher Genehmigung von Nicola Graf
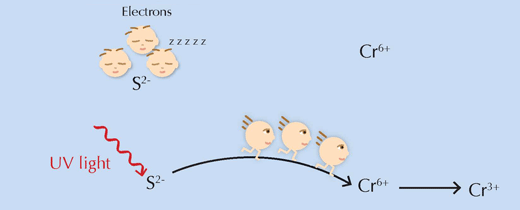
Eine wichtige Frage blieb offen: wie funktioniert der vermutete Auslöser für die Reaktion, UV-Licht? Vereinfacht gesagt, versorgt es die Reaktionspartner mit der Energie, die sie brauchen, um die Grenze der Aktivierungsenergie zu überschreiten, sodass die Reaktion fortlaufen kann (siehe Abbildung 6, unten).
Mit freundlicher Genehmigung von Nicola Graf
Was kann man tun?
Janssens’ Team hat die Chemie untersucht, die für die Verfärbung von van Goghs Gemälden verantwortlich ist. Aber können wir dieses Wissen nutzen, um die Arbeit des Künstlers zu retten? Ella Hendriks vom Van Gogh Museumw3 in Amsterdam, Niederlande, hat ihre Zweifel: „Ultraviolettes Licht…wird in modernen Museen bereits herausgefiltert. Wir stellen die Gemälde in einer kontrollierten Umgebung aus, um sie im bestmöglichen Zustand zu erhalten.“ Ein Teil dieser kontrollierten Umgebung ist die niedrige Temperatur im Museum. Allgemein gilt, dass ein Temperaturanstieg von 10°C die Reaktionsrate um einen Faktor von 2-4 erhöht, und die Reduktion von Chrom macht da keine Ausnahme.
Wenn also sowohl das UV-Level als auch die Temperatur bereits kontrolliert werden, was kann man dann noch für die van Gogh-Bilder tun? Es gibt eine radikalere Alternative: Anstatt den Degradationsprozess zu verlangsamen, ihn ganz umzukehren. „Unsere nächsten Experimente sind schon in Vorbereitung“, sagt Janssens. „Wir wollen natürlich herausfinden, welche Bedingungen die Reduktion von Chrom begünstigen und ob es Hoffnung gibt, die Pigmente in ihren ursprünglichen Zustand auf den Bildern zurückzuversetzen.“w4
Auch wenn es die beste Lösung wäre, die Zeit auf diese Weise zurückzudrehen, gibt Janssens zu, dass die Aussicht, die Pigmente wieder zu ihrer ursprünglichen Farbe zurückzubringen, momentan eher unwahrscheinlich ist. Nichtsdestotrotz versichert uns die Arbeit der Wissenschaftler, dass wir alles in unserer Macht stehende tun, um van Goghs Gemälde zu erhalten in der Hoffnung, dass zukünftige Generationen sich an dem erfreuen können, was dieser großartige Künstler erschaffen hat.
Kunststudien mit dem Synchrotron
Die chemische Charakterisierung wertvoller Kunstwerke kann problematisch sein. Man kann nur sehr wenige kleine Proben für die Analyse nehmen, und diese bestehen oft aus einer Mixtur komplexer Verbindungen in heterogenem Zustand der Materie. Um diese Schwierigkeiten zu überwinden, verwenden Wissenschaftler Methoden auf Basis von Röntgenstrahlen. Je stärker und präziser die Röntgenstrahlen sind, umso besser ist die Qualität der Analyse. Die potentesten Röntgenstrahlen werden von einer Synchrotronstrahlenquelle produziertw2 (siehe Abbildung 2, unten). In dieser Studie wurden zwei spektroskopische Methoden auf den Farbproben angewandt: XRF und XANES.
Mit freundlicher Genehmigung von EPSIM 3D / JF Santarelli, Synchrotron Soleil; Bildquelle: Wikimedia Commons
XANES
XANES Spektroskopie beruht auf der Physik der Röntgenstrahlungsabsorption. Atome eines bestimmten Elements absorbieren Röntgenstrahlung auf charakteristische Weise. Daher kann man durch den Blick auf ein Röntgenabsorptionsspektrum, welches die Röntgenstrahlungsabsorption (Y-Achse) gegen den Energieumfang der Strahlung (X-Achse) darstellt, die einzelnen Elemente einer Probe identifizieren. Hochauflösende Röntgenstrahlungsabsorptionsspektren werden typischerweise in bestimmten Energieregionen (genannt XANES) gesammelt, die nahe einer Absorptionskante eines Elements von Interesse liegen (siehe Abbildung 3, unten und 4). Solche detaillierten Spektren können zeigen, in welchem Oxidationszustand sich das entsprechende Element befindet. Diese Information war von großem Interesse für die Forscher.
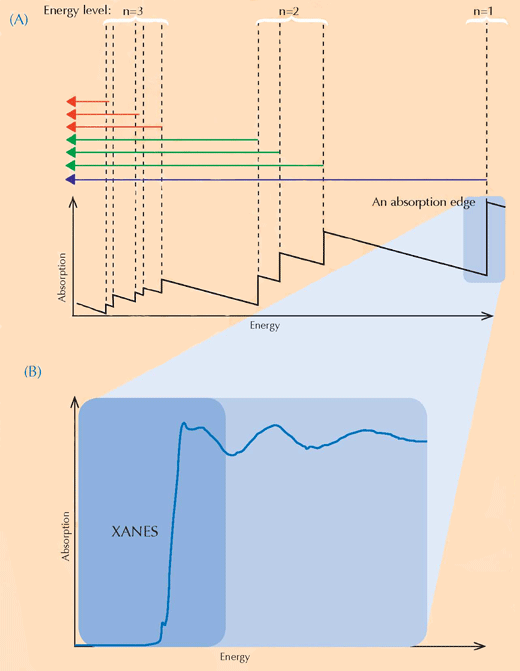
Mit freundlicher Genehmigung von Atenderhold; Bildquelle: Wikimedia Commons (B) Eine Absorptionskante im Detail. Wenn wir an eine scheinbar glatte Absorptionskante heranzoomen, entdecken wir, dass sie verziert ist mit einer Anzahl kleinerer Eindellungen, die kleineren Absorptionen entsprechen. Die Region an der vorderen Kante (in Blau eingefärbt) der Absorptionskante bezeichnet man als die Röntgen-Nahkanten-Absorptions-Struktur (XANES für englisch X-ray Absorption Near-Edge Structure) und sie entspricht den Elektronen, die zu unbesetzten Energielevels in der Nähe übergehen. Die Forscher, die die van Gogh Gemälde untersuchten, nutzten die XANES-Region, weil sie Aufschluss geben kann über den Oxidationszustand der Atome in einer Probe: Atome mit unterschiedlichem Oxidationszustand besitzen unterschiedlich viele Elektronen (siehe Abbildung 1, oben). Dies ändert den Wert ihres Energiezustandes und dadurch auch ihr XANES-Spektrum
Mit freundlicher Genehmigung von M Blank: Bildquelle; Wikimedia Commons
Mit freundlicher Genehmigung von Nicola Graf
XRF
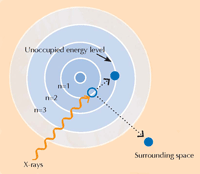
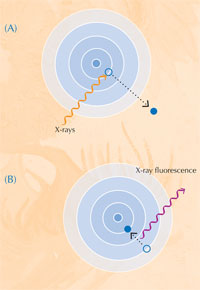
Atome treten in einen angeregten, unstabilen Zustand, wenn sie Röntgenstrahlung absorbieren. Wenn sie dann in eine stabileren Zustand zurückkehren, geben sie sekundäre Röntgenstrahlen ab, ein Prozess, den man Röntgenfluoreszenz nennt (siehe Abbildung 5). Das Muster der Röntgenfluoreszenz (XRF für englisch X-ray fluorescence), das eine bestimmte Probe erzeugt, genannt XRF-Spektrum, kann man nutzen, um die Verteilung von Elementen in einer bestimmten Region zu bestimmen. Im Gegensatz dazu kann XANES nur an einem ausgewählten Punkt auf der Probe genutzt werden. Durch die Kombination von XRF und XANES waren die Wissenschaftler in der Lage, detaillierte Bilder der chemischen Zusammensetzung der Farbproben zu erstellen.
Mit freundlicher Genehmigung von Nicola Graf
Wissenschaft in der Kunst
Was denken Sie und Ihre Schüler? Sollte die Wissenschaft dazu genutzt werden, die Degeneration wichtiger Kunstwerke aufzuhalten oder sie gar wieder in ihren Originalzustand zu versetzen?
References
- Monico L et al. (2011) Degradation process of lead chromate in paintings by Vincent van Gogh studied by means of synchrotron X-ray spectromicroscopy and related methods. 2. Original paint layer samples. Analytical Chemistry 83: 1224-1231. doi: 10.1021/ac1025122
Web References
- w1 – Die European Synchrotron Radiation Facility (ESRF) ist eine internationale Forschungseinrichtung für wegbereitende Forschung mit Photonen. ESRF ist Mitglied des EIROforum, dem Herausgeber von Science in School. Um mehr zu erfahren, besuchen Sie: www.esrf.eu
- w2 – Für mehr Details über Synchrotronstrahlung in der Forschung siehe:
- Capellas M, Cornuéjols D (2006) Shipwreck: science to the rescue! Science in School 1: 26-29.
- Capellas M (2007) Recovering Pompeii. Science in School 6: 14-19.
- w3 – Um mehr über Vincent van Gogh und seine Kunst zu erfahren, besuchen Sie die exzellente Webseite des Van Gogh Museums: www.vangoghmuseum.nl
- Ein Teil der Webseite enthält auch Quellen für den Unterricht an Grund- und weiterführenden Schulen: www.vangoghmuseum.nl/vgm/index.jsp?page=110&lang=en
- w4 – Für ein Interview mit Koen Janssens über seine Forschung an den van Gogh Gemälden, ausgestrahlt auf BBC Radio 4, siehe: www.bbc.co.uk/programmes/b00yjs49
- w5 – CLEAPSS ist ein britischer Beratungsservice, der Unterstützung im wissenschaftlichen und technologischen Unterricht bietet, für die Themen Gesundheit und Sicherheit; Risikoeinschätzung; Quelle und Nutzung von Chemikalien; und lebende Organismen und Ausrüstung. Für mehr Information, siehe: www.cleapss.org.uk
- Sicherheitsvorgaben für die Benutzung von Blei, Chrom und deren Verbindungen entnehmen Sie den Schülersicherheitsdatenblättern, die Sie hier kostenlos herunterladen können: http://www.cleapss.org.uk/free-publications/general-publications
Resources
- Bilder und eine Animation der Untersuchung der historischen Farbtuben finden Sie unter: www.vangogh.ua.ac.be
- Um mehr über die Wissenschaft der Erhaltung von Kunst zu erfahren, siehe:
- Leigh V (2009) The science of preserving art. Science in School 12: 70-75.
Institutions
Review
Dieser Artikel verbindet sehr schön Wissenschaft mit Kunst und Erhaltungsstudien. Die fortschrittlichen Methoden, die die Forscher benutzen, bringen chemische Veränderungen der Pigmente ans Licht, die viele Dekaden nach der Vollendung von van Goghs Gemälden auftreten.
Der Artikel zeigt Schülern auf sinnvolle Weise, dass es immer eine wissenschaftliche Erklärung dafür gibt, warum sich Artefakte mit der Zeit verändern. Er kann bestens als Lehrmittel in Chemie für Schüler im Alter von 16 bis 18 Jahren genutzt werden. Der Artikel kann auch benutzt werden, um einzelne chemische Themen wie Oxidation und Reduktion zu lehren.
Um das Verständnis der Schüler für die Chemie hinter der Forschung zu fördern, könnte man die folgenden Fragen stellen:
- Die in dem Artikel beschriebene Arbeit der Wissenschaftler zeigt, dass Sulfidionen die chemische Spezies sein können, die für die Reduktion von Chrom verantwortlich sind. Schreibe verschiedene Gleichungen für die Reduktion von Bleichromat (PbCrO4) durch die Sulfidionen-haltigen Verbindungen H2S und PbS auf. Hinweis: Cr(VI)-Verbindungen sind oxidierende Stoffe.
- Die Wissenschaftler vermuten, dass sulfathaltige Verbindungen in van Goghs Farbe eine Quelle für Sulfidionen sein können. Überlege, auf welche andere Art Gemälde Sulfidionen ausgesetzt sein können.
- Silberschmuck wird mit der Zeit dunkler, wenn er Luft ausgesetzt ist. Schreibe die Reaktion auf, die dafür Verantwortlich ist. Beachte, dass es sich nicht um eine einfache Ersetzungsreaktion handelt.
Um zu zeigen, dass sich Bleichromat verdunkelt, wenn es in Kontakt mit Sulfidionen kommt, können Sie folgendes Experiment im Unterricht zeigen:
- Synthetisieren Sie Bleichromat im Becherglas, indem Sie ein wasserlösliches Bleisalz, zum Beispiel Blei-(II)-azetat, Pb(CH3COO)2, oder Blei-(II)-nitrat, Pb(NO3)2, zu einem gleichen Volumen Kaliumchromatlösung, K2CrO4 geben. Verdünnte Lösungen (~ 0,03 M) sind ausreichend.
- Gelbes Bleichromat wird sofort ausfallen. Filtern Sie die restliche Flüssigkeit mit einem Trichter und Filterpapier. Trocken Sie die Ausfällung vorsichtig mit einem Fön unter einem Abzug, ohne es jedoch ganz zu trocknen.
- Bereiten Sie eine verdünnte wässrige Lösung von Hydrogensulfat (H2S) vor, indem Sie 50 mg Natriumsulfid (Na2S) in 90 mL Wasser lösen. Geben Sie die Lösung zu 10 mL Salzsäure (HCl, 0,1 M). Rühren Sie die Mischung.
- Füllen Sie einen Gummiballon mit Luft und verbinden Sie ihn mit einer kleinen gläsernen Drechselflasche, in der sich ein paar Milliliter der Hydrogensulfatlösung befinden (siehe Abbildung unten). Richten Sie den austretenden Strom von Hydrogensulfat-haltiger Luft auf das ausgefallene Bleichromat.
- Die Ausfällung wird sich sofort braun verfärben. Sie haben den Verdunkelungsprozess auf van Goghs Gemälden simuliert und um ein vielfaches beschleunigt.
Sicherheitshinweis: Alle löslichen Bleisalze sind giftig, und lösliche Chromate sind giftig (über 0,003 M) und vermutlich karzinogen. Kaliumchromat kann bei Kontakt mit der Haut Sensibilisierung und / oder Geschwüre hervorrufen. Es gibt Hinweise, dass Bleichromat karzinogen ist. Es kann auch Schäden an ungeborenen Kindern verursachen und sollte deshalb nicht verwendet werden, wenn die Lehrerin oder eine der Schülerinnen schwanger ist oder sein könnte. Hydrogensulfat ist ein toxisches Gas mit sehr unangenehmem Geruch.
Führen Sie die oben beschriebenen Versuche unter einem Abzug durch und tragen Sie Schutzbrille und Handschuhe. Entsorgen Sie alle Chemikalien entsprechend den örtlichen Sicherheitsvorgaben. Siehe auch die Science in School allgemeinen Sicherheitshinweise. Sie könnten auch die CLEAPSS Schülersicherheitsdatenblätter für Chrom und Blei hilfreich findenw5.
Vladimir Petruševski, Mazedonien






