Recuperare Pompei Understand article
Traduzione di Lucilla Croce Ferri. I vostri studenti hanno difficoltà a vedere le applicazioni delle materie scientifiche ad altri soggetti? Montserrat Capellas dell’European Synchrotron Radiation Facility a Grenoble, in Francia, spiega come moderne tecniche di analisi chimica stanno facendo…

(1827-1833) di Karl Pavlovich
Briullov
Immagine di pubblico dominio;
fonte dell’immagine: Wikimedia
Commons
Gli artisti dell’antica Pompei in Italia dipinsero 2000 anni fa la città di rosso con un brillante pigmento carminio che dominava molti dei dipinti murali della città andati perduti. Il 24 agosto 74 d.C. il vulcano Vesuvio eruttò sotterrando le città vicine sotto pomice e cenere. Però, invece di distruggere Pompei, ciò preservò la città e i suoi abitanti sotto terra. Inclusa nella lista del Patrimonio Mondiale UNESCO nel 1997, l’antica città di Pompei è ora il sito archeologico più visitato in Europa.
Villa Sora nella vicina città di Torre del Greco rimase sepolta fino a 20 anni fa, quando lavori di scavo portarono alla luce l’edificio. Dalla scoperta del resto della casa, il colore rosso caratteristico degli affreschi murali è diventato nero in molti posti con un rapido processo di degradazione non ancora scientificamente compreso del tutto. L’origine del colore rosso a Torre del Greco e a Pompei è il sulfide di mercurio (HgS), normalmente chiamato cinabro. Si tratta di un pigmento rosso cupo molto usato per coprire lo sfondo dei dipinti, dando uno sfondo rosso uniforme ai disegni. Tuttavia, in alcune circostanze, può diventare instabile, trasformandosi in monotone ombre grigio-nere.

Gli scienziati si sono chiesti da molti anni pechè le pareti rosse di Pompei annerivano. Attorno al primo secolo a.C., Vitruvio menzionò il problema nel suo trattato De Architectura e diede la ricetta per una sorta di vernice protettiva basata sulla cera punica (un sapone fatto di cera di api e calce spenta): “Chi desidera che il cinabro conservi il colore originario, dovrà applicare con un pennello, dopo che la parete sarà stata dipinta e sarà asciutta, della cera punica liquefatta e stemperata con dell’olio: poi, usando carboni messi dentro un recipiente di ferro, la parete dovrà essere riscaldata in modo tale che la cera trasudi e si distribuisca sulla superficie, infine dovrà essere strofinata con una candela e con panno pulito, come si fa con le statue di marmo. Lo strato di cera punica previene l’effetto sia dei raggi lunari che di quelli solari che rovinano e distruggono i colori nelle opere di questa natura.”
Nonostante la cera punica, le antiche pareti pompeiane negli ultimi anni hanno perso i loro colori. La spiegazione più comune è che l’esposizione al Sole trasformi il cinabro in un’altra fase (in cui gli stessi atomi, mercurio e zolfo si sistemano diversamente) , il metacinabro, che è nero. Tuttavia le cause e i meccanismi sono rimasti un mistero e i restauratori hanno perso la corsa contro il tempo per prevenire il degradazione, per ora.
Nuovi risultati

Pompei di un artista pompeiano
datato attorno al 40 a.C.
Immagine di pubblico dominio;
fonte dell’immagine:
Wikimedia Commons
Un gruppo italo-francese di ricercatori ha studiato quattro campioni di pareti affrescate di Villa Sora usando l’ European Synchrotron Radiation Facility (ESRF) di Grenoble, Francia, per monitorare i processi chimici che hanno luogo nelle pareti. I campioni di dipinti su parete sono stati presi sia da aree alterate sia da aree intatte e sottomessi a microanalisi per chiarire questo drammatico annerimento.
Il gruppo ha identificato gli elementi presenti sia nei campioni ben preservati (rossi) sia in quelli alterati (grigio-neri). Oltre allo zolfo e al mercurio del pigmento e al calcio presente come calcite nella malta, hanno rivelato bassi livelli di altri elementi, tra cui l’alluminio, il silicio e il potassio. Tuttavia l’elemento trovato più interessanti è stato il cloro, che potrebbe spiegare il misterioso processo di annerimento.
Mappando segnali di micro fluorescence da raggi X (vedi riquadro) con superfici rosse, grigie o nere, gli scienziati sono stati capaci di correlare direttamente la distribuzione degli elementi con l’aspetto visibile dei dipinti. Questa tecnica è spesso usata coi dipinti, ma normalmente impiega la microscopia elettronica invece dell’analisi sincrotronica, più sensibile. La mappa degli elementi mediante una sorgente a sincrotrone di uno dei campioni ha mostrato che la distribuzione del cloro combacia perfettamente con una macchia grigia rovinata.
Il cloro è stato trovato essere associato con il sodio e il mercurio, mostrando che il cloro ha reagito con il pigmento e che il sale comune (NaCl) è coinvolto nel processo di degradazione.
Si sa che il cloro scurisce il cinabro in presenzadi luce. Gli scienziati supponevano che il cloro nei dipinti potesse aver origine da due sorgenti di sale. Per prima cosa, siccome Pompei e Torre del Greco sono al mare, avrebbe potuto essere che i dipinti avessero assorbito il sale dall’aria. Ironicamente, la seconda sorgente di sale potrebbe essere la cera punica “protettiva”, che secondo Plinio il Vecchio veniva prodotta usando l’acqua di mare.
Cosa significa tutto ciò?
Per ora, le scoperte dell’ESRF avevano confermato la spiegazione tradizionale: che il cinabro rosso fu trasformato nel nero metacinabro. L’analisi di un’altra parte del dipinto, più scura, rivelò tuttavia un’alta concentrazione di zolfo in aree dove il cloro non era presente. Fu analizzata la speciazione o l’ambiente chimico dello zolfo per scoprire quali fossero gli atomi circostanti. Ciò era importante perchè nonostante il cinabro e il metacinabro hanno la stessa composizione (Hg e S), possono differenziarsi per la diversa sistemazione atomica. Questa analisi rigettò l’ipotesi che il cinabro si fosse trasformato in metacinabro: il metacinabro non fu rilevato.

Riprodotta con il permesso di Cotte et al., 2006. Copyright 2007 American Chemical Society

Riprodotta con il permesso di Cotte et al., 2006. Copyright 2007 American Chemical Society
Inaspettatamente gli scienziati provarono un altro composto: il solfato di calcio, conosciuto anche come gesso. Questo era il composto solforoso trovato nelle regioni nere dove non c’era cloro. Così, al posto di una semplice transizione di fase, lo zolfo aveva subito una vera ossidazione, trasformandosi da un sulfide ridotto (S(-II)) in un solfato ossidato (S(+VI)). Molto probabilmente il gesso (CaSO4.2H2O) risultò dalla reazione del biossido di zolfo (SO2) nell’aria con la calcite (CaCO3) nella malta:
SO2(g) + CaCO3(s) + 2H20(g) + ½ O2 → CaSO4.2H20(s) + CO2
Questa spiegazione è sostenuta dal fatto che il cloro può catalizzare la reazione
HgS → Hg + S
in cui il cinabro si dissocia nel mercurio e nello zolfo in presenza di luce, fornendo una sorgente di zolfo per successive reazioni con l’ossigeno dell’aria e la successiva formazione di SO2. Così, benchè la seconda macchia più scura contenesse zolfo senza cloro, il cloro nelle altre aree (tipo la prima macchia grigia) fu sufficiente per generare biossido di zolfo che generò il pigmento nelle altre aree.
Così l’analisi al sincrotrone metteva in dubbio la teoria tradizionale che il pigmento di cinabro rosso degradi direttamente in metacinabro in presenza di luce e sosteneva la teoria più recente che il cinabro si dissoci in presenza di cloro per produrre zolfo, che poi (in forma di biossido di zolfo) reagisca con la calcite nella malta per formare solfato di calcio. Questa reazione è favorita dalla presenza di HgS nel pigmento, il che spiega perchè aree che non furono dipinte con il pigmento di rosso cinabro non si scolorirono.
Studi di sezioni
Gli scienziati analizzarono la sezione di uno dei campioni per mappare la profonidtà di alterazione del dipinto. Un campione fu immerso nella resina e levigato perpendicolarmente allo strato dipinto. In questo modo, tutti gli strati del dipinto, dalla malta alla superficie, furono accessibili. Gli scienziati capirono che lo strato degradato contenente le specie di zolfo ossidato e i solfati, era profondo solo 5 µ e che sotto la superficie il cinabro era rimasto intatto.
Questi dipinti antichi erano affreschi in cui il colore era applicato sull’intonaco bagnato, permettendo al pigmento di penetrare e di creare uno strato di pigmento di circa 100 µ. Lo studio delle sezioni quindi fornisce due tipi di informazione. Per prima cosa fu possibile distinguere quegli elementi presenti nei dipindi originali (calcio, mercurio e zolfo) e quelli provenienti dall’ambiente (potassio, silicio, alluminio, cloro e gesso). Ciò era importante, in quanto lo stesso gesso a volte era usato nella malta; siccome fu rilevato solo negli strati superficiali, chiaramente per questi dipinti esso non fu usato nella malta. Inoltre, le sezioni mostravano che la degradazione del colore era limitata ad uno strato molto superficiale, lasciando sperare che i dipinti possano essere riportati al loro pieno splendore.
“La ricerca portata aventi all’ESRF ha un’importanza straordinaria non solo per la conservazione delle pareti dipinte di Villa Sora, ma in generale per la preservazione dei dipindi murali romani scoperti nei più importanti siti archeologici romani (tipo Pompei ed Ercolano)”, spiega Corrado Gratziu, un membro del gruppo di ricerca e professore emerito in geologia all’Università di Pisa, Italia, specializzato in pietrologia delle roccie sedimentarie.
Ricerche future
Nonostante abbia confutato la classica spiegazione dell’annerimento del cinabro, la ricerca sull’ antico pigmento rosso è lungi dall’essere esaurita. Il processo complesso che coinvolge la reazione sia del cloro che del biossido di zolfo ha aperto nuove questioni. “La distribuzione chimica dei composti non è uniforme, il che significa che le condizioni atmosferiche probabilmente hanno un ruolo importante in questo cambio di colori, “ spiega Marine Cotte, una delle ricercatrici. “Il Sole influenza sicuramente questo processo, ma probabilmente anche la pioggia”, aggiunge. “La luce solare accelera alcune reazioni, mentra la pioggia lava i dipinti e dissolve i composti più solubili”. Anche la contaminazione atmosferica o le attività batteriche possono contribuire ai meccanismi di solfazione.
Il prossimo passo per il gruppo è esaminare più campioni, non solo di affreschi in siti archeologici ma anche campioni già estratti e esposti in musei. “ In questo modo abbiamo più dati e possiamo paragonare i risultati tra dipinti esposti a differenti condizioni atmosferiche e stabilire meglio le cause della loro degradazione, “ spiega Marine.
I raggi X come mezzo per studiare Pompei
Gli esperimenti svolti all’ESRF avevano bisogno di un fascio di raggi X molto piccolo (da 100 μm a meno di 1 μm) e intenso, per rilevare la bassa concentrazione di elementi e per fornire dettagliate informazioni chimiche. Furono condotti presso la beamline di microscopia a raggi X (ID21) combinando le tecniche di mappatura tramite micro fluorescenza a raggi X e micro spettroscopia di assorbimento di raggi X. La prima fu usata per rilevare la presenza di cloro e zolfo, la seconda per identificare la loro speciazione, cioè il modo in cui sono legati a altri atomi. Sotto sono riportate semplici spiegazioni di fluorescnza a raggi X e spettroscopia, che possono essere adatte a scolari più giovani.
Il principio della florescenza a raggi X
Un modo semplice di capire il principio della fluorescemza a raggi X è di considerare che gli atomi (i piccoli elementi che compongono la materia) sono come case, i cui abitanti sono chiamati elettroni. Questi abitanti sono piuttosto pigri e non vogliono vivere ai piani superiori. Così, prima vogliono occupare il pianterreno, poi il primo piano e così via. Come nella vita, ci sono case piccole (piccoli atomi con pochi elettroni) e case grandi (grandi atomi con tanti elettroni).
Il principio della fluorescenza a raggi X è mandare raggi X su questi atomi. La luce si comporterà come un ascensore della casa che trasferisce gli elettroni che vivono ai piani bassi ai piani pià alti della casa; questo processo è chiamato “assorbimento”, in quanto la luce è assorbita dall’atomo (l’elettrone è assorbito dall’ascensore). Quando questi elettroni spariscono, sarà disponibile del posto vuoto a questi livelli più bassi. Logicamente, gli elettroni che vivono più in alto sono piuttosto contenti di trasferirsi in basso. Durante questa transizione, esprimono la loro gioia emettendo della luce o fluorescenza. In una casa piccola, la transizione sarà piccola, così che le urla di gioia saranno piccole, mentre in una casa grande, alcune transizione e le corrispondenti esplosioni di gioia, possono esser grandi. Misurando il segnale di fluorescenza (l’energia di fluorescenza, che è la distanza tra il piano di partenza e il piano di arrivo) si possono distinguere tra piccoli e grandi atomi e, più precisamente, identificare ogni atomo in base alla sua esplosione di gioia.
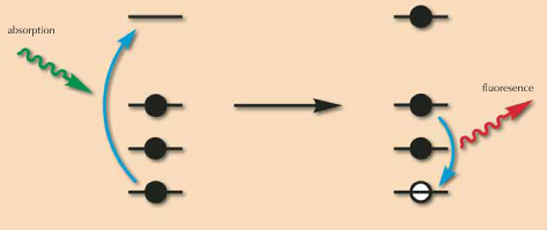
Immagine cortesemente messa a disposizione da Calvero; fonte dell’immagine: Wikimedia Commons
Principio della spettroscopia a raggi X
Questo metodo è basato sulla variazione dell’energia dei raggi X nella luce necessaria per eccitare gli atomi, che corrisponde all’altezza dell’ascensore. Immaginiamo che l’atomo sia illuminato con poca energia, cioè che la casa abbia un piccolo ascensore che va solo dal pianterreno al primo piano. Se entrambi questi piani sono pieni, nessun elettrone del pianterreno potrá prendere l’ascensore, poichè per lui al primo piano non c’è spazio. C’è quindi una condizione che deve essere soddisfatta prima che un elettrone possa prendere l’ascensore (o un atomo possa assorbire luce): l’altezza dell’ascensore deve essere sufficientemente grande da permettere la transizione dai piani inferiori a quelli vuoti più alti. Per esempio, un ascensore che va più in alto dell’altezza della casa porterà sempre ad un assorbimento.
C’è un caso critico in cui l’ascensore è appena sufficiente a portare gli elettroni in solaio e nell’attico. Infatti gli elettroni preferiscono andare in solaio piuttosto che essere buttati fuori di casa. Così la probabilità che un elettrone prenda l’ascensore per il solaio è più alta della probabilità che esca del tutto. Misurando l’assorbimento, misuriamo la probabilità che un elettrone prenda l’ascensore. Per ogni altezza dell’ascensore (energia del raggio X), viene misurato l’assorbimento. La ragione, per cui gli scienziati sono interessati ai trasferimenti degli elettroni in solaio (essendo stati eccitati al più alto livello energetico senza lasciare l’atomo) è che l’altezza del solaio ci dà informazioni sull’ambiente chimico dell’atomo.
In alter parole, consideriamo una casa isolata. Noi possiamo identificare questa casa usando la fluorescenza. Ora, supponiamo che la casa sia circondata da altre case (atomi). Saranno stati creati alcuni collegamenti, tipo ponti pedonali in cima alle case. Per ospitare il ponte pedonale con sicurezza la casa sarà stata leggermente modificata, cambiando un po’ il livello del solaio di ogni casa. Il risultato è che l’altezza del solaio dipende dalle case circostanti (quali case si trovano nelle vicinanze, quanto sono lontane e così via). Misurando l’altezza dell’ascensore per il solaio, possiamo dedurre la natura del ponte pedonale e di conseguenza l’ambiente chimico della casa (quali altri atomi la circondano, per esempio). Questo processo è chiamato speciazione atomica.
Resources
- Cotte M, Susini J, Metrich N, Moscato A, Gratziu C, Bertagnini A, Pagano M (2006) Blackening of Pompeian cinnabar paintings: X-ray microspectroscopy analysis. Analytical Chemistry 78: 7484-7492. doi:10.1021/ac0612224
Institutions
Review
L’articolo è adatto soprattutto per gli insegnanti che cercano nuove idee per mostrare ai loro studenti l’importanza della chimica e della fisica in campi differenti (per esempio, l’archeologia, la conservazione del patrimonio,…) e per gli studenti delle scuole secondarie affascinati dagli studi dell’antichità. In uno stile semplice arricchito da precise informazioni chimiche e che illustrano i compartamenti degli elettroni, il lettore può scoprire come i ricercatori moderni risolvono i misteri di materiali e tecnologie vecchi di circa 2000 anni.
Recuperare Pompei può esser usato in classe per affrontare diversi argomenti scientifici (chimica: la struttura atomica e molecolare, ossidoriduzioni, catalisi; fisica: la struttura atomica, la radiazione elettromagnetica; scienza della Terra: meteorologìa, vulcanismo), come attività introduttiva per aumentare l’interesse nelle applicazioni della ricerca scientifica. Può essere utilizzato come lettura di base prima di una visita ad un sito archeologico o ad un centro di ricerca come l’impianto a radiazione di sincrotrone. L’articolo è adatto anche come test di valutazione delle capacità degli studenti di comprensione linguistica e scientifica.
Per esempio si potrebbero formulare le seguenti domande:
1.I colori degli affreschi studiati erano:
- rosso, grigio e verde
- rosso, marrone e grigio
- rosso, grigio e nero
- rosso, nero e marrone
2.Quale dei seguenti composti non contiene zolfo?
- cinabro
- calcite
- metacinabro
- gesso
3.Scegli l’affermazione corretta circa lo studio degli affreschi per mezzo di raggi X:
- la fluorescenza a raggi X misura la luce di assorbimento e la spettroscopia a raggi X misura l’emissione
- la fluorescenza a raggi X misura la luce di emissione e la spettroscopia a raggi X misura l’assorbimento
- entrambe la fluorescenza a raggi X e la spettroscopia a raggi X misurano la luce di emissione
- entrambe la fluorescenza a raggi X e la spettroscopia a raggi X misurano la luce di assorbimento
Gli insegnanti potrebbero usare l’articolo per discutere;
- il ruolo della chimica e della fisica nei diversi campi (ricerca, industria, conservazione del patrimonio,…)
- l’importanza del lavoro di gruppo sia nella ricerca che in altre situazioni
- l’approccio interdisciplinare dell’archeologia moderna.
Inoltre questo materiale potrebbe essere molto utile per iniziare un progetto interdisciplinare che unisce le scienze naturali e quelle umanistiche per aiutare gli studenti a capire l’unità di base della cultura.
Giulia Realdon, Italia





