Beim Wachsen zuschauen: Die Entwicklung eines digitalen Embryos Understand article
Übersetzt von Julia Heymann. Was, wenn Sie Zeuge der Entwicklung neuen Lebens werden könnten? Wenn Sie in aller Ruhe jedes Detail und jede einzelne Zelle beobachten könnten, von jedem Blickwinkel aus, Augenblick für Augenblick? Sonia Furtado spricht mit Forschern, die genau das möglich…

Jochen Wittbrodt und Annette
Schmidt
Mit freundlicher Genehmigung
von EMBL Photolab
Stellen Sie sich vor, Google Earth™ würde regelmäßig immer wieder neue Satellitenfotos aufnehmen. Man könnte dann nicht nur den ganzen Planeten anschauen und Länder oder Städte heran zoomen, sondern auch die Fotosequenzen abspielen und sehen, was sich in zehn oder zwanzig Jahren verändert hat. Nimmt man statt der Erde einen Zebrafischembryo und sammelt ein paar hunderttausend Momentaufnahmen über einen Zeitraum von 24 Stunden, bekommt man das, was die Wissenschaftler des European Molecular Biology Laboratory (EMBL)w1 den „digitalen Embryo“ nennen.
Der Biophysiker Philipp Keller, die beiden Biologen Annette Schmidt und Jochen Wittbrodt; sowie der Physiker Ernst Stelzer haben zusammen eine Technik entwickelt, durch die man eine dreidimensionale Darstellung der ersten 24 Stunden in der Entwicklung eines Zebrafischembryos erhält (Keller et al., 2008). Alles begann Anfang 2006, als ein Forscherkollege Philipp vorschlug, einfach mal einen Embryo unters Mikroskop zu legen und alle Zellen einzeln nach zu verfolgen. Nach diesem Gespräch schaute sich Philipp die Lichtscheiben-Mikroskopie oder auch single-plane illumination microscopy (SPIM) genauer an (für alle kursiven Begriffe: siehe glossary), Dieses bildgebende Verfahren in 3D war zuvor in Ernsts Arbeitsgruppe entwickelt worden. Philipp verfeinerte die Grundlagen der SPIM, so dass die embryonale Entwicklung direkt aufgezeichnet werden konnte. Das Ergebnis war die so genannte digital scanned laser light sheet fluorescent microscopy (DSLM).
Da die Zellen eines sich entwickelnden Embryos sich ständig teilen und bewegen, müssen die Aufnahmen in sehr kurzen Zeitabständen gemacht werden, damit man Veränderungen beobachten kann. Man braucht ein Mikroskop, das eine hohe Aufnahmegeschwindigkeit und eine hohe Bildqualität kombiniert, damit man eng aneinander sitzende Zellen unterscheiden kann. Und natürlich müssen die Zellen am Leben erhalten werden und sich über einen Zeitraum von ein oder zwei Tagen normal verhalten, wenn man die Entwicklung des Embryos verfolgen will. Außerdem darf das Mikroskop dabei nicht den fluoreszierenden Farbstoff beschädigen, mit dem man die Zellen markiert.
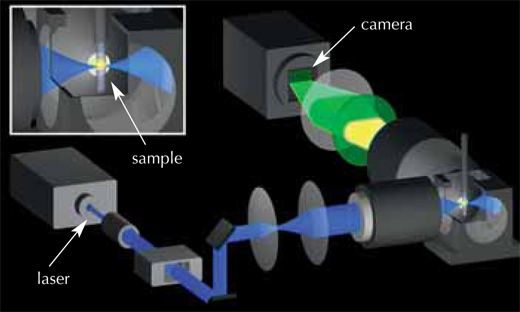
Mit freundlicher Genehmigung von Petra Riedinger
Die Lösung war die Verwendung eines sehr dünnen Laserstrahls, der den Schaden an Embryo und Farbstoff minimiert. Dieser strahlt durch den Embryo und regt den Fluoreszenzfarbstoff in den Zellen an, so dass er Licht ausstrahlt. Der Laserstrahl bewegt sich entlang einer vertikalen Linie und eine Kamera erfasst die von der Probe im 90°-Winkel zum Laserstrahl emittierte Fluoreszenz. Dadurch entsteht ein Bildschnitt von einem tausendstel Millimeter Dicke (siehe Film 1w2). Dann wird der Embryo um einen winzigen waagerechten Schritt weiter bewegt und der nächste Schnitt wird gescannt. Wenn der gesamte Embryo von einem Blickpunkt aus aufgenommen wurde, wird er um 180° gedreht und erneut gescannt, so dass später ein komplettes 3D-Bild erstellt werden kann. Der Embryo lebt und entwickelt sich dabei weiter, das heißt die Schnitte können regelmäßig am selben Embryo wiederholt werden und man kann die Veränderungen verfolgen. Die EMBL-Wissenschaftler „zerschnitten“ so ihre Zebrafischembryos entweder alle 60 oder alle 90 Sekunden, über einen Zeitraum von 24 Stunden und erhielten ungefähr 400 000 Bilder pro Embryo.
Die nächste Herausforderung bestand darin, einen Weg zu finden, die drei Terabyte an Daten pro Embryo zu analysieren. Die Forscher entschieden sich für einen automatisierten Ansatz: sie verwendeten Gruppen von Computern, die parallel arbeiteten, sowohl am EMBL in Heidelberg als auch am Karlsruher Institut für Technologiew3. “Jeder Computer bekommt eine Momentaufnahme des Embryos und dazu die Anweisung, in diesem Bild die Zellkerne zu finden“, erklärt Philipp. Jeder Zellkern bedeutet eine Zelle, und so können die Wissenschaftler durch Kombination der Informationen aus allen Schnitten ihren digitalen Embryo bauen. Eine optische Darstellung aller Zellen des Embryos, wo sie sich zu einem bestimmten Zeitpunkt befinden, wo sie sich als nächstes hin bewegen und wann und wo sie sich teilen. Das Ergebnis ist ein 3D-Zeitraffervideo des sich entwickelnden Embryos.
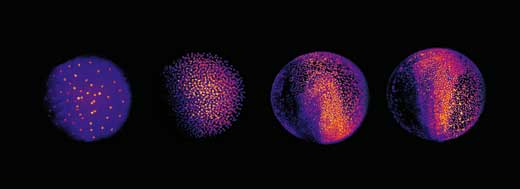
Mit freundlicher Genehmigung von EMBL Photolab
So erhielten Philipp, Annette und Jochen Aufschluss über verschiedene Stadien der Embryonalentwicklung der Zebrafische. Im ganz frühen Stadium besteht ein Zebrafischembryo zunächst aus einer Gruppe von Zellen, die oben auf dem Dottersack (der Nahrungsquelle des Embryos) sitzen. Erst teilen sich die Zellen in Form einer Welle, die sich von der Mitte aus in alle Richtungen bewegt, wie das Kräuseln von Wasser in einem Becken. Die Rekonstruktion ließ erkennen, dass sich das Muster der Zellteilung aber nach den ersten neun Zellzyklen verändert, zu einer Welle die sich in nur eine Richtung ausbreitet, sich dann teilt und außen an der Peripherie in zwei Halbkreisen weiter läuft (siehe Bild unten und Film 10w2). Die Grenze zwischen den beiden Halbkreisen wird später zur Körperachse des Tieres, die seine Symmetrie bestimmt. Also haben die Wissenschaftler herausgefunden, dass die Körperachse eines Zebrafischs zu einem früheren Zeitpunkt in seiner Entwicklung festegelegt wird, als bisher angenommen; zu einer Zeit in der maternale Gene (in Form von mRNA, die im Ei deponiert wurde) noch die alleinige Vorlage für die Proteinproduktion sind.
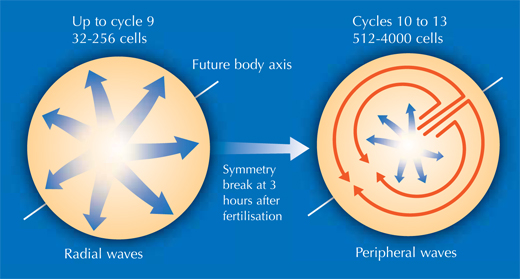
Zebrafischentwicklung: von schnellen radialen Wellen (Zyklen 1 bis 9) hin zu
langsamen, ringförmigen peripheren Wellen (Zyklen 10 bis 13)
Mit freundlicher Genehmigung von Nicola Graf
Die Forscher untersuchten auch die Gastrulation, den Prozess, durch den Zellen der ursprünglich einzigen äußeren Schicht des Embryos nach innen wandern, um die anderen beiden Schichten, oder Keimblätter, zu bilden. Aus diesen dreien entwickeln sich später unterschiedliche Gewebearten. „Lehrbücher brauchen zwei oder drei Seiten, um diesen Prozess zu beschreiben, doch wenn man sich die Filme des digitalen Embryos anschaut, ist es plötzlich ganz leicht zu verstehen,“ sagt Annette. Und nicht nur das – sie und ihre Kollegen entdeckten sogar, dass die Lehrbücher Unrecht haben.
Seit den achtziger Jahren hat es eine ständige, manchmal feurige Debatte im Fachgebiet darüber gegeben, wie Zellen wandern um diese Schichten zu bilden. Die allgemeine Lehrbuchmeinung besagte, dass die Zellen zu einer Öffnung im Embryo wandern und über deren Rand rollen, um darunter eine neue Schicht zu bilden (Involution) – ähnlich dem Rand einer Badekappe, der sich am Kopf entlang nach innen aufrollt. Andere Forscher behaupteten, dass einzelne Zellen der Außenschicht einfach dort untertauchen, wo sie sich gerade befinden (Ingression), und so eine neue Lage bilden.
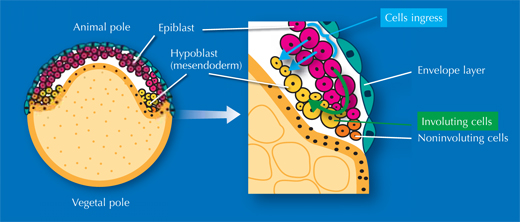
Zebrafischembryo kann dies durch Involution oder Ingression der Zellen
geschehen. Mit freundlicher Genehmigung von Nicola Graf
„Wir haben das Problem wirklich schön gelöst“, sagt Jochen. „Es stellte sich heraus, dass alle Recht hatten!“ Es ist eine Frage des Blickwinkels. Auf einer Seite des Embryos rollt sich die Zellschicht ein, während auf der anderen Seite die Zellen einwandern (Siehe Film 16w2). Die Forscher haben den digitalen Embryo auch als Vorlage verwendet um herauszufinden, woher die Zellen kommen, die zur Entwicklung eines bestimmten Organs oder Gewebes beitragen. Als erstes Beispiel diente das Auge. Zu einem fortgeschrittenen Stadium (z.B. gegen Ende des 24 Stunden-Videos) markierten sie in der digitalen Darstellung die Zellen, von denen sie wussten, dass sie bei der Bildung einer der Zebrafischaugen beteiligt sind. Dann verfolgten sie die Zellen in der Zeit zurück, um herauszufinden woher sie stammten (siehe Film 11w2).
Die Wissenschaftler stellten ihren digitalen Embryo öffentlich im Internet zur Verfügungw2, zusammen mit Hilfsprogrammen für andere Wissenschaftler, die damit ihre eigenen Mikroskopiedaten analysieren können. Und was kommt als nächstes? Mit Google Earth kann man jetzt nicht nur den ganzen Planeten anschauen und Orte heranzoomen, die Benutzer können auch ihre eigenen Notizen und Markierungen einfügen und die anderer sehen. Philipp, Annette, Jochen und Ernst stellen sich vor, dass ihr digitaler Embryo genauso zum so genannten „virtuellen Embryo“ werden soll: ein Hilfsmittel, mit dem andere Forscher Entwicklungsprozesse sehen können, wo sie für mehr Informationen heranzoomen und ihre eigenen Anmerkungen und Ergebnisse hinzufügen können. Auf lange Sicht möchten sie den Anwendungsbereich des digitalen Embryos auch auf andere Spezies ausweiten. Das soll Wissenschaftlern ermöglichen, auch quantitativ zu vergleichen, wie verschiedene Embryonen heranwachsen, womit sie wertvolle Einblicke in Entwicklungsprozesse erlangen würden. Der digitale Embryo hat noch viel Platz zum Wachsen und mit einer immer größeren Zahl an Leuten, die ihm dabei helfen wollen, hat er wohl ein viel versprechendes Leben vor sich.
Glossar
Digital scanned laser light sheet fluorescent microscopy (DSLM): Eine verbesserte Version der SPIM, bei der ein dünner Laserstrahl anstatt einer ganzen Lichtscheibe eingesetzt wird. Dadurch verringert sich der Schaden an Probe und Fluoreszenzfarbstoff.
Gastrulation: Die Phase in der frühen Embryonalentwicklung, während derer die drei Keimblätter Ektoderm, Endoderm und Mesoderm gebildet werden. Zeitliche Koordinierung und molekularer Mechanismus der Gastrulation unterscheiden sich zwischen verschiedenen Organismen
Genetic strain: Eine genetisch einheitliche Gruppe von Tieren, die in Laborexperimenten verwendet wird. Ein genetischer Stamm kann durch Kreuzung, Mutation oder Genmanipulation entwickelt werden.
Single-plane illumination microscopy (SPIM): Diese Methode ermöglicht die dreidimensionale Beobachtung von Prozessen in lebenden Organismen sogar in tieferen Gewebeschichten. Sie detektiert Fluoreszenzen in einem Winkel von 90° relativ zur Beleuchtungsachse mit einer Ebene aus Laserlicht, wodurch optische Schnitte möglich sind. Die Probe befindet sich nicht auf einem Objektträger sondern in einer flüssigkeitsgefüllten Kammer, die während der Beobachtung gedreht wird.
Der Zebrafisch als Modellorganismus
-Stadium, 2 Stunden und 45
Minuten nach der Befruchtung
Mit freundlicher Genehmigung
von Angharad Jones, Wellcome
Images
Die frühe (embryonale) Entwicklung kann man bei Menschen aus ethischen Gründen nicht ohne weiteres untersuchen. Praktischerweise gleicht sich der Prozess aber in allen Wirbeltieren, also werden andere Tiere als Modellorganismen verwendet, um unsere eigene Entwicklung zu verstehen. Aber warum gerade der Zebrafisch? Das verdanken wir George Streisinger, einem ungarischen Biologen der Universität Oregon, USA. Anfang der achtziger Jahre träumte dieser davon, die molekularen Methoden, die er zuvor zur Untersuchung von Viren angewandt hatte, bei der Erforschung der Genetik und Entwicklung von Wirbeltieren einzusetzen. Der Hobby-Aquarianer entschied sich an Zebrafischen zu arbeiten, von denen er wusste, dass sie leicht zu halten und zu züchten waren. Viele praktische Gründe machen Zebrafische zu einem attraktiven Modellsystem: sie sind zum Beispiel klein genug, um sie in den großen Mengen zu halten, die man für genetische Studien braucht – aber groß genug um klassische embryologische Manipulationen wie Transplantationen an ihnen durchzuführen.
Sie besitzen eine relativ kurze Generationszeit (3-4 Monate), produzieren große Mengen an Embryonen (100-200 pro Paarung) und bieten wegen externer Befruchtung leichten Zugang zu allen Entwicklungsstadien. Die Embryonen sind optisch transparent und entwickeln sich schnell, alle wichtigen Strukturen des erwachsenen Fisches sind schon nach drei Tagen vorhanden. Dadurch kann man ihre Entwicklung leicht studieren – entweder mit einem einfachen Lichtmikroskop oder mit komplizierterer Technologie, wie in diesem Artikel beschrieben. Noch dazu wurde das Zebrafischgenom gerade sequenziert und es gibt verschiedene genetische Stämme, wodurch man nicht nur die Embryologie sondern auch die Genetik hinter der Entwicklungsbiologie untersuchen kann – die Erfüllung von Streisingers Traum.
References
- Keller PJ, Schmidt AD, Wittbrodt J, Stelzer EH (2008) Reconstruction of zebrafish early embryonic development by scanned light sheet microscopy. Science 322: 1065-9. doi: 10.1126/science.1162493
Web References
- w1 – Mehr über das EMBL, das European Molecular Biology Laboratory, unter: www.embl.org
- w2 – Die Internetseite des digitalen Embryo mit Videos von der Entwicklung des Zebrafischembryos, sowie Daten zum Download: www.digital-embryo.org
- Film 1 zeigt eine schematische Darstellung des DSLM-Prinzips.
- Die Filme 2 und 3 zeigen die Entwicklung eines Zebrafischembryos während der ersten 24 Stunden.
- Film 10 illustriert den Symmetriebruch in den Zellteilungen nach neun Zellzyklen und die frühe Festlegung der Körperachse des Embryos.
- Film 11 zeigt die Migrationswege von Zellen, die das frühe Zebrafischauge bilden.
- Film 16 illustriert, wie sowohl Involution als auch Ingression eine Rolle bei der Zebrafischgastrulation spielen.
- w3 – Für mehr Informationen über das Karlsruher Institut für Technologie, siehe: www.kit.edu
Resources
- Patterson L (2010) Getting ahead in evolution. Science in School 14: 16-20.
- Hodge R (2006) A search for the origins of the brain. Science in School 2: 68-71.
- Für eine Sammlung von Lern- und Forschungsressourcen zum Thema Embryonalentwicklung, siehe: http://people.ucalgary.ca/~browder/virtualembryo
Institutions
Review
Dieser Artikel beschreibt den Fortschritt auf dem neuesten Stand der Entwicklungsbiologie. Das potentielle Ergebnis – ein virtueller Embryo, der mit anderen Wissenschaftlern geteilt und von ihnen annotiert werden kann – genau wie Fotos und Kommentare zu Google Earth hinzugefügt werden können – ist ein spannendes Beispiel dafür, wie Forschungsergebnisse verbreitet, kommentiert und vielleicht erweitert werden können. Dies passt gut zum Konzept von globaler Wissenschaft und Kommunikation, das in manchen Lehrplänen enthalten ist.
Viel in diesem Artikel kann interessierte Biologieschüler begeistern. Die Verwendung von hoch entwickelter Mikroskopie zur Überschreitung wissenschaftlicher Möglichkeiten könne zu Diskussionen darüber dienen, wie die Technologie Entdeckungen behindert; oder wie vergänglich und unsicher Forschungs„wissen“ ist, weil es von der neuesten Technik abhängt.
Die Verwendung von Zebrafischembryonen kann auch zu ethischen Debatten anregen. Ist es richtig, an Fischembryonen zu experimentieren? Was ist mit Säugerembryonen? Oder menschlichen Embryonen? Man könnte über einige rechtliche Aspekte dieser Art Forschung diskutieren.
Auch könnte dieser Artikel Biologielehrern helfen, ihr eigenes Wissen zu aktualisieren. Er könnte zudem als Hintergrundwissen dienen, etwa für Schüler, die an Biologiewettbewerben teilnehmen, oder für Hochschulbewerbungen. Zusätzlich hilft das Videomaterial, die embryonale Entwicklung für Kurse mit diesem Thema zu illustrieren.
Mögliche Verständnisfragen:
- Beschreiben und diskutieren Sie ethische Probleme, die bei der Arbeit der Wissenschaftler eine Rolle spielen.
- Erörtern sie die Bedeutung der Arbeit an Fischembryonen für die zukünftige Behandlung humaner Krankheiten.
Sue Howarth, Vereinigtes Königreich





