Pojedyncza cząsteczka pod mikroskopem Understand article
Tłumaczenie Jadwiga Schreiber. Czy nie byłoby fascynujące zobaczyć a może nawet zmanipulować pojedyncze cząsteczki? Patrick Theer i Marlene Rau z European Molecular Biology Laboratory wyjaśnią nam jak za pomocą mikroskopu sił atomowych (ang. atomic force microscope) możemy to zrobić…
Henrik5000 / iStockphoto
Umożliwienie oglądania pod mikroskopem pojedynczych cząsteczek fascynowało naukowców przez wiele stuleci. Ten ambitny cel zrealizowany został w roku 1981 dzięki konstrukcji skaningowego mikroskopu tunelowego (ang. scanning tunnelling microscopy), za który Gerd Binnig i Heinrich Rohrer z IBM Research Laboratory w Rüschlikon w Szwajcarii, otrzymali Nagrodę Nobla w dziedzinie fizyki w roku 1986w1. Mikroskop ten ma jednak dość duże ograniczenie: umożliwia on badanie tylko materiałów przewodzących prąd i dlatego wiele obiektów np. biologicznych, nie nadawało się w nim do analizy. Binning i jego współpracownicy kontynuowali poszukiwania lepszego rozwiązania i w roku 1986 zaprezentowali model mikroskopu sił atomowych (ang. atomic force microscope AFM), umożliwiający badanie materiałów przewodzących i nieprzewodzących prąd elektryczny.

vinyl record, ready to begin
scanning its surface to
produce sound
Zdjęcie dzięki uprzejmości
arbobo; Źródło zdjęcia: Flickr
Mikroskop ten działa na bardzo podobnej zasadzie jak gramofon, w którym ostra igła porusza się po rowkach płyty winylowej i w ten sposób odczytuje zapisany na niej dźwięki (zobacz ilustrację po prawej stronie). AFM też raczej „czuje” atomy a nie „widzi” ich: analizowana powierzchnia skanowana jest za pomocą bardzo wąskiego ostrza (jednego lub kilku; z krzemu lub azotku krzemu) zamocowanego na końcu sprężystej mikrodźwigni, która jest w stanie wyczuć nawet najmniejsze detale na badanej powierzchni. Gdy końcówka ostrza, składająca się z pojedynczego atomu, znajdzie się w pobliżu lub wejdzie w kontakt z powierzchną badanego obiektu zostanie ona „odchylona” poprzez siły zachodzące między cząsteczkami (ostrza i obiektu): może to być siła van der Waalsa, siła kapilarna, siła wiązania chemicznego, siła elektrostatyczna lub magnetyczna, efekt Casimira, siła solwatacji czy też inna siła, w zależności od natury badanego obiektu.
Ponieważ AFM detektuje wszystkie z wspomnianych wyżej sił oddziaływania międzycząsteczkowego, jego zastosowanie jest wszechstronne i bardzo popularne wśród naukowców – min. do badań właściwości materiałów i w biologii. W każdym z tych przypadków siła powodująca „odchylenie” ostrza jest minimalna i proporcjonalna do odległości pomiędzy ostrzem i badaną powierzchnia.
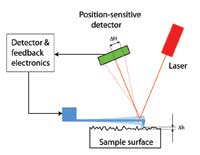
wzmocnić sygnał pochodzący
ze zmiany położenia ostrza
AFM. Kliknij na obrazek aby
powiększyć
Zdjęcie dzięki uprzejmości
Patrick Theer
W jaki sposób mierzone są te odchylenia ostrza? Wynalazcy mikroskopu wykorzystali tu sprytny trik: wiązka laseru pada na końcówkę mikrodźwigni, skąd ulega odbiciu i reflektuje na detektor światła, czujny na zmianę pozycji laseru. Zmiana pozycji wiązki laseru na detektorze światła (zobacz ilustrację po lewej stronie, ∆H), spowodowana odchyleniem ostrza (zobacz ilustracje na stronie 61, ∆h), jest proporcjonalna to odległości pomiędzy detektorem i ostrzem. Jeśli odległość ta jest wystarczająco duża nawet minimalne odchylenia ostrza mogą być rejestrowane, umożliwiając analizę powierzchni próbki atom po atomie.

biofouling
Zdjęcie dzięki uprzejmości
lovestruck; Źródło zdjęcia:
Flickr
Możliwości zastosowania AFM są niezliczone. Poniżej przedstawionych zostało tylko kilka przykładów. Generalnie, AFM został opracowany do szczegółowej obserwacji i analizy różnych powierzchni. Jest to interesujące nie tylko z naukowego punktu widzenia, ale może to również przynieść korzyści ekonomiczne. Przykładem może być tzw. biofouling (ang.). Jest to niepożądane gromadzenie się mikroorganizmów, roślin (np. alg) czy zwierząt (np. wąsonogów, Cirripedia) na mokrych powierzchniach np. na kadłubie statku. Nagromadzenie się grubej warstwy biologicznego zanieczyszczenia na powierzchni statku podnośni opór wody i powoduje stopniowe, ale zauważalne zwiększenie zużycia paliwa. Problem ten zaobserwowano również na membranach bioreaktorów, w systemach chłodniczych w elektrowniach czy rurociągach naftowych. Za pomocą AFM naukowcy analizują warstwy nagromadzonego biofoulingu i testują różne substancje przeciwdziałające jego powstawaniu (Finlay et al., 2010).

Frantysek / iStockphoto
Podobne zastosowanie AFM ma w rolnictwie: rośliny ananasa często cierpią na grzybicę zwaną fusariosis. Naukowcy porównali strukturę komórek powierzchniowych pomiędzy roślinami odpornymi na tą grzybicę z roślinami, które są na nią podatne i stwierdzili, że posiadają one różne właściwości mechaniczne. Odkrycie to pomoże w doborze odpowiednich roślin (o pożądanych właściwościach mechanicznych komórek) do dalszych upraw (de Farias Viégas Aquije et al., 2010).
Czy poznanie struktury powierzchni różnych obiektów ma jakiekolwiek znaczenie dla człowieka? Odpowiedź jest prosta: tak. AFM często stosowany jest w stomatologii, na przykład w porównywaniu efektywności różnych metod usuwania osadu i kamienia nazębnego; do pomiaru chropowatości powierzchni aparatów ortodontycznych i jej wpływu na efektywność korekcji pozycji zębów; czy też do pomiaru uszkodzenia szkliwa zębów przez kwas w napojach gazowanych i skuteczności różnych past do zębów w procesie regeneracji szkliwa (Kimyai et al., 2011; Lee et al., 2010; Poggio et al., 2010).
-related applications
Zdjęcie dzięki uprzejmości
webking / iStockphoto
Innym przykładem zastosowania AFM w medycynie jest produkcja tzw. biomateriałów stosowanych w medycynie regeneracyjnej. Jeśli taki biomateriał wejdzie w kontakt z żywą komórką (tkanką), właściwości jego powierzchni, jak np. adhezja, szorstkość, swobodna energia powierzchniowa, ładunek powierzchniowy oraz właściwości i skład chemiczny, decydują o charakterze tej interakcji. Dlatego też AFM może być pomocny w projektowaniu i produkcji biomateriałów, które tolerowane są przez ciało człowieka, czyli do produkcji implantatów jak np. endoproteza stawu biodrowego (Al-Ahmad et al., 2010; Kolind et al., 2010; Padial-Molina et al., 2011).
AFM odgrywa bardzo ważną rolę również w badaniach klinicznych i często używany jest do analizy białek np. ich nieprawidłowego fałdowania czy agregacji jak np. w przypadku alfa synukleiny, insuliny, prionów, glukagonu czy beta amyloidu. Nieprawidłowa struktura białek związana jest z rozwojem wielu chorób degeneracyjnych jak np. cukrzycy typu 2, choroby Parkinsona, gąbczastej encefalopatii bydła (choroba szalonych krów), pląsawicy Huntingtona czy choroby Alzheimera. Dzięki AFM naukowcom udało się już wiele dowiedzieć na temat nanostruktury tych agregatów białkowych, wierzą oni również, że AFM pomoże im zrozumieć powody ich nieprawidłowego fałdowania oraz wpływ otaczających warunków na ten proces (Lyubchenko et al., 2010; więcej informacji na temat nieprawidłowego fałdowania się prionów można znaleźć w atrykule Tatalovic, 2010).

Synchrotronu Atomowego w
Grenoble (z ang. European
Synchrotron Radiation
Facility) zaprojektował
specjalny mikroskop sił
atomowych wykorzystujący
do badań promieniowanie
synchrotronowe
(promieniowanie X,
rentgenowskie). Dzięki AFM
można precyzyjnie umieścić
nanoskopowe obiekty w
samym centrum wiązki
promieniowania X. Nie jest to
łatwe zadanie – rozmiar
badanego obiektu i
szerokość wiązki
promieniowania X często jest
mniejsze niż 100 nm
Zdjęcie dzięki uprzejmości
ESRF / Small Infinity
Innym przykładem zastosowania AFM w badaniach interakcji biologicznych, są badania dotyczące interakcji ludzkich trofoblastów (komórek tworzących zewnętrzną warstwę błony płodowej i odpowiedzialnych za tworzenie się łożyska oraz transport substancji odżywczych do płodu) z komórkami nabłonkowymi macicy – procesu będącego podstawą udanej implantacji zarodka (Thie et al., 1998).
AFM może być użyty nie tylko do obserwacji. Używając AFM można również manipulować atomy, cząsteczki i inne nanostruktury. Na przykład za pomocą nano-pęsety można wyciąć i badać małe fragmenty błony komórkowej czy wyizolować fragmenty białek by odtworzyć ich strukturę czy też zmienić konformację poszczególnych białek by zrozumieć ich właściwości biofizyczne.
Od nano-pęsety pozostaje już tylko mały krok do tzw. nano-chirurgii: gdzie za pomocą AFM można by wyizolować lub wprowadzić pojedyncze molekuły np. leki z/do cytoplazmy komórki i w ten sposób zbadać ich wpływ na komórkową homeostazę (Lamontagne et al., 2008; Müller et al., 2006).
Zmodyfikowana końcówka ostrza AFM może być również użyta, jako wiertło lub „długopis”: nano-drążenie powierzchni obiektów (Gozen & Ozdoganlar, 2010), czy nano-litografia – naprowadzane stałych czy płynnych wzorów na powierzchni obiektów. W laboratoriach chemicznych czy biologicznych technologia ta używana jest do produkcji nanoskopowych sensorów czy funkcjonalnych nano-obwodów i nano-urządzeń. Poprzez nanoszenie na daną powierzchnię różnych nano-struktur z metalu, półprzewodników czy też z tlenków metali, różnego rodzaju informacje mogą zostać „zapisane” (zakodowane; Basnar & Willner, 2009). W przyszłości, budowa takich nano-obwodów czy nano-urządzeń w połączeniu z użyciem ostrza AFM do „przesuwania” (manipulowania) np. pojedynczych atomów na danej powierzchni, otworzy drogę do miniaturyzowania układów elektronicznych i pamięci cyfrowej.
Mimo szerokiego zasięgu zastosowania AFM – w artykule tym podanych jest tylko kilka przykładów – możliwości AFM nie są wyczerpane. W przyszłości planowana jest dalsza optymalizacja ostrza AFM oraz kombinacja AFM z innymi technikami np. jednoczesna analiza struktury powierzchni obiektu oraz jej fluorescencji czy właściwości elektrycznych (Müller et al., 2006). Innym aspektem jest szybkość analizy obrazu czy obiektu: niedawno opracowano AFM z 1000 krotnie szybszą analizą obrazu, w którym procesy biologiczne jak segregacja i replikacja chromosomów, fagocytoza czy synteza protein, mogą być śledzone „na żywo” (Ando et al., 2008).
Czy masz może jeszcze inny pomysł na zastosowanie AFM? Jeśli chciałbyś wyborować AFM to może zainteresuje cię instrukcja Philippe Jeanjacquota jak budować własny mikroskop sił atomowych np. w twojej szkolew2. Z pewnością zajmie to dość sporo czasu, ale jest to możliwe – Jeanjacquot i jego uczniowie zbudowali własny, funkcjonalny, nisko budżetowy mikroskop sił atomowych. Istnieje jedno podstawowe wymaganie: do budowy mikroskopu potrzebne jest bezdrganiowe miejsce np. pusta piwnica. Jeśli masz do dyspozycji takie miejsce to potrzebne są już tylko: twój entuzjazm i pomysłowość.
References
- Al-Ahmad A et al. (2010) Biofilm formation and composition on different implant materials in vivo. Journal of biomedical materials research. Part B, Applied Biomaterials 95(1): 101-109. doi: 10.1002/jbm.b.31688
- Ando T et al. (2008) High-speed AFM and nano-visualization of biomolecular processes. Pflügers Archiv: European journal of physiology 456(1): 211-225. doi: 10.1007/s00424-007-0406-0
- Basnar B, Willner I (2009) Dip-pen-nanolithographic patterning of metallic, semiconductor, and metal oxide nanostructures on surfaces. Small 5(1): 28-44. doi: 10.1002/smll.200800583
- de Farias Viégas Aquije GM et al. (2010) Cell wall alterations in the leaves of fusariosis-resistant and susceptible pineapple cultivars. Plant Cell Reports 29(10): 1109-1117. doi: 10.1007/s00299-010-0894-9
- Finlay JA et al. (2010) Barnacle settlement and the adhesion of protein and diatom microfouling to xerogel films with varying surface energy and water wettability. Biofouling: The Journal of Bioadhesion and Biofilm Research 26(6): 657-666. doi: 10.1080/08927014.2010.506242
- Gozen BA, Ozdoganlar OB (2010) A rotating-tip-based mechanical nano-manufacturing process: nanomilling. Nanoscale Research Letters 5(9): 1403-1407. doi: 10.1007/s11671-010-9653-7. Artykuł ten dostępny jest bezpłatnie w internecine.
- Kimyai S et al. (2011) Effect of three prophylaxis methods on surface roughness of giomer. Medicina Oral, Patología Oral y Cirugía Bucal 16(1): e110-e114. doi: 10.4317/medoral.16.e110. Artykuł ten dostępny jest bezpłatnie w internecine.
- Kolind K et al. (2010) A combinatorial screening of human fibroblast responses on micro-structured surfaces. Biomaterials 31(35): 9182-9191.
 doi: 10.1016/j.biomaterials.2010.08.048
doi: 10.1016/j.biomaterials.2010.08.048 - Lamontagne CA, Cuerrier CM, Grandbois M (2008) AFM as a tool to probe and manipulate cellular processes. Pflügers Archiv: European journal of physiology 456(1): 61-70. doi: 10.1007/s00424-007-0414-0
- Lee GJ et al. (2010) A quantitative AFM analysis of nano-scale surface roughness in various orthodontic brackets. Micron 41(7): 775-782. doi: 10.1016/j.micron.2010.05.013
- Lyubchenko YL et al. (2010) Nanoimaging for protein misfolding diseases. Wiley Interdisciplinary Reviews (WIREs). Nanomedicine and Nanobiotechnology 2(5): 526-543. doi: 10.1002/wnan.102
- Müller DJ et al. (2006) Single-molecule studies of membrane proteins. Current Opinion in Structural Biology 16(4): 489-495. doi: 10.1016/j.sbi.2006.06.001
- Padial-Molina M et al. (2011) Role of wettability and nanoroughness on interactions between osteoblast and modified silicon surfaces. Acta biomaterialia 7(2): 771-778.
 doi: 10.1016/j.actbio.2010.08.024
doi: 10.1016/j.actbio.2010.08.024 - Poggio C et al. (2010) Impact of two toothpastes on repairing enamel erosion produced by a soft drink: an AFM in vitro study. Journal of Dentistry 38(11): 868-874.
 doi: 10.1016/j.jdent.2010.07.010
doi: 10.1016/j.jdent.2010.07.010 - Tatalovic M (2010) Deadly proteins: prions. Science in School 15: 50-54. www.scienceinschool.org/2010/issue15/prions
- Thie M et al. (1998) Interactions between trophoblast and uterine epithelium: monitoring of adhesive forces. Human Reproduction 13(11): 3211-3219. doi: 10.1093/humrep/13.11.3211. Artykuł ten dostępny jest bezpłatnie w internecine.
Web References
- w1 – Aby dowiedzieć się więcej o odkryciu skaningowego mikroskopu tunelowego, za który Gerd Binning i Heinrich Rohrer odznaczeni zostali Nagrodą Nobla w dziedzinie fizyki w 1986, zobacz: http://nobelprize.org/nobel_prizes/physics/laureates/1986
- w2 – W krótce udostępniona zostanie instrukcja do zbudowania własnego lub szkolnego AFM. Jeśli chciałbyś otrzymać powiadomienie, gdy instrukcja te będzie gotowa, napisz do nas editor@scienceinschool.org
Resources
- Szwajcarscy naukowcy zaprojektowali pierwszy AFM dla badań planetologicznych, które są częścią misji na planetę Mars prowadzonej przez NASA Phoenix. Aby oglądnąć wprowadzenie do tego projektu wejdź na stronę Azonano (www.azonano.com) lub zobacz ten link: http://tinyurl.com/6yguvb9
- ‘Universe today’ opisuje jak ważną rolę odegrał mikroskop sił atomowych w misji na Mars. Zobacz ich stronę internetową (www.universetoday.com) lub zobacz artykuły: śnieg na Marsie (http://tinyurl.com/6kp3rym) i ziarna marsjańskiego pyłu (http://tinyurl.com/64z6xrb)
Review
Artykuł ten może być przydatny przy omawianiu różnorodnych zagadnień na zajęciach szkolnych – różnych lekcji fizyki, ale również przy omawianiu fizjologii zwierząt czy badań biomedyncznych. Artykuł ten może być przydatny przy omawianiu różnorodnych zagadnień na zajęciach szkolnych – różnych lekcji fizyki, ale również przy omawianiu fizjologii zwierząt czy badań biomedyncznych.
Poniżej podane są przykładowe pytania nawiązujące do tematu tekstu::
- Jakie organicznie posiada skaningowy mikroskop tunelowy?
- Jaki inny mikroskop rozwiązał ograniczający problem skaningowego mikroskopu tunelowego?
- Wyjaśnij, dlaczego AFM działa podobnie jak gramofon? (Weź pod uwagę, że nie wszyscy uczniowie wiedzą, co to gramofon)
- Wyjaśnij pojęcie zanieczyszczenia biologicznego (z ang. biofouling).
- Dlaczego zanieczyszczenie biologiczne jest problemem?
- Podaj przykłady zastosowania AFM.
- Gdybyś miał do dyspozycji AFM, jaki obiekt chciałbyś zbadać/zobaczyć?
Artykuł ten przeznaczony jest dla uczniów klas starszych a szczególnie nadaje się dla uczniów zdolnych do kreatywnego myślenia. Tematyka obrazowania pojedynczych cząsteczek może być ciekawym zagadnieniem np. do eseju naukowego, w połączniu np. z pomysłami z filmu Honey, I Shrunk the kids (w którym, naukowiec pracujący nad ściśle tajnym projektem budowania maszyny do minimalizacji obiektów, przez przypadek zmniejszył rozmiar ludzi). Innym ciekawym tematem do dyskusji są obiekty, jakie uczniowie chcieliby zobaczyć i zanalizować w AFM. Czy byliby oni zainteresowani np. lekarstwami na nieuleczalne obecnie choroby czy raczej przedmiotami z życia codziennego?
Jennie Hargreaves, Wielka Brytania





