Die große Wanderung Understand article
Übersetzt von Hildegard Kienzle-Pfeilsticker. Warum verhalten sich Zellen wie Gnus? Laura Spinney auf den Spuren der Zellwanderung und der Organbildung mit Hilfe des kleinen und transparenten Zebrafisches.
Jedes Jahr im Mai ziehen riesige Herden Gnus auf der Suche nach Nahrung von den trockenen ostafrikanischen Ebenen Richtung Wälder. Im Novmber kehren sie zurück, wenn die kurzen Regenfälle die Ebene tränken und vollenden so ihren jährlichen Wanderungszyklus. Jedes Gnu verhält sich gemäß seinem Überlebensinstinkt, der es in die Gemeinschaft anderer Gnus drängt. Eine einmal gebildete Herde verhält sich wie eine neue Einheit mit ihren eigenen Regeln. Zellen besitzen einen ähnlichen Herdentrieb. Ihre genetische Ausstattung gibt ihnen vor, mit anderen Zellen zusammenzuarbeiten. Aber es gibt keine unumstößlichen Befehlssätze, die festlegen, wie sich jede einzelne Zelle in der Gruppe genau zu verhalten hat. „Wir erkennen jetzt, dass viele Ereignisse nach der Befruchtung nicht in allen Einzelheiten festgelegt und formbar sind und selbst-organisierenden Prinzipien gehorchen“, sagt Darren Gilmour vom Europäischen Laboratorium für Molekularbiologie in Heidelberg, Deutschland.
Als Entwicklungsbiologe möchte Darren diese Prinzipien verstehen, denn die umfangreiche Zellwanderung resultiert in der Bildung komplizierter und komplexer Systeme wie Blutgefäßen und des Atmungssystems. Da die Zellen innerhalb der Wanderungsgruppen sich hinsichtlich ihrer Genexpression wohl sehr ähneln, würde wohl ein Knock-out (eine Inaktivierung) oder ein Knock-down (eine Aktivitätsminderung) einzelner Gene die Wanderung der gesamten Gruppe blockieren. Er braucht eine ausgefeiltere Herangehensweise, um die sozialen Netzwerke der Zellen zu zerstören und zu beobachten, wie dadurch ihre Fähigkeit leidet, zu wandern und Organe zu bilden. „Im Grunde ist es wie Soziologie“, meint er und fügt an: „Wir möchten wissen wer zu wem sagt, was er tun soll und wie.”

Bild mit freundlicher Genehmigung von Darren Gilmour, EMBL
Diese Prinzipien erforscht Darrens Gruppe an Seitenlinien-Vorläuferzellen (Primordium) vom Zebrafisch, einer vorübergehenden Struktur, die nur während einer frühen Entwicklungsphase erkennbar ist. Sie versorgt den Fischembryo mit Haarzell-Organen — sensorischen Organen, mit denen weitere Fische über winzige Änderungen des Wasserdrucks wahrgenommen werden können. „Das Primordium ist eine Gruppe aus gut 100 Zellen, die unter der Haut des Tieres wie eine Schnecke allmählich entlangwandern“, erklärt Darren, und weiter: „Sie starten hinter dem Ohr, bewegen sich Richtung Schwanz und hinterlassen auf dem Weg eine zwei Zellen dicke Fährte, unterbrochen durch kleine Zellhaufen, die sich später eventuell zu Haarzell-Organen entwickeln.”
Der Zebrafisch eignet sich gut als Modellsystem, da er die Wünsche von Biologen erfüllt: Er ist transparent und damit kann das Verhalten von lebenden Zellen beobachtet werden, deren Proteine mit fluoreszierenden Farbstoffen markiert worden sind. Das Seitenliniensystem kann leicht genetisch manipuliert werden und ist gleichzeitig wie ein Geschenk für alle an Zellmigration Interessierten, weil der Fisch einen auch für den Menschen wichtigen Signalweg nutzt, der daher gut untersucht ist. SDF1, ein chemisches Signal, welches einem menschlichen gleicht, löst eine ganze Reihe von Veränderungen in den Primordialzellen aus. Dazu bindet es an einen Rezeptor namens Cxcr4b außen auf der Zellmembran. Das Protein Cxcr4b durchspannt die Zellmembran und ist für die HIV-Infektion beim Menschen notwendig. Es spielt sowohl eine Rolle in der normalen Entwicklung von Organismen, ist aber auch beteiligt an der Metastasierung oder dem Streuen von Tumorzellen.
Darrens Gruppe sah, dass in einer Zebrafischmutante mit weniger Signalen über Cxcr4b das Primordium orientierungslos wird — sie bewegen sich nicht mehr vorwärts und hinterlassen keine „Schneckenspur“ (die zwei Zellen dicke Fährte). Ferner scheint die statische Struktur aufzuhören, Zellhaufen zu produzieren, als ob sie sich bewegen muss und diese Haufen ausstoßen, um mehr davon zu erzeugen. Einer der interessantesten Charakteristika der Mutante bei genauerem Hinsehen ist allerdings, dass die Zellen sich immer noch bewegen, obwohl sie nicht wandern. Dabei irren sie scheinbar zufällig umeinander herum.w1„Es sieht so aus, als ob die Zellen verwirrt wären. Wie Affen in einem Sack“, sagt Darren. Das sei der Schlüssel zur Arbeitsweise des Systems, fügt er an.
Um die Mutation wieder rückgängig zu machen (mutant rescue) und die Vorwärtsbewegung des Primordiums wieder zu ermöglichen, konstruierten die Forscher ein genetisches Mosaik. Dazu transplantierten sie einige normale, „sehende“ Zellen, die den Cxcr4b-Rezeptor exprimierten und daher auf SDF1a reagierten, in ansonsten „blindes“, mutiertes Gewebe. Normale und mutierte Zellen wurden mit rot beziehungsweise grün fluoreszierenden Proteinen markiert. Auf diese Weise konnten Darren und sein Team die Bewegungen der Zellen verfolgen. Die sehenden Zellen fanden sehr schnell ihren Weg an die Vorderseite durch die orientierungslosen Zellen im Primordium hindurch. Das Primordium bewegte sich wieder vorwärts.
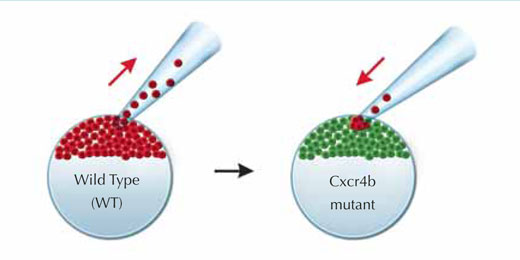
Bild mit freundlicher Genehmigung von Petra Riedinger, EMBL
„Seltsam bei diesen Experimenten war nur, dass nicht alle der ansprechenden, Cxcr4b exprimierenden Zelllen den Weg zur Vorderseite fanden“, berichtet Darren. Sobald einige von ihnen die Front erreicht hätten, hörte die Zufallsbewegung auf, das Primordium bewegte sich vorwärts und diejenigen Rezeptor-positiven Zellen, die noch nicht die Vorderseite erreicht hätten, blieben an ihrem Ort — wie eingefroren. „Wir denken, dass das System durch die Instabilität aufrechterhalten bleibt. Es wandert umher und bewegt sich zufällig. Damit sorgt es dafür, dass die den Weg weisenden Zellen in die Führungsposition gelangen. Sobald sie ziehen, erstarren die anderen“, erklärt er.
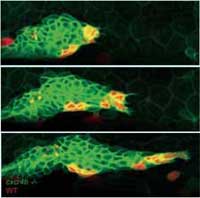
Wildtyp-Zellen (rot) ihren Weg an
die Spitze des Primordiums und
stoßen in Wanderungsrichtung vor.
Dabei ziehen sie mutierte Zellen
(grün) hinter sich her
Bild mit freundlicher Genehmigung
von Darren Gilmour, EMBL
Wenn aber nicht alle sensiblen Zellen zu Anführern werden, was macht einige von ihnen dazu? Egal woran es liegt, unterschiedliche Genaktivität scheint nicht die Ursache zu sein. „Die Gene bestimmen nicht, wer Anführer und wer Nachfolger ist. Eher ist es so, dass die Gene alle Zellen mit demselben Rezeptor ausstatten. Danach ist es ein Kampf unter Gleichen“, sagt Darren. Er und seine Mitarbeiterin Petra Haas denken, dass Führung eher durch die Instabilität der wandernden Zellgruppe definiert werden muss. Durch die Zufallsbewegung der Zellen erlangen einige von ihnen zeitweise einen Vorteil gegenüber anderen, indem sie mehr Signale empfangen können. Sie orientieren sich am Signal und bewegen sich an das vordere Ende, wenn sie die Aktivierung des Rezeptors beibehalten können. Das ist aber bei weitem noch nicht alles.
Eine Hypothese der Zellbewegung lautet, dass die Führungszellen die Nachfolgezellen irgendwie mitnehmen. Diese wiederum lassen es passiv zu. Darren steht dem, wie er es nennt, Anhaltermodell skeptisch gegenüber. Eher denkt er, dass die Anführer den anderen die richtige Richtung weisen und dass das Primordium intern so organisiert ist, dass die anderen aktiv folgen. Er glaubt, dass ein ähnliches Prinzip jeder Organentwicklung zugrunde liegt. „Ich sage beispielsweise für die Verzweigung von Blutgefäßen voraus, dass eine kleine Zahl von Zellen an der Spitze die Signale der Umwelt empfangen und durch Zell-Zell-Interaktionen irgendwie das Verhalten der anderen beeinflussen“, sagt er. Die anderen müssten die Welt nicht sehen. Er benutzt das Beispiel eines Falken, der einen Schwarm Staren überfällt. Nicht alle Staren müssen den Falken sehen, um eine angemessene Fluchtreaktion zu zeigen – sie müssen nur die panische Antwort ihrer Nachbarn wahrnehmen.
So weit, so gut. Aber die Geschichte wird noch komplizierter, weil sich herausstellt, dass nicht alle Nachfolgenden in gleicher Weise handeln. Bei den bildgestützten Experimenten an lebenden Zellen haben Darren und sein Team festgestellt, dass während des Vorstoßes des Primordiums die hinteren Zellen ihre Wanderungsgeschwindigkeit verlangsamen. Das führt zu einer Streckung des Gewebes. Der Doktorand Guillaume Valentin hat jetzt einen weiteren Rezeptor in eben diesen rückwärtigen Zellen identifiziert, der auch auf SDF1a anspricht. Aber dieser Rezeptor löst ein anderes Verhalten aus als das des SDF1a/Cxcr4b-Wegs. Das verleiht diesen Zellen einen gewissen Grad an Unabhängigkeit von den Cxcr4b exprimierenden Führungszellen.
Während sich das Primordium vorwärts bewegt und Zellhaufen hinter sich zurücklässt, ist die Hauptströmung der Zellen durch die Struktur rückwärts gerichtet. Darren vermutet, dass die Zellen während sie zurückfallen, möglicherweise auf den zweiten Rezeptor umschalten. Er spekuliert, dass die Kombination der beiden Zellpopulationen mit den verschiedenen Rezeptoren eine Art Caterpillar-Bewegung hervorrufen, wobei sich Vorder- und Rückseite des Primordiums abwechselnd vorwärts bewegen. Unterstützt wird diese Vermutung durch Experimente mit Zebrafischembryos, in denen die Aktivität des zweiten Rezeptors reduziert ist und die zweite Hälfte der koordinierten Bewegung fehlt. „Der führende Zellsaum zieht und zieht, aber die rückwärtigen Zellen kommen nicht mit und so gibt er schließlich auf und fällt zurück“, sagt er.
Wenn er Recht hat, stellen sich mit den neuen Erkenntnissen Fragen über das Ausmaß der Dynamik, mit der Informationen in großen Zellgruppen weitergegeben werden. Wir müssen nicht nur die Signalweiterleitung verstehen, sondern auch die Vermittlung von Kräften in Zellpopulationen mittels Zell-Zell-Interaktionen. An dieser Stelle möchte Darren weiterforschen. Im Moment ist er jedoch begeistert über die Entdeckung eines zweiten SDF1a-Rezeptors im Zebrafisch-Primordium. „Die Idee, dass auch die inneren Zellen Signale wahrnehmen können, ist ganz neu“, sagt er. Ob bei Gnus das gleiche Prinzip gilt, ist eine andere Geschichte
Resources
- Haas P, Gilmour D (2006) Chemokine signaling mediates self-organizing tissue migration in the zebrafish lateral line. Developmental Cell 10: 673-680. doi: 10.1016/j.devcel.2006.02.019
Institutions
Review
Ich habe mich sehr darüber gefreut, dass ich diesen Artikel rezensieren durfte, denn sonst hätte ich ihn sicher nicht so aufmerksam gelesen. Er ist so gut geschrieben und enthält viele anschauliche Analogien wie die Verknüpfung der Wanderung afrikanischer Herdentiere mit der Wanderung von Zellen in sich entwickelnden Organismen. Faszinierend ist nicht nur die zugrunde liegende Biologie mit Signalproteinen, HIV-Infektion, Zebrafisch, Krebszellen und mutierten „blinden“ Zellen, sondern auch die Beschreibung der Methoden des Forscherteams, die sich lesen wie eine Detektivgeschichte: die Entwicklung von Theorien, das Verwerfen von Modellen, der Schritt zu neuen Ideen und deren Überprüfung.
Für Biologielehrer steckt viel Interessantes in diesem Artikel. Er wäre auch eine ausgezeichnete Verständnisübung oder würde für Schüler ab 16 Jahren ergänzendes Material liefern. Andererseits wäre er sehr sinnvoll für eine Diskussion über Embryologie, Entwicklung von Wirbeltieren, Genmanipulation, Kommunikation zwischen Zellen gegenüber Kommunikation zwischen Organismen, Signalproteinen, Krebs, Mutationen, Abläufe wissenschaftlicher Untersuchungen oder Theoriebildung.
Sue Howarth, UK





