Di che cosa sono fatte le stelle? Teach article
Tradotto da Rocco G. Maltese. Scopriamo come conosciamo di cosa sono fatti il Sole (e le stelle).
Diversamente dai componenti del Sistema Solare, del tipo dei pianeti e dei satelliti, e stelle sono fuori dal raggio delle navicelle spaziali, o nel caso del Sole, la sua temperatura é troppo alta perché possa essere avvicinato. E allora come possiamo capire come sono fatti se non possiamo utilizzare sonde, robot o astronauti per studiarli? La risposta é che dobbiamo studiare la propria luce. Sappiamo che il colore di una stella é dato dalla temperatura emessa (Ribeiro, 2015), ma come facciamo a sapere di cosa sono fatte le stelle? Nuovamente, dalla luce emessa dalle stelle, dal loro spettro, questa é la risposta.
Al festival Science on Stage (le Scienze alla Ribalta), che si é tenuto a Londra a Giugno del 2015, si é discusso tra noi come potevamo combinare alcune attività sperimentali che avessero insegnato agli studenti la composizione chimica delle stelle e fu così che nacque questa attività. È congegnata in modo da permettere agli studenti di età tra 15 e 18 anni di studiare differenti spettri luminosi e capire come possono essere utilizzati per individuare gli elementi chimici all’interno di una lampada e, molto più interessante, nella nostra stella più vicina, il Sole.
Lo spettro della luce
Isacco Newton, nel suo famoso esperimento del 1666, utilizzando un prisma, dimostrava come la luce poteva essere scomposta nei suoi colori e questi colori potevano essere ricombinati ottenendo un raggio di luce bianca. Egli ha dimostrato che i colori non hanno origine all’interno del cristallo, come si credeva in precedenza, ma che invece rappresentavano le componenti (o le lunghezze d’onda) della luce solare. Egli ha coniato la parola ‘spettro’ per descrivere i colori dell’arcobaleno e la sua scoperta ha dato inizio alla scienza della spettroscopia.

A Newton lo spettro del Sole appariva continuo, con nessun intervallo tra i colori. Ma nel 1814, Joseph von Fraunhofer scoprì che quando la luce é sufficientemente dispersa ottenuta facendola passare attraverso una stretta fenditura, si vede che lo spettro contiene un certo numero di linee oscure, conosciute come le linee di Fraunhofer (figura 1). Circa 45 anni dopo, queste linee si sarebbero rese essenziali per la determinazione ella composizione del Sole, grazie al lavoro di Gustav Kirchhoff e Robert Bunsen.
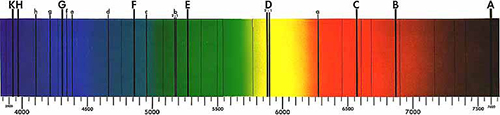
Immagine di dominio pubblico; fonte: Wikimedia Commons
Nel 1860, Kirchhoff e Bunsen studiarono un differente specie di spettro. Invece di osservare le linee scure su uno sfondo chiaro, studiarono le linee luminose su uno sfondo scruto, emesso quando si riscaldavano gli elementi alla fiamma del gas emessa dal becco Bunsen. Tale spettro era quello del sodio (figura 2), che si ottiene riscaldando il sale da cucina (NaCl) o accendendo una lampada ai vapori di sodio a bassa pressione, come quelle utilizzate per l’illuminazione stradale.
Bunsen e Kirchhoff conclusero che gli elementi chimici si potevano individuare utilizzando queste linee di emissione e, considerando questo fatto, trovarono due nuovi elementi e i due anni successivi: il cesio e il rubidio.
Kirchhoff ha continuato il suo lavoro capendo che le linee di emissione coincidono con diverse linee di Fraunhofer. Per esempio, le line giallo acceso dello spettro del sodio si trovavano nelle stesse posizioni delle linee scure nella regione del giallo dello spettro solare, detta ‘D’ di Fraunhofer.

Immagine di pubblico dominio; fonte: Wikimedia Commons
Questi primi esperimenti rivelarono che che vi erano tre tipi principali di spettro; continuo, di assorbimento e di emissione. Il primo mostra tutte le lunghezza d’onda, il secondo contiene solo alcune delle lunghezze d’onda della luce, e il terzo mostra i vuoti, o le linee scure su sfondo chiaro. Questi spettri si formano secondo quanto stabiliscono le tre leggi di della spettroscopia di Kirchhoff:
- Un spettro continuo è emesso da un solido, un liquido o un gas incandescente, ad alta pressione.
- Uno spettro di assorbimento si ottiene quando uno spettro continuo viene fatto attraversare gas freddo a bassa densità.
- Lo spettro di emissione viene emesso da un gas caldo a bassa pressione.
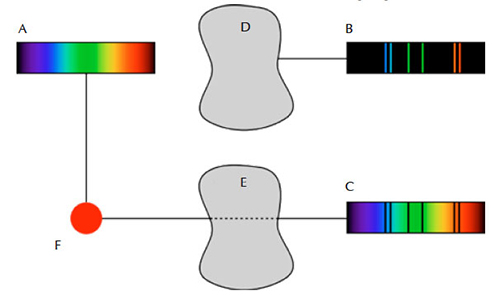
Immagine di Pubblico dominio; fonte: Wikimedia Commons
Kirchhoff non aveva trovato solo che un elemento chimico era responsabile per le linee spettrali nelle stesse posizioni sia dello spettro di emissione che in quello di assorbimento, ma aveva anche scoperto che il Sole conteneva sodio. Così per conoscere la composizione del Sole, o di ogni altra stella, abbiamo solamente bisogno di confrontare gli spettri di elementi noti con lo spettro della stella.
Ricavare lo spettro di differenti sorgenti luminose
Materiali
- Diverse sorgenti di luce (come ad esempio lampadine ad incandescenza, a fluorescenza, lampade per lampioni stradali e lampade al neon).
- Spettrometro – costruendolo con una scatola di cerealiw1 (vedere attività di classe box) o acquistando e assemblando iun kit di un mini-spettrometro (disponibile onlinew2).
- Gli spetri di emissione di diversi elementi – immagini adatte si possono trovare nei libri o scaricandole da internetw3.
Costruzione di uno spettrometro
Materiali
- Scatola di cereali
- Carta spessa
- CD
- Forbici
- Nastro isolante nero
Procedura
- In uno dei lati stretti della scatola, praticate un taglio orizzontale per formare una fenditura. Per effettuare un taglio che sia senza sbavature potreste usare il nastro isolante per accostare uno vicino all’altro, due pezzettini di carta spessa, lasciando un piccolo spazio tra loro per formare la fenditura. Lo spessore della linea è di 0,2 mm.
- Tagliare un CD in due metà utilizzando le forbici. Dal lato opposto di dove avete praticato la fenditura, praticate un altro taglio orizzontale. Estendete questo taglio oltre i bordi da entrambe i lati, in modo che quando farete scivolare il CD nella fenditura, inclinandolo di un angolo di 60° rispetto al fondo opposto della scatola.
- Praticare un foro in alto nella scatola, dal quale si può osservare il CD.
- Escludere la possibilità che della luce entri dalle fessure della scatola avendo cura di ricoprire le fessure con nastro adesivo nero.
Per ulteriori informazioni per la costruzione di questo spettrometro, cliccare qui.
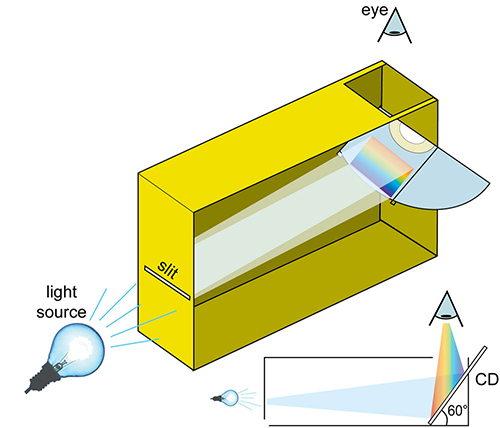
Immagine gentilmente concessa da Mark Tiele Westr
Una alternativa a questo spettrometro può essere il mini-spettrometro pieghevole, disponibile per l’acquisto onlinew2. Esso permette agli studenti di fotografare lo spettro osservato utilizzando uno smartphone.
Note per la sicurezza
Non guardare il Sole in modo diretto, nemmeno con uno spettrometro. Invece, puntate lo spettrometro verso il cielo per osservare uno spettro della luce solare diffusa.
Procedura
Confronto tra spettri
Domandate agli studenti di osservare attraverso lo spettrometro gli spettri delle varie sorgenti luminose. Questo dimostrerà a loro che non tutte le sorgenti luminose saranno le stesse, poiché i loro spettri non sono gli stessi.
Domande:
- Quale tipo di spettro è emesso da ogni sorgente luminosa?
- Che cosa vi dirà questo spettro sul tipo di sorgente luminosa utilizzata?
- Qual è la sorgente luminosa più utilizzata e perché?
Risposte:
Gli studenti osserveranno diversi spettri provenienti dalla fonte luminosa:
- Una lampadina ad incandescenza emette uno spettro continuo con tutti I colori presenti.
- Una lampada a scarica di gas normalmente contenente elio (He), neon (Ne), argo (Ar), kripton (Kr) e xenon (Xe) (figura 3).Ogni gas emette il proprio spettro di emissione.
- Le lampade stradali normalmente contengono sodio così emetteranno uno spettro del sodio.
- Lo spettro emesso da una lampadina LED dipende dal semiconduttore con il quale si è costruito il LED. Un LED blu crea uno spettro continuo con la parte blu dello spettro, più luminosa.
- Il Sole emette uno spettro continuo. Con uno spettrometro più sofisticato mostrerebbe le line di assorbimento che risulteranno scure determinate dagli elementi con i quali la luce passa attraverso l’atmosfera solare.
La differenza negli spettri indicano che queste fonti luminose, e i meccanismi che stanno dietro a queste formazioni, sono differenti, eccetto che per il Sole e le lampade a incandescenza. Spesso si usano le sorgenti di luce ad incandescenza perché hanno uno spettro continuo come quello del Sole.
Analisi dello spettro di emissione
Utilizzando diverse lampade a scarica di gas, domandate ai vostri studenti di individuare gli elementi presenti confrontando lo spettro delle lampade con quello delle immagini degli spettri di emissione di differenti elementi. Questo rappresenta la base della spettroscopia come metodologia delle analisi chimiche.
Note per la sicurezza
Una lampada a scarica di gas richiede un voltaggio alto, queste dovrebbero essere maneggiate dall’insegnante.

Immagine concessa gentilmente da Heinrich Pniok; fonte: Wikimedia Commons
Domande:

mini-spettrometro
pieghevole per ottenere lo
spettro di emissione dell’elio
Immagine concessa
gentilmente da Ole Ahlgren
- Le linee spettrali hanno tutte la stessa intensità?
- Qual è la relazione tra le linee spettrali e il colore della lampada?
- Come si utilizzano gli spettri per individuare i vari elementi chimici?
Risposte:
Alcune lunghezze d’onda sono più intense di altre, come succede in certe linee di emissione che sono più brillanti di altre. Questo è evidente nei colori delle lampade. Per esempio, la luce di una lampada al sodio è gialla perché emette principalmente luce presente nello spettro del giallo, comunque emette anche nella parte rossa e verde dello spettro. Poiché ogni elemento ha le sue specifiche lunghezze d’onda, potete utilizzare gli spettri per individuare gli elementi chimici in esse presenti.
Estensione dell’attività
Per ottenere dei risultati maggiormente dettagliati, si possono realizzare ulteriori attività sperimentali con uno spettrometro in grado di individuare lo spettro di assorbimento del Sole, con l’ausilio di un software associato ad un registratore di dati (data-logger). Le figure 4 e 5 sono state ricavate con lo spettrometro dell’Ocean Optics Red Tide, e il programma LoggerPro.
Gli spettri così ottenuti sono differenti da quelli ottenuti mediante un semplice spettrometro, e contengono molte più informazioni, comprese le lunghezze d’onda di ogni linea spettrale e lo loro relative intensità. Lo spettro del Sole può anche mostrare che la presenza di alcune linee di assorbimento non significa necessariamente che queste lunghezze d’onda siano completamente assente ma solo che sono meno intense di altre lunghezze d’onda.
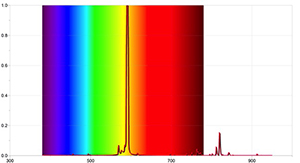
Immagine per gentile concessione di Oler Ahlgren
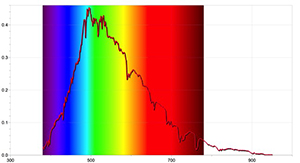
Immagine per gentile concessione di Ole Ahlgren

del mercurio con lo
spettrometro dell’Ocean
Optics Red Tide e il
programma del LoggerPro
Immagine per gentile
concessione Ole Ahlgren
Materiali
- Spettrometrow4 più sofisticato di quello utilizzato in precedenza
- Software per Data-logger (acquisitore-dati)w5
Procedura
Gli studenti potrebbero registrare lo spettro del Sole utilizzando uno spettrometro più sofisticato. Il programma di acquisizione dati (data-logger) fornirà le lunghezze d’onda delle righe di assorbimento che gli studenti sceglieranno. Le righe di assorbimento scelte dovranno essere le più prominenti. Per determinare gli elementi presenti, vi sono due scelte:
- Gli studenti confrontano ciascuna lunghezza d’onda con quelle derivanti da una tabella, come quella disponibile alla pagina dell’Osservatorio Ottico del SETIw6
- Gli studenti ricaveranno gli spettri di emissione di diversi elementi e quindi li confronteranno con le righe di lunghezza d’onda del Sole. Il numero di elementi che potranno essere utilizzati è limitato da quelli presenti nella lampada a scarica di gas. È possibile bruciare metalli e ottenere degli spettri di emissione, ma vi sarebbero delle righe di altri elementi. Per esempio, le righe più prominenti mostrate in figura 6 ottenute dalla combustione del magnesio sono dovute alla presenza di azoto.

Immagine per gentile concessione di Ole Ahlgren
Osservando gli spettri di differenti sorgenti luminose ed elementi chimici e confrontandoli con lo spettro del Sole, gli studenti imparano a determinare la composizione del Sole e di altre stelle.
References
- Ribeiro C (2015) Starlight inside a light bulb. Science in School 31: 37–42.
Web References
- w1 – per le istruzioni di come costruire il vostro spettroscopio con la scatola di cereali, vedi: Westra M (2007) A fresh look at light: build your own spectrometer. Science in School 4: 30-34.
- w2 – Potete ordinare on line il kit di montaggio mini-spettrometro pieghevole presso il vostro negozio Public Laboratory store.
- w3 – Spettro di emissione di vari elementi possono essere scaricati da Open Discovery Space.
- w4 – Alcuni spettrometri che ad esempio si potrebbero utilizzare per estendere questa esperienza si possono trovare qui.
- w5 – LoggerPro è un software all’avanguardia per l’acquisizione ed elaborazione dei dati per computer con sistemi operativi Windows e Mac.
- w6 – Le righe di Fraunhofer e le loro lunghezze d’onda si possono trovare nel sito all’osservatorio Columbus Optical SETI Observatory.
Resources
- Per una panoramica per gli utilizzi pratici della luce, si veda:
- Douglas P, Garley M (2010) Chimica e luce. Science in School 14: 63-68.
- Science on Stage è la piattaforma Europea degli insegnanti di scienze, tecnologia, ingegneria e matematica (STEM), che fu lanciata per la prima volta nel 1999 dall’EIROforum, l’editore di Science in School. Science on Stage raduna gli insegnanti di scienze di tutta Europa affinché si scambino idee per l’insegnamento e la buona pratica con l’entusiasmo tra colleghi provenienti da 25 paesi.
Institutions
Science on StageReview
All’interno di questo articolo, gli autorri descrivon brevemente come siano stati scoperti gli spettri e come si possano usare diffrenti tipi di spettri per identificare di cosa siano fatte le stelle.
Vengono altresì illustrati metodi per poter costruire in modo autonomo degli sprettografi ed come usarli per misurare gli spettri. Questa attività può generare risultati affascinanti utilizzando questi spettrometri.
Si possono porre le seguenti domande al fine di capire il grado di apprendimento degli argomenti:
- Come è arrivato Newton a scoprire lo spettro della luce?
- Quali colori sono compresi nello spettro della luce?
- Quali sono i colori con i quali inizia e termina lo spettro della luce?
- Descrivere le scoperte di Bunsen e Kirchhoff.
Gerd Vogt, Scuoal Secondaria Superiore per l’Ambiente e l’Economia (HLUW), Yspertal, Austria





