Una clase sobre la economía del hidrógeno Teach article
Traducido por Rafael Martínez-Oña. ¿Podría ser el hidrógeno la mejor alternativa a los combustibles fósiles? Este artículo muestra cómo funciona, de manera práctica, una economía del hidrógeno.
Mientras las existencias de combustibles fósiles se están agotando lentamente, la creciente población de nuestro planeta consume cada vez más y más energía. Ahora sabemos que el uso de combustibles tradicionales que contienen carbono ha contribuido significativamente a aumentar la contaminación del medio ambiente, lo que hace que el desarrollo de generación de energía respetuosa con el medio ambiente sea cada vez más importante.
Uno de los escenarios más plausibles para la producción de la llamada energía «verde» es el de la economía del hidrógeno. El hidrógeno tiene una densidad de energía por unidad de peso superior a la de los combustibles fósiles tradicionales y también libera menos emisiones de efecto invernadero. Cuando el hidrógeno se quema directamente o se oxida en pilas de combustible para obtener calor y electricidad, el único producto que se genera es agua.
Aunque algunas compañías han estado desarrollando nuevos motores basados en la combustión interna de hidrógeno, las pilas de combustible son los principales convertidores de energía en los que se basa el concepto de la economía del hidrógeno.
Las pilas de combustible se inventaron en la primera mitad del siglo 19, cuando el físico británico William Grove sugirió que si el agua pudiese dividirse mediante electricidad en hidrógeno y oxígeno, a continuación, la combinación de los dos elementos podría generar electricidad. Sin embargo, como los combustibles fósiles llegaron a ser dominantes, las pilas de combustible se quedaron en el camino.
En la década de 1960, la NASA utilizó pilas de combustible de hidrógeno alcalinas en sus vehículos espaciales Apolo y más tarde en los transbordadores espaciales para producir electricidad y agua. Ahora, la tecnología puede experimentar otro impulso.
La producción y el uso de pilas de combustible están todavía bastante limitados, debido principalmente a que la producción y almacenamiento del hidrógeno son muy caros, como lo son los catalizadores utilizados en las pilas de combustible más eficientes. Sin embargo, conforme mejore la tecnología y los combustibles fósiles se vuelvan más caros, se espera que las pilas de combustible puedan reemplazar las fuentes y convertidores de energía existentes.

electrodos del electrolizador
a un panel solar
Imagen cortesía de Mario Mitov
Demostración del principio
Para conocer cómo funcionan las pilas de combustible, hemos desarrollado una pila de combustible de bajo costo para su uso en el aula. El electrolizador y la pila combustible desarrollados se pueden utilizar como parte de un conjunto para demostrar cómo se puede generar y utilizar el hidrógeno.
Para desarrollar los modelos se siguieron los criterios siguientes:
- Los materiales deben ser accesibles y baratos;
- Toda la construcción debe ser relativamente sencilla para que, terceros desde fuera, puedan observar los fenómenos y los procesos;
- La construcción de los prototipos no debe presentar ningún riesgo;
A continuación se describen los materiales y los procedimientos necesarios para la construcción de un prototipo de electrolizador de agua y de una pila de combustible de hidrógeno para el aula.
Actividad para el aula

una pila de combustibles
Imagen cortesía de Mario Mitov
Materiales y reactivos
- Jeringas de plástico (50 ml)
- Barras de grafito o minas de lápiz
- Electrodos de carbono difundido y prensado en malla de níquel
- Tubos pequeños flexibles con válvulas
- Conexiones en T de vidrio
- Vasija de plástico (botella) para el electrolito
- Soporte de laboratorio con pinzas
- Hoja de aluminio o cobre
- Papel antigrasa
- Plato para altas temperaturas
- Recipientes de vidrio (vasos de 400 ml)
- Cables de cobre con conectores
- Taladro
- Pasta de silicona
- Fuente de alimentación de 6-12 V DC (panel solar o batería de 9 V)

Figura 3: Demostración de la
estequiometria de la
descomposición del agua
Imagen cortesía de Mario Mitov - Consumidor final (motor eléctrico de baja potencia con ventilador, LED)
- Juego de resistencias
- Dos multímetros o un voltímetro y un amperímetro
- 1 M H2SO4
- 2 M HNO3 (para el grabado)
- Solución de PdCl2 preparada para disolver 1 g de sal en 50 ml de 0,5 M HCl. Calentarla a 50 oC y diluirla en 100 ml con agua destilada.
- 1 M KOH o NaOH
- Guantes y gafas
Procedimientos
* Los pasos marcados con un asterisco, por motivos de seguridad, deben ser realizados por el profesor.
Construcción del electrolizador
- *Retirar los émbolos y agujas de las dos jeringas.
- *Retirar las juntas de goma de los émbolos y hacerles un agujero para insertar el electrodo de grafito en cada una de ellas.
- Introducir las minas de grafito en cada uno de los agujeros de las juntas de goma y montar las juntas en las jeringas.
- *Taladrar un agujero en el lateral de cada jeringa a 1 cm del fondo. El diámetro de los agujeros debe ser 1 mm más grande que el diámetro de los extremos del conector en T.
- Conectar un trozo de tubo de 1 cm de longitud en cada uno de extremos del conector en T.
- Conectar las jeringas con el conector en T.
- Conectar el contenedor del electrolito al extremo libre del conector en T con un trozo de tubo.
- Conectar los tubos flexibles al extremo de cada una de las jeringas donde se fija la aguja.
- *Verter 1M H2SO4 en el contenedor del electrolito hasta que el electrolito llene las dos jeringas.
- Conectar ambos electrodos mediante cables de cobre a la fuente de alimentación (figura 1).
Construcción de la pila de combustible
- *Retirar los émbolos y agujas de las dos jeringas.
- *Cortar dos trozos de los electrodos para cubrir completamente las bridas de las jeringas.
- *Colocar un trozo de papel de aluminio o de cobre sobre un plato resistente a temperaturas elevadas, poner encima papel antigrasa y, sobre éste, colocar los electrodos.
- *Presionar la brida de la jeringa sobre el electrodo – debido a la alta temperatura, el plástico se derretirá y el electrodo se quedará adherido a la jeringa.
- *Taladrar un agujero en la brida de la jeringa junto al electrodo.
- Atornillar un tornillo en el agujero.
- Pelar el aislante de un extremo del cable de cobre, arrollarlo sobre el tornillo y fijarlo con una tuerca.
- Aislar el tornillo con pasta de silicona.
- Repetir los pasos 3 a 8 para preparar el segundo electrodo.
- *Fijar la conexión de los electrodos sumergiéndolos en 2 M HNO3 durante 5 minutos y luego lavarlos con agua.
- *Verter la solución de PdCl2 en el vaso de 400 ml y sumergir los electrodos en ella durante 5 minutos. Debido a la reactividad de los metales, se depositará una capa catalítica delgada de paladio sobre los electrodos cuando los iones de paladio entren en contacto con la malla de carbono y níquel.
- *Verter 100 ml de NaOH 1 M (o KOH) en otro recipiente y colocar en él ambas jeringas con los electrodos sellados (figura 2).
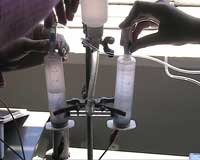
- Conectar las jeringas a los dos tubos finos fijados al electrolizador.
Después de recoger alguna cantidad de hidrógeno y oxígeno, detener la producción de gas y abrir las válvulas para permitir que los gases pasen a los electrodos de la pila de combustible (figura 4).
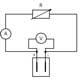
Luego, los estudiantes pueden medir los parámetros eléctricos de la pila de combustible utilizando el circuito descrito en la figura 5. La corriente, I, se calcula de acuerdo con la ley de Ohm:
I= V/R

válvulas para permitir que
los gases pasen a los
electrodos de la pila de
combustible; b) generación
de electricidad por la célula
de combustible
Imagen cortesía de Mario Mitov
En lugar de una resistencia, también se puede utilizar un diodo emisor de luz (LED) o un motor eléctrico de baja potencia.
Una ventaja importante de este sistema es que cada uno de los módulos básicos se puede sustituir por otros dispositivos. Por ejemplo, se puede utilizar un aerogenerador en lugar de un panel solar para generar la electricidad necesaria para alimentar el electrolizador de agua. O, en lugar de un electrolizador de agua como una fuente de hidrógeno gaseoso y de oxígeno, se puede generar el gas por reacción química (figura 6).
También se pueden desarrollar otros tipos de pilas de combustible utilizando combustible líquido (por ejemplo, etanol en lugar de hidrógeno).
Tanto el electrolizador como la pila de combustible, propuesta en el sistema de energía ecológica, podrían ser reemplazadas por nuestra célula DeMi que funciona según el principio de pilas de combustible reversiblesw1. Debido a que las células DeMi utilizan electrolitos salinos no peligrosos, éstas cumplen los requisitos de seguridad más fácilmente.
Los estudiantes de los diferentes cursos, con conocimientos de los fundamentos teóricos, son capaces de desarrollar prototipos de tecnologías avanzadas y sofisticadas (figura 7).
para probar una pila de
combustible
Imagen cortesía de Mario Mitov

generador de gas químico y
contendor de gas;
Imagen cortesía de Mario Mitov

electrolizador de agua, pilas
de combustible y
contenedores de gas
Imagen cortesía de Mario Mitov

hidrógeno y oxígeno,
recogido en el depósito de
gas, a la pila de combustible
Imagen cortesía de Mario Mitov
Una demonstración práctica
Al conectar el electrolizador y la pila de combustible a un panel solar, como se muestra en la figura 1, se puede demostrar cómo la energía generada en el panel solar puede ser almacenada en forma de hidrógeno y luego se convierte de nuevo en electricidad. La electricidad necesaria para alimentar la electrólisis del agua se puede generar iluminando con una luz artificial el panel solar, después de lo cual los gases desprendidos se recogen encima del electrolito en las partes separadas del electrolizador (jeringas). Es necesario que las válvulas cierren el paso de los gases que pasan desde el electrolizador a las pilas de combustible hasta que se requiera.
Las jeringas permiten mostrar que el volumen de gas en el ánodo es dos veces el volumen de gas en el cátodo: en dos moles de agua se producen 2 moles of hidrógeno y 1 mol of oxígeno (figura 3):
(-) 4 Н2О + 4 е–→ 2 Н2 + 4 ОН–
(+) 4 ОН– → 2 Н2О + О2 + 4 е–
Sumario 2 Н2О → 2 Н2 + О2
Web References
Resources
- Lex Solar proporciona kits con pilas de combustible y otras fuentes de energía para la escuela. Ver: www.lexsolar.de
- Este libro representa una introducción al tema de las pilas de combustible y la economía del hidrógeno:
- Cook B (2001) An Introduction to Fuel Cells and Hydrogen Technology. Vancouver, Canada: Heliocentris
- Para conocer más sobre el trabajo de Mario Mitov se puede leer
- Mitov M, Kondev I, Petrov Y, Bliznakov S, Popov A (2003) Fuel cells – Achievements and Perspectives. Khimiya 12: 455-466 (solo disponible en ruso)
- Mitov M, Petrov Y, Manev S (2005) Demonstrational Fuel Cells. Khimiya 14: 440-445 (solo disponible en ruso)
- Otro tipo de pila de combustible es la pila de combustible microbiana, que produce electricidad en lugar de cerveza. Para conocer cómo se utiliza este tipo de pila se puede leer en la clase el artículo
- Madden D (2010) La pila de combustible microbiano: electricidad de las levaduras. Science in School 14: 32-35.
Review
Este artículo describe una actividad práctica que explica el concepto de la economía del hidrógeno, que puede utilizarse para introducir las aplicaciones de las reacciones de oxidación-reducción. Aunque la actividad requiere materiales normalmente no incluidos en el equipamiento escolar estándar, éstos se pueden conseguir fácilmente.
A veces, la química se ve como algo que contribuye a contaminar y dañar al medio ambiente, pero este texto muestra que también puede tener un papel muy importante en la protección del medio ambiente.
Por último, este artículo también podría ser utilizado como un punto de partida para pensar acerca de las ventajas y desventajas de las fuentes de energía utilizadas actualmente por nuestra sociedad y la necesidad de encontrar alternativas a los recursos de combustibles fósiles.
Mireia Güell Serra, España





