Los neutrones en la lucha contra el VIH Understand article
Traducido por Elisa Inés López Schiaffino. Al pensar en los estudios de difracción, lo que más frecuentemente viene a la mente son los rayos X, pero los neutrones también pueden brindar información estructural importante y podrían ayudar en la lucha contra el VIH.
Cuando pensamos en cristalografía, la técnica que con frecuencia viene a nuestra mente es la difracción de los rayos X. No es extraño: en biología se han determinado más de 88 000 estructuras de proteínas, ácidos nucleicos, virus y conjuntos macromoleculares usando rayos X. Pero a medida que la cristalografía de neutrones ha ido mejorando, ésta se ha vuelto cada vez más útil en el diseño de medicamentos. Los investigadores del Institut Laue-Langevin (ILL) ubicado en Grenoble, Francia, recientemente han utilizado las instalaciones para comprender cómo un medicamento antirretrovírico combate el VIH.

Imagen cortesía del ILL
Desde los inicios de la cristalografía de rayos X de proteínas, la técnica se ha desarrollado y se ha extendido llamativamente. Los rayos X de alta intensidad que provienen de fuentes de radiación sincrotrónica permiten la recolección sistemática de datos a partir de pequeños cristales de micrómetros de ancho en cuestión de segundos (ver Cornuejols, 2009).
En cambio, la cristalografía neutrónica de moléculas biológicas grandes no ha sido tan desarrollada, y su aplicación ha sido mucho menos extensa. La razón principal es que el número de partículas por centímetro cuadrado por segundo (o ‘flujo’) emitido por las fuentes neutrónicas más intensas es muchos órdenes de magnitud menor que el flujo de las fuentes de rayos X.
Eso significa que, hasta hace poco, los cristalógrafos de neutrones necesitaban cristales grandes y meses de exposición para recolectar suficientes datos. Mejoras recientes permiten ahora recolectar datos suficientes con cristales más pequeños en solo unos días. Pero todavía lleva más tiempo que muchos experimentos de rayos X; entonces, ¿por qué usar neutrones? Una de las razones la constituye el átomo más pequeño del universo: el hidrógeno.
La importancia del hidrógeno
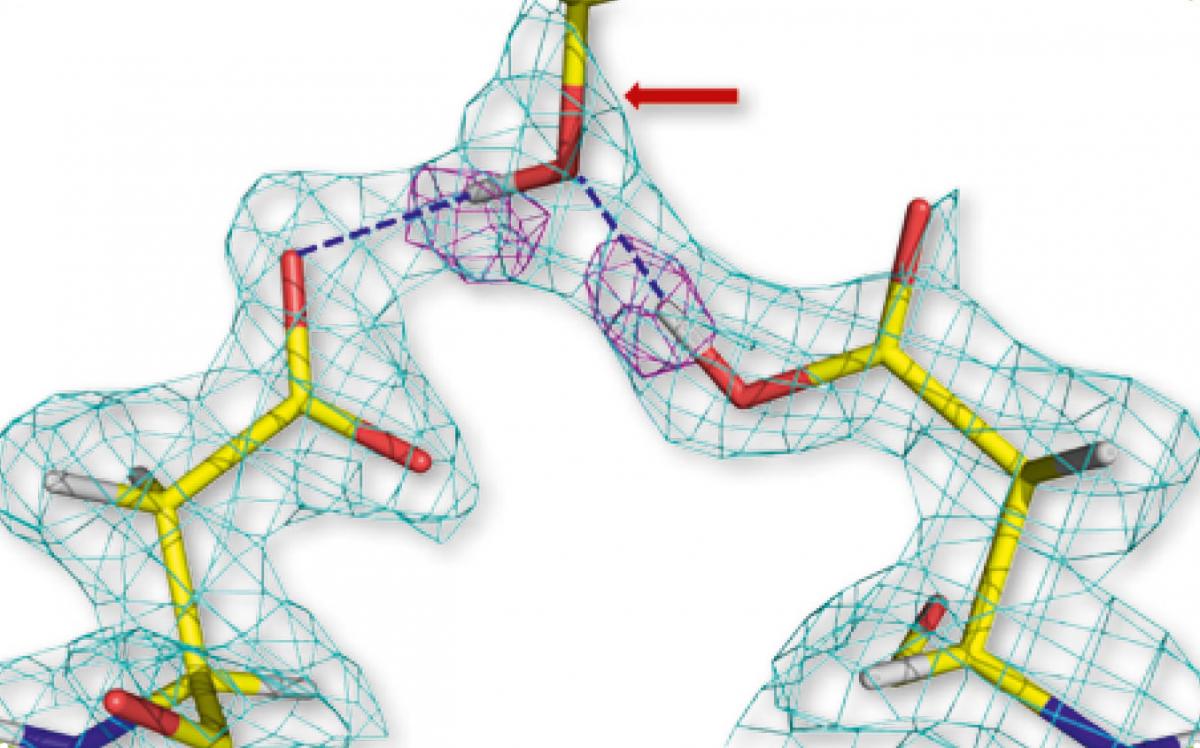
ácido aspártico de dos
moléculas de proteasa del
VIH-1 (izquierda y derecha),
unidas por enlace de
hidrógeno al grupo hidroxilo
del fármaco aprenavir
(centro). Las formas
geométricas de color rosa
representan los átomos de
hidrógeno
Imagen cortesía de Andrey
Kovalevsky
La mayoría de los fármacos funcionan al unirse a una enzima específica involucrada en una enfermedad, para que la función de esta enzima se vea inhibida. Por ello, muchos diseños de medicamentos modernos centran su atención en el análisis y la optimización de las interacciones entre el medicamento y su célula diana. La cristalografía de rayos X ha sido el método preferido para descifrar estos detalles estructurales, pero generalmente los rayos X no revelan la posición de los átomos de hidrógeno en una molécula. Estos átomos de hidrógeno a menudo juegan un rol crucial al intervenir en interacciones débiles pero importantes conocidas como enlaces de hidrógeno.
En cambio, los neutrones pueden localizar las posiciones de todos los átomos, incluyendo el de hidrógeno. Por eso constituyen una poderosa herramienta para analizar las interacciones de unión de los fármacos. Esto se demostró recientemente en un estudio de la unión de un fármaco antirretrovírico para el tratamiento del VIH (amprenavir) y su enzima diana, la proteasa del VIH-1. Esta enzima es una parte fundamental del ciclo de vida del VIH – rompe los polipéptidos virales y crea las proteínas necesarias para la maduración y la producción de nuevas partículas virales infecciosas.
Los científicos dispararon neutrones a un pequeño cristal de proteasa del VIH-1 unido a amprenavir (de 0,2 mm3 de tamaño) para recolectar datos a una resolución de solo 0,2 nanómetros. Estos datos permitieron que los investigadores localizaran los átomos de hidrógeno en el complejo fármaco-enzima, y, fundamentalmente, identificaran los átomos que participan en el enlace de hidrógeno entre el fármaco y la enzima.
Mejor resolución
Basándose en estudios de rayos X anteriores, los científicos habían especulado que varias interacciones por enlace de hidrógeno eran importantes en la unión entre la proteasa del VIH-1 y el amprenavir. Sin embargo, el estudio de neutrones reveló que, de hecho, existen solo dos fuertes enlaces de hidrógeno directos entre el fármaco y la enzima (figura 1). Este hallazgo les muestra a los diseñadores de medicamentos nuevas maneras de fortalecer estos enlaces mediante la modificación de la estructura molecular del fármaco. Se espera que estos cambios aumenten la efectividad del medicamento y reduzcan la dosis necesaria.
Por ejemplo, los diseñadores de medicamentos podrían fortalecer aún más los dos enlaces de hidrógeno agregando al fármaco un átomo reactivo como por ejemplo el flúor. O bien, podrían agregar más enlaces de hidrógeno directos, por ejemplo a través de la incorporación de grupos de átomos más grandes a la estructura que repele moléculas de agua que suelen encontrarse en el sitio de enlace.
La sensibilidad única del análisis de neutrones de los átomos de hidrógeno le brinda a la industria farmacéutica una nueva herramienta poderosa para el diseño de fármacos basada en la estructura. Aunque, dada su mayor resolución, el valor de la cristalografía macromolecular de rayos X permanecerá por muchos años, la utilización de ambas herramientas -rayos X y neutrones- revela con más claridad cómo interactúan las drogas con sus proteínas diana, y sin duda esto mejorará la eficacia de otros fármacos en el futuro.
Difracción de neutrones
Cuando se coloca un cristal en un haz de rayos X, los rayos X interactúan con las nubes de electrones de los átomos del cristal, lo que causa difracción en direcciones específicas. Al medir los ángulos y la intensidad de estos puntos de difracción –o ‘reflexiones´ – podemos elaborar una imagen tridimensional de la densidad de electrones dentro del cristal, con la que se puede determinar las posiciones medias de los átomos.
La difracción de los neutrones es conceptualmente similar, pero los neutrones son difractados por los núcelos atómicos de la red cristalina en vez de serlo por las nubes de electrones a su alrededor. Por ello, la fuerza de dispersión de los distintos tipos de átomos no guarda correlación con la configuración electrónica sino con las fuerzas nucleares, que incluso puede variar entre isótopos diferentes del mismo elemento.
El hidrógeno y el deuterio, debido a sus pequeñas nubes de electrones, no tienen gran efecto en los rayos X, pero tienen fuerzas de dispersión de neutrones similares a otros elementos comunes en las macromoléculas biológicas: carbono, nitrógeno, oxígeno y azufre. En consecuencia, el hidrógeno y el deuterio no son visibles usando dispersión por rayos X, pero sí son visibles utilizando dispersión de neutrones.
Esta visibilidad del hidrógeno y el deuterio permite determinar sus posiciones con resoluciones de alrededor de 1,5 y 2,5 Å (1,5 x 10-10 m y 2,5 x 10-10 m), respectivamente. Un átomo de hidrógeno mide alrededor de 1 Å. Esto hace que la cristalografía macromolecular de neutrones sea de importante utilidad para los estudios en los que las posiciones de los átomos de hidrógeno sean relevantes, como en estudios de los mecanismos enzimáticos o en estudios de unión de fármacos, donde los detalles de las interacciones de los enlaces del hidrógeno puedan contribuir al diseño de medicamentos.
Más información sobre el ILL
El Institut Laue-Langevin (ILL)w1 es un centro internacional de investigación con base en Grenoble, Francia. Ha sido el líder mundial en la ciencia y tecnología de dispersión de neutrones por más de 40 años, desde que comenzaron los experimentos en 1972. El ILL opera una de las fuentes de neutrones más poderosas del mundo, y alimenta haces de neutrones a un grupo de 40 instrumentos de alto rendimiento que son constantemente actualizados. Cada año 1200 investigadores de más de 40 países visitan el ILL para realizar investigaciones sobre la física de materiales condensados, la química, la biología, la física nuclear y la ciencia de los materiales.
El ILL es miembro de EIROforumw2, el editor de Science in School. Consulte la lista de los artículos relacionados con el ILL de Science in School.
References
- Cornuejols D (2009) Biological crystals: at the interface between physics, chemistry and biology. Science in School 11: 70–76.
Web References
- w1 – Conozca más sobre el ILL.
- w2 – EIRO forum es una colaboración de ocho de las organizaciones de investigación científica intergubernamentales más grandes de Europa. Combina los recursos, los establecimientos y las experiencias de sus organizaciones miembro para que la ciencia europea alcance su pleno potencial. Como parte de sus actividades de educación y divulgación, EIROforum publica Science in School.
Resources
- La difracción de neutrones también ha ayudado a investigar cómo el anticongelante en la sangre de los peces del Ártico los mantiene vivos en temperaturas bajo cero. Puede leer sobre esto en:
- Blakely M, Hayes E (2011) Neutrones y anticongelante: investigando los peces del Ártico. Science in School 20: 18–22.
Institutions
Review
Este artículo es interesante y demuestra cómo se puede usar los avances en las diferentes ramas de la ciencia, en este caso la difracción de neutrones, para desarrollar nuevos medicamentos para el beneficio de la humanidad.
Este artículo puede ser útil como lectura preparatoria para docentes y como complemento para la enseñanza de ciencia con aplicaciones de la vida real. También puede ser usado en actividades de comprensión o discusión, especialmente con estudiantes mayores. El tipo de preguntas depende de lo que los docentes quieran enseñar o resaltar. Por ejemplo, ¿cuál es la ventaja de usar neutrones en vez de rayos X?
Paul Xuereb, Malta





