Supporting materials
Limoneno Hoja de información (PDF)
Actividades complementarias (PDF)
Download
Download this article as a PDF

Esta actividad se presentó en el Festival Science on Stage en el 2022 ![]()
Cuando la vida te da limones: usa el limoneno para explorar propiedades moleculares con tus alumnos y demostrar el método científico en acción.

Las actividades en este artículo permiten a los alumnos investigar propiedades moleculares simples, a través de un compuesto que es fácilmente accesible: el limoneno. Estas actividades se desarrollaron gracias a grupos de alumnos italianos y españoles, en un proyecto conjunto que consistió en tareas por escrito, cuestionarios y videos.
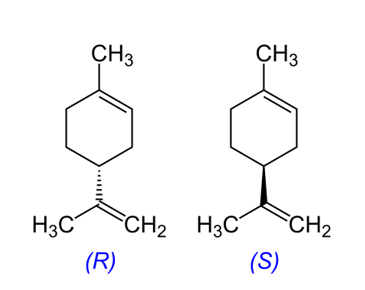
Gracias a la aplicación del método científico, los alumnos desarrollan la habilidad de observar un fenómeno, formular una hipótesis, buscar materiales adecuados para crear un experimento, recolectar datos para análisis y llegar a conclusiones que comparten con otros. El enfoque aquí es en una molécula simple, (R)-(+)-4- y (S)-(–)-4-isopropenil-1-metil-1-ciclohexano (los dos enantiómeros del limoneno), un compuesto que es seguro, fácil de encontrar y de interés industrial en el mundo real.
El limoneno (4-isopropenil-1-metilciclohexano) es un monoterpeno cíclico quiral, cuya fórmula molecular es C10H16.[1–3] Este compuesto quiral existe en dos formas isoméricas, las cuales son estereoisómeros; es decir, son moléculas con la misma estructura pero con orientaciones diferentes de los mismos átomos en el espacio. Las dos formas del limoneno difieren solamente en la configuración de los grupos que rodean a un solo átomo de carbono. Ambas formas son imágenes especulares (=enantiómeros) entre sí y solo se pueden convertir entre sí mediante el rompimiento y la formación de enlaces covalentes.
Fórmula molecular: C10H16
Peso molecular: 136.23
Sinónimos:
D-Limoneno, (R)-(+)-Limoneno
L-Limoneno, (S)- (−)-Limoneno
El D-Limoneno es uno de los compuestos principales en el aceite de las cáscaras de los cítricos, el cual también contiene limonoides cítricos. [4] El L-limoneno, que es menos común, se encuentra en hierbas como la alcaravea. El limoneno industrial proviene de la cáscara de frutos cítricos que se obtiene a partir de los desechos del procesamiento de frutas para la producción de zumos. [5] Por esta razón, se produce como el enantiómero R (D-limoneno). Se utiliza como un compuesto en fragancias y para desengrasar.

Como todos los enantiómeros, las dos formas son indistinguibles en la mayoría de los análisis químicos o físicos. Sin embargo, rotan el plano de luz polarizada en direcciones opuestas. Por lo tanto, es posible distinguirlos por medio de un polarímetro.
Además, se distinguen fácilmente desde el punto de vista biológico. El D-limoneno (la forma R) tiene un olor a cítrico dulce, mientras que la forma L tiene un olor más fuerte a resina o similar a la trementina. Nuestra nariz es muy sensible y puede distinguir estos compuestos que son muy similares, porque los receptores olfativos en la nariz tienen sitios moleculares que interactúan específicamente con enantiómeros diferentes. [6]
Experimentos:
Actividades complementarias: las propiedades antibacterianas y antigérmenes del limoneno (2 h)
El limoneno es un terpeno volátil que, cuando está concentrado, no se debe ingerir o entrar en contacto con los ojos porque es un irritante. Si entra en contacto con la piel se debe enjuagar inmediatamente. A diferencia de la cáscara de naranja, el contenido de limoneno en la resina y en la trementina no llega a concentraciones altas.
En la primera actividad, explicaremos la quiralidad por medio del (R)- y (S)-limoneno. Esta actividad dura alrededor de 60 min.
Construye el limoneno con los modelos de barras y esferas e identifica el C*.
En el siguiente paso, los estudiantes investigarán la quiralidad del (R)- y (S)- limoneno y ver cómo este pequeño cambio estructural tiene consecuencias en el mundo real. Esta actividad dura alrededor de 60 min.

El ángulo de rotación específico para reconocer cada uno de los enantiómeros es +/− 123°, pero, en realidad, es suficiente con observar que el enantiómero R se extingue al rotar el analizador a la derecha, mientras que, para el enantiómero S, la rotación es en la dirección opuesta con el mismo ángulo.
El olor a cítrico también se debe a las moléculas del limonoide cítrico. Hemos añadido referencias y una actividad teórica para entender la diferencia entre estas moléculas y estudiar trayectorias metabólicas en plantas.
La percepción de que el olor del (R)-limoneno es diferente al del (S)-limoneno es común, pero no universal. Los alumnos podrían diseñar un experimento para probar esto. Por ejemplo, para determinar el porcentaje de la población en un grupo de muestra que pueda distinguir ambos olores.
En el paso siguiente, los alumnos investigarán el efecto del limoneno en diferentes polímeros. Esta actividad debe tomar entre 1 y 2 horas. Todos los pasos los deben ejecutar los estudiantes. Son muchas pruebas, por lo que si es necesario, los alumnos podrán trabajar en grupos para ahorrar tiempo/material.

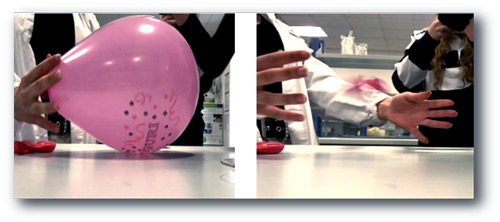

El material de látex, que está hecho de 30-40% de poli isopreno reticulado, reacciona con el limoneno y se ‘abre’ un agujero alrededor de la gota o el punto de contacto. Esto se debe a que las moléculas de limoneno (monoterpenos) son lo suficientemente pequeñas para pasar a través de las cadenas de poli isopreno y separarlas, y así debilitar la reticulación química. Esto es suficiente para disturbar la muestra y reventar el globo lleno de gas. La reacción es proporcional a la concentración de limoneno y al espesor del hule, pero no hay diferencia entre (R)- y (S)-limoneno.
En esta actividad, investigaremos las propiedades químicas del limoneno, y dura alrededor de 30 min.

El limoneno es soluble en aceite y se mezcla con este de manera natural; por lo tanto, se deduce que es un soluto no polar que se disuelve en un solvente no polar.
El limoneno es insoluble en agua y no se mezcla con esta: el limoneno es una molécula no polar que no se disuelve en agua, una molécula polar.
La polaridad de una molécula depende de las especies químicas que la componen, de la diferencia en la electronegatividad presente en los enlaces covalentes, y del hecho de que el centro de las fuerzas electroestáticas positivas no coincide con el de las negativas.
El limoneno es un hidrocarbono que consiste en átomos de carbono y de hidrógeno. Es un monoterpeno, un derivado del isopreno con una cadena cerrada, en donde las únicas áreas con carga parcial negativa débil son los dobles enlaces. Estas cargas son muy débiles para producir cualquier interacción con las moléculas de agua.
[1] Erasto P, Viljoen AM (2008) Limonene – a review: biosynthetic, ecological and pharmacological relevance. Natural Product Communications 3: 1193–1202. doi: 10.1177/1934578X0800300728
[2] Perveen S (2018) Introductory Chapter. In Perveen S, Al-Taweel A (eds) Terpenes and Terpenoids pp 1–12. IntechOpen. ISBN: 978-1-78984-777-2
[3] Chemical information for limonene and a virtual 3D model: https://pubchem.ncbi.nlm.nih.gov/compound/Limonene#section=3D-Conformer
[4] Gualdani R et al. (2016) The chemistry and pharmacology of citrus limonoids. Molecules 21: 1530. doi: 10.3390/molecules21111530
[5] Jongedijk E et al. (2016) Biotechnological production of limonene in microorganisms. Applied Microbiology and Biotechnology 100: 2927–2938. doi: 10.1007/s00253-016-7337-7
[6] Malnic B, Godfrey PA, Buck LB (2004) The human olfactory receptor gene family. PNAS 101: 2584–2589. doi: 10.1073/pnas.0307882100. This article has a correction.
Limoneno Hoja de información (PDF)
Actividades complementarias (PDF)
Download this article as a PDF