Detección de azúcar: un problema diario para diabéticos Teach article
Traducido por Jakob Suckale. Fred Engelbrecht y Thomas Wendt del Laboratorio de Enseñanza ExploHeidelberg describen algunos experimentos sobre la detección de azúcar para mostrar los problemas a los que se enfrentan los diabéticos cada día.
Diabetes, una enfermedad de la civilización moderna
El monosacárido glucosa es la fuente más importante de energía para los organismos eucariota y es usada por las células para la respiración aeróbica y anaeróbica. Además sirve como precursor en la producción de proteínas y en el metabolismo de lípidos. Por eso, es una molécula central en varias rutas metabólicas y su concentración en la sangre debe estar estrictamente regulada por insulina y glucagón.
Diabetes mellitus (o mas sencillamente diabetes) es un síndrome caracterizado por un metabolismo de glucosa desregulado y por niveles elevados de glucosa en sangre (hiperglucemia). Esto es causado por niveles bajos de la hormona insulina, o por una resistencia anormal a los efectos de la insulina junto con niveles de secreción de insulina demasiado bajos para compensar la resistencia.
Hay dos tipos principales de diabetes: tipo 1 y tipo 2. A pesar que tienen causas distintas, los pacientes con cualquiera de los dos no son capaces de producir suficientemente insulina en las células beta del páncreas para prevenir hiperglucemia.
La diabetes tipo 1 representa el 10% de todos los casos de diabetes en Europa y esta caracterizada por la pérdida de las células beta del páncreas, normalmente por destrucción autoinmune. Puesto que la diabetes tipo 1 afecta frecuentemente a pacientes jóvenes, también se llama diabetes juvenil. Es la forma más severa de la enfermedad porque no hay tratamiento. En su lugar, los pacientes tienen que ajustar su estilo de vida, por ejemplo cambiando su dieta, haciendo ejercicios regularmente y midiendo sus niveles de azúcar en la sangre. Además, inyecciones subcutáneas o la administración continua de insulina a través de una bomba conectada a la circulación sanguínea son necesarios para evitar el coma y la muerte.
La diabetes tipo 2 es causada por resistencia a la insulina o por la reducción de la sensibilidad a insulina en los tejidos diana junto con insuficiente secreción de insulina. La respuesta reducida de los tejidos del cuerpo a insulina es causada seguramente por los receptores de insulina en la membrana de las células. Eso hace que el cuerpo necesite niveles de insulina atípicamente altos para mantener niveles normales de glucosa en la sangre y la diabetes se desarrolla cuando las células beta no pueden satisfacer esta demanda. La diabetes tipo 2, también conocida como diabetes adulta, suele aparecer después de los 30 años. En la mayoría de los casos esta conectada con obesidad y falta de ejercicio físico. Cambios en el estilo de vida pueden mejorar la condición e incluso curarla. Ver Dugi (2006) para más detalles.
La gente afectada por cualquiera de los tipos de diabetes debe aprender a vivir con los síntomas de la enfermedad. Estos incluyen micción frecuente, sed aumentada, y por eso también mayor ingestión de fluidos. Debido a que muchos niños sufren diabetes, es esencial enseñar a los estudiantes como funciona la enfermedad desde una etapa temprana. Los pacientes con diabetes deben aprender a minimizar los síntomas o incluso a evitar la enfermedad cambiando la dieta y haciendo suficientemente deporte. Los niños sanos deben entender las necesidades de sus compañeros afectados.
Por eso, hemos coleccionado algunos experimentos para habilitar a los estudiantes a detectar carbohidratos. Una serie de experimentos determina si una solución contiene almidón, proteínas o azucares como glucosa, lactosa o sucrosa. Después de identificar azucares, otra serie de experimentos determina si la muestra contiene lactosa o glucosa usando una reacción enzimática. El principio de los experimentos es el mismo que las pruebas para determinar glucosa en sangre para la diagnosis de diabetes o para medir niveles de glucosa y/o lactosa, por ejemplo en frutas, zumos, leche y productos de leche. Así, estos experimentos dan una idea a los estudiantes sobre como los diabéticos miden su nivel de azúcar.
Experimento 1: Detección de azúcar, almidón y proteína
Los estudiantes reciben cinco muestras, rotuladas A-E, que contienen almidón, proteína (BSA), el monosacárido glucosa o uno de los disacáridos lactosa o sacarosa. Todas las disoluciones están a una concentración del 0,1% en agua. Se podrían probar también muestras de bebidas sin color que contienen glucosa como Powerade®-Limón. Usando distintos reactivos, los estudiantes pueden determinar cuales de las cinco muestras contienen azúcar, almidón o proteína.
Para una clase de 30 estudiantes trabajando en pares se necesitan los siguientes reactivos:
- Disolución de Fehling recién preparada mediante la mezcla de volúmenes iguales de la disolución I de Fehling (azul claro; 7g de CuSO4·5H2O disuelto en 100ml de agua destilada) e la disolución II de Fehling incolora (35g C4H4KNaO6·4H2O y 10g de NaOH disuelta en agua destilada). Mezcla las disoluciones poco antes de usarlas.
- Disolución de Lugol preparada mediante la disolución de 1g de yodo (I2) y 2g de yoduro de potasio (KI) en 50ml de agua destilada.
- El colorante Coomassie Brilliant Blue para el ensayo de Bradford está disponible comercialmente, por ejemplo de Bioradw1.
a) Detección de un azúcar reductor (ensayo de Fehling)
- Pipetear una muestra de 1ml de las soluciones A-E en 5 tubos distintos y calentar a 60 °C en un baño María durante 2 minutos.
- Añadir 16 μl de disolución de Fehling azul oscuro recién preparada, a los tubos e incubar a 60 °C durante otros 10 minutos o hasta que la reacción de color se observe y se formen precipitados.
Las disoluciones que contienen azucares reductores como fructosa, glucosa o lactosa deben cambiar a color rojo y formar un precipitado rojo. Los iones disueltos de cobre (II) se reducen a óxido de cobre (I), que es insoluble. No deben producirse cambios de color con sacarosa y almidón. La disolución de proteínas debe cambiar a un violeta pálido.
b) Detección de almidón (disolución de Lugol)
- Pipetear 500µl de las muestras A-E a cinco nuevos tubos de reacción.
- Añadir 50µl de disolución de Lugol a cada tubo y observar el cambio de color.
La disolución de Lugol es un indicador de almidón. El reactivo coloreará almidón al interactuar con la hélice del polisacárido, produciendo así un color azul oscuro. No reaccionará con monosacáridos (glucosa) o disacáridos (lactosa o sacarosa).
c) Detección de proteína
El ensayo de proteínas esta basado en el método de Bradford que mide el cambio de color del azul de Coomassie cuando se une a proteínas.
- Pipetear 20 µl de las muestras A-E a cinco nuevos tubos de reacción. Luego, añadir 800µl de agua desionizada y 200µl de azul de Coomassie (reactivo de Bradford).
- Mezclar los reactivos, dejar la reacción durante 5min y observar el cambio de color.
En presencia de proteínas, la disolución cambiará a azul (se puede medir con un fotómetro a 595 nm). Las muestras con azucares o almidón no cambiarán de color.
Aviso de seguridad:
La disolución de Biorad para el ensayo de proteínas contiene metanol y ácido fosfórico y debe ser usada con precaución.

Imágenes cortesía de Thomas Wendt
| Reacción de Fehling | Reacción de Lugol | Ensayo de proteínas | Compuesto | |
|---|---|---|---|---|
| Disolución A | Precipitado rojo | Marrón | Marrón | Azúcar reductor |
| Disolución B | Disolución azul | Dark blue | Marrón | Almidón |
| Disolución C | Precipitado rojo | Marrón | Marrón | Azúcar reductor |
| Disolución D | Precipitado rojo | Marrón | Marrón | Proteína |
| Disolución E | Disolución azul | Marrón | Marrón | Sacarosa |
Resultados e interpretación
La disolución B resulta en una reacción positiva con la solución de Lugol demostrando que contiene almidón. La disolución D da un resultado positivo en el ensayo de Bradford, demostrando que es una disolución de proteínas. La disolución A y C producen un precipitado rojo durante la reacción de Fehling y pueden entonces ser identificadas como disoluciones de los azucares reductores, glucosa y lactosa (aunque en este punto no se puede decir de cual de los dos se trata). La disolución E que queda no demuestra ninguna reacción en los ensayos y debe ser entonces la disolución de sacarosa.
Experimento 2: Detección enzimática de azúcar
En este segundo experimento, las dos disoluciones A y C que quedan son re-analizadas pare ver cual contiene lactosa y cual glucosa. Para este experimento usamos el kit EnzyPlus EZS 962+ lactosa/D-glucosa que se puede comprar de BioControlw2. El método es parecido al típicamente usado por pacientes de diabetes para medir sus niveles de glucemia. El protocolo estándar para ese producto se ha modificado y reducido en tamaño para ampliar los números de experimentos que se pueden hacer con los reactivos. Un kit contiene suficientemente material para 20 parejas de estudiantes.
El principio del test es el siguiente (ver figuras a bajo):
- El disacárido lactosa es hidrolizado por la enzima β-galactosidasa a D-galactosa y D-glucosa (Paso 1 abajo).
- En presencia de ATP, D-glucosa es específicamente fosforilada por hexoquinasa a glucosa-6-fosfato; simultáneamente se forma adenosina-5′-difosfato (ADP) (Paso 2).
- Glucosa-6-fosfato es oxidada por la glucosa-6-fosfato deshidrogenasa a gluconato-6-fosfato.
- Durante la reacción, NADP+ es reducido a NADPH. La cantidad de NADPH creado en esa reacción es estequiométrico a la cantidad de lactosa y puede ser medido fotométricamente por el aumento de absorción a 340 nm.
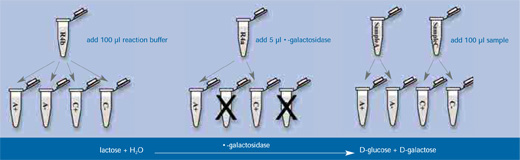
Imagen cortesía de Thomas Wendt
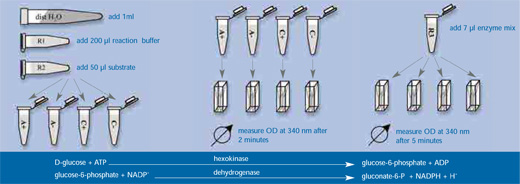
Imagen cortesía de Thomas Wendt
Para efectuar la reacción:
- Tomar cuatro tubos de 1,5ml y rotularlos A+, A-, C+ y C-. Añadir 100µl del tampón R4b (tampón de fosfato, pH 6,6) a cada tubo y 5µl de disolución R4a de β-galactosidasa a los tubos A+ y C+ (pero no a A- y C-).
- Añadir 100µl de disolución A a tubos A+ y A- y 100µl de disolución C a los tubos C+ y C-.
Nota: En los siguientes pasos del experimento, los cuatro tubos se tratan de manera igual.
- Dejar las muestras por 30 min a 37 °C en un baño María mientras ocurre la hidrólisis.
- Después de la incubación, añadir 1ml de agua destilada, 200 µl de tampón R1 y 50 µl de reactivo R2 (contienen ATP y NADP, respectivamente) a los cuatro tubos de reacción y mezclar bien.
- Trasferir 1ml de cada mezcla de reacción a distintas cubetas fotométricas y medir la densidad óptica a 340 nm (OD340) después de 2 min.
- A cada cubeta, añadir 7 µl de mezcla de enzima R3 que contiene la hexoquinasa y la glucosa-6-fosfato-deshidrogenasa, incubar 5 min más y medir la absorción a 340 nm otra vez.
| Primera medida (OD340) | Segunda medida (OD340) | Resultado | |
|---|---|---|---|
| Muestra A+ | 0.09 | 2.43 | Glucose |
| Muestra A- | 0.09 | 2.37 | Glucose |
| Muestra C+ | 0.10 | 1.43 | Lactose |
| Muestra C- | 0.09 | 0.10 | Lactose |
Resultados e interpretación
Las cuatro muestras deben dar una absorción baja en la primera medida, indicando la ausencia de NADPH. La segunda medida (después de añadir las enzimas) debe permitir distinguir entre las disoluciones A y C. Puesto que la disolución A da un resultado positivo independientemente de que se haya añadido β-galactosidasa, se puede deducir que contiene glucosa. Al contrario, un cambio de absorción de la disolución C debe medirse solo en presencia de β-galactosidasa (C+), indicando que contiene lactosa.
Durante las prácticas, los participantes reciben información básica sobre diabetes y sobre los problemas con los que se enfrentan los pacientes. Para medir su glucemia, los pacientes usan un test “strip glucose monitoring system” que funciona como una caja negra, pero que está basado en el principio del Experimento 2. Realizar un experimento así puede aumentar la conciencia sobre diabetes y cómo se puede sobrevivir la enfermedad o prevenirla a través de cambios de estilo de vida.
Los experimentos descritos aquí se pueden efectuar sin riesgo en laboratorios escolares porque los reactivos no son materiales peligrosos en el sentido de la Regulación de Substancias Peligrosas (Regulación de la CE 67/548/EEC). El nivel de azida de sodio, el conservante en los reactivos, es bajo los niveles más bajos de toxicidad para una preparación según la Directiva 1999/45/EC.
ExploHeidelberg
La ExploHeidelbergw3 es un centro de educación informal e interacción con la ciencia. Esta formado por tres partes distintas: una exhibición interactiva, una sala de medios de comunicación y un laboratorio para enseñar biotecnología.
En la exposición interactiva, alrededor de 50 muestras retan a los visitantes a sentir fenómenos ópticos, acústicos y mecánicos. El concepto pedagógico y el diseño de la exposición interactiva han sido desarrollados en colaboración con la Universidad de Educación de Heidelbergw4. Profesores adjuntos y miembros del departamento de física participan como asistentes de exposición diseñando experimentos y desarrollando cursos, educación de profesores y proyectos de investigación.
El laboratorio de enseñanza ofrece a los estudiantes de primaria y secundaria la oportunidad de hacer experimentos biotecnológicos en prácticas de un día que no serían posibles en el aula.
La sala de medios de comunicación complementa el centro de educación con 12 ordenadores, la posibilidad de webcast e imagen.
La exposición interactiva y la sala de medios están abiertos al publico y se enfocan en interesar al visitante en las ciencias naturales. El laboratorio de enseñanza ofrece cursos especializados que posibilitan una introducción a la biotecnología moderna para estudiantes de escuela y universidad, profesores y profesores adjuntos. Los participantes pueden elegir entre cursos de un día sobre DNA y proteínas o cursos especializados de una semana sobre técnicas exigentes que normalmente se enseñan solo en la universidad.
References
- Dugi K (2006) Diabetes mellitus. Science in School 1. www.scienceinschool.org/2006/issue1/diabetes/spanish
Web References
- w1 – Biorad: www.bio-rad.com
- w2 – BioControl: www.rapidmethods.com
- w3 – ExploHeidelberg: www.explo-heidelberg.de
- w4 – Universidad de Educación Heidelberg: www.ph-heidelberg.de
Review
En ese artículo, Fred Engelbrecht y Thomas Wendt tratan el importante tema de la diabetes y proponen dos experimentos para dar una idea sobre los componentes de comida y de la ciencia tras las pruebas de glucosa usadas por diabéticos.
El estilo del texto, aún comprensible y apropiado, es más fácil en la primera parte sobre diabetes. Los experimentos son un poco más desafiantes y dan la oportunidad a los profesores de dar distintas secciones a distintos niveles de secundaria.
El artículo se puede usar en clases de biología, química, y educación de la salud con la posibilidad de un enfoque interdisciplinario conectando aspectos bioquímicos, biológicos y sanitarios de la diabetes. Dada la extensión de la enfermedad, el texto puede ser útil como un punto de salida para promover la ciudadanía activa y la inclusión social de estudiantes diabéticos.
El artículo se podría usar para tratar temas como los carbohidratos y las proteínas, el metabolismo (bioquímica), el sistema digestivo (biología), la comida y la salud (educación de salud) y como entrenamiento de laboratorio (química).
La primera parte se puede usar para comprobar la comprensión sobre diabetes; la segunda parte para comprensión de temas técnicos. Preguntas modelo incluyen:
Cual de las siguientes características no forma parte de la diabetes mellitus?
a) Niveles altos de glucosa en la sangre
b) Producción insuficiente de insulina o resistencia a sus efectos
c) Bajos niveles de glucosa en la sangre
d) Micción frecuente y sed aumentada.
Los datos mostrados en la Tabla 2 indican que:
a) La glucosa necesita β-galactosidasa para producir NADPH
b) La lactosa necesita β-galactosidasa para producir NADPH
c) La lactosa no necesita β-galactosidasa para producir NADPH
d) La glucosa necesita glucosa-6-fosfato deshidrogenasa para producir NADP+.
Giulia Realdon, Italia





