Supporting materials
Dióxido de carbono – Información básica (Word)
Dióxido de carbono – Información básica (Pdf)
Historias del dióxido de carbono (Word)
Historias del dióxido de carbono (Pdf)
Download
Download this article as a PDF

Traducido por Ramon Trujillo Puig. Marlene Rau presenta algunas actividades efervescentes y divertidas con el dióxido de carbono, desarrollado por Chemol y Science on the Shelves.

El dióxido de carbono (CO2) no es únicamente uno de los gases invernadero más importantes, se encuentra en todo nuestro alrededor: en el aire que respiramos (0,0388 vol. %); en el aire que exhalamos (4 vol. %); en bebidas gaseosas; en bizcochos, que suben gracias al CO2 producido por la levadura artificial; y cuando se queman substancias orgánicas como la parafina, el papel, la madera o el petróleo. En forma líquida se usa en extintores de fuego y como refrigerante en la industria alimentaria (por ejemplo para guardar y transportar helados).
A altas concentraciones, el CO2 puede ser peligroso para los humanos y otros animales, pero es también una fuente de vida: durante la fotosíntesis, las plantas utilizan CO2 y luz para producir azúcar, almidón, grasas y proteínas, así como también el oxígeno que necesitamos para sobrevivir.
Las siguientes actividades educativas de Chemolw1 y Science on the Shelvesw2 (véase el recuadro) introduce este importante gas a los escolares de primaria. Para apoyar las actividades se dispone de más información sobre la química, importancia fisiológica, detección y ocurrencia de CO2 en la sección de recursosw3.

Nota: las cantidades de dióxido de carbono producido en estas actividades no son lo suficientemente altas como para ser peligroso.
Cuando se añade agua a una pastilla efervescente o a levadura artificial, se forman burbujas: se produce un gas. Este gas puede utilizarse para inflar un globo sin tener que soplar uno mismo. ¿De qué tipo de gas se trata? Recojámoslo y analicémoslo.
Materiales

Los seis primeros pasos son comunes a ambas actividades – luego tienes dos opciones de cómo proseguir.
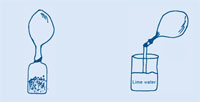
Cuando el globo ha dejado de inflarse, presiona el cuello del globo y retuércelo de manera que el gas no pueda escaparse, y quitas el globo de la botella.
Si el agua de cal te alcanza a los ojos, lávalos inmediatamente con agua. Véase también la nota general de seguridad.
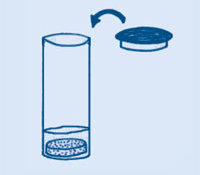
La prueba para detectar CO2 fue desarrollada por el químico Joseph Black (1728 – 1799). Tanto el cemento como el mortero contienen hidróxido cálcico (Ca(OH)2). Cuando el CO2 se añade al Ca(OH)2 acuoso, se forman pequeñísimas partículas de carbonato cálcico (CaCO3) esto es lo que provoca la turbidez del agua de cal.
¿De dónde viene nuestro CO2? Tanto la levadura artificial como las pastillas efervescentes contienen bicarbonato sódico (NaHCO3) y un ácido sólido (como por ejemplo cristales de ácido cítrico o fosfato monocálcico). En contacto con el agua, el bicarbonato sódico y el ácido reaccionan entre sí, formando en última instancia agua y CO2. Este gas es el responsable de las burbujas que se forman cuando una pastilla efervescente se disuelve; y también lo es de que el bizcocho suba.
La velita debe dejar de quemar porque el gas (CO2) ahoga la llama.
De nuevo, la llama se apaga, mostrando que fuimos capaces de verter el gas desde un vaso de precipitados a otro, como si se tratara de un líquido. Esto demuestra que el CO2 es más pesado que el aire.
Chemolw1 es un proyecto de la Universidad de Oldenburg, Alemania, para acercar la química a los niños de la escuela primaria. El equipo, que incluye maestros en formación y es dirigido por la Dra. Julia Michaelis, ofrece talleres para niños sobre el fuego, la tierra, el aire y el agua, así como la formación para maestros de enseñanza primaria.
Otras actividades sobre el dióxido de carbono de Chemol incluyen construir un extintor de fuego basado en CO2, experimentar con bebidas carbonatadas, medir cuanto gas es producido por una pastilla efervescente y probar el efecto de la temperatura en la solubilidad del CO2 en agua. Los detalles pueden encontrarse en la página web de Chemolw1.
Science on the Shelves es una página webw2 que proporciona instrucciones para una amplia gama de experimentos simples que utilizan alimentos y otros productos del supermercado, indicado para niños de 6 a 11 años, sus maestros y familias. El proyecto, que está ubicado en UK y es coordinado por el Dr. Nigel Lowe, es una colaboración entre la Universidad de York y el Engineering and Physical Sciences Research Council. Si tienes ideas para grandes experimentos, Nigel está esperando saber de ti.
Mezcla 3 cucharadas de bicarbonato sódico y 1 cucharada de cristales de acido cítrico (grado alimenticio). Para mejorar el sabor, añade o bien 2-4 cucharadas de azúcar glasé o una cucharada de gelatina instantánea y una cucharada de azúcar. Tu sorbete está listo para probar.
Los cristales de ácido cítrico se disuelven en la lengua y reaccionan con el bicarbonato sódico. Esto produce burbujas del gas dióxido de carbono, causando la sensación de efervescencia en la lengua. Para hacer una gaseosa, mezcla el sorbete con agua.
Cohetes y explosivos funcionan al generar enormes volúmenes de gas en muy poco tiempo. Tú puedes crear tus propios cohetes utilizando ácido cítrico y bicarbonato sódico o pastillas efervescentes.
Los experimentos siguientes producen proyectiles de alta velocidad. Sigue todas las indicaciones de seguridad y ponte gafas de protección. Realiza todos los experimentos en un espacio abierto, ya que lo puedes dejar todo hecho una pena. Véase también la nota general de seguridad.
Nunca permitas que nadie mire por encima del cañón cuando éste esté ‘cargado’. Si falla (como ocurre a veces si la tapa no cierra herméticamente), quita la tapa con mucho cuidado, manteniendo tu cara bien apartada.

Cuando los cristales de ácido cítrico y bicarbonato sódico se disuelven en el agua, reaccionan entre ellos para producir gas dióxido de carbono. Las pastillas efervescentes contienen ambos ingredientes (bicarbonato sódico y un ácido), que reaccionan entre ellos cuando se añade agua. El gas resultante se expande, presionando en las paredes y tapa del cañón. Cuando la presión llega a ser más fuerte que el punto más débil de la pared circundante (la tapa), el cañón explotará dramáticamente, con la tapa saliendo disparada hasta 5 m en el aire, liberando el gas.
Cronometra el tiempo que tarda la tapa en salir disparada y luego experimenta con diferentes cantidades: por ejemplo, intenta que la tapa salga disparada exactamente en 1 min.

El dióxido de carbono puede ser un peligro si se acumula en concentraciones suficientemente altas. Para controlar este y otros gases peligrosos en el lugar de trabajo, el EFDA-JETw4 utiliza una variedad de instrumentos, tanto de uso manual como instalados fijos en edificios, para detectar gases que disminuyen la concentración de oxígeno y que por tanto pueden producir asfixia. El control de gases incluye no solamente el dióxido de carbono y otros gases criogénicos como el helio, sino también el nitrógeno (usado para extinguir incendios), hexafluoruro de azufre (SF6, un gas usado como aislante eléctrico) y vapores de líquidos refrigerantes como el Galden®. Antes de trabajar en aéreas donde estos gases son un peligro, el personal debe verificar la instrumentación instalada o solicitar el uso de un instrumento portátil para confirmar que la atmósfera es segura.
El dióxido de carbono es también un riesgo potencial a 350 km por encima de la superficie de la Tierra – para los astronautas a bordo de la Estación Espacial Internacional (ISS), una colaboración entre la Agencia Espacial Europea (ESA)w5 y otros socios internacionales.
Cuando los humanos respiramos, consumimos oxígeno y producimos dióxido de carbono. Como resultado, en hábitats cerrados tales como los submarinos, aviones y la ISS, los niveles de oxígeno disminuyen y los de dióxido de carbono se acumulan, poniendo en peligro a la tripulación (tal como se describe en la película Apollo 13). Los niveles de ambos gases necesitan ser regulados.
En la actualidad, la ISS utiliza un enfoque abierto: atrapar dióxido de carbono con trampas especificas para este gas (por ejemplo, hidróxido de litio, LiOH, que combina con CO2 para formar carbonato de litio y agua) y transportando botellas de oxígeno desde la Tierra. En el futuro, la ISS usara un enfoque cerrado de reciclado: recuperando O2 del CO2, utilizando ya sea técnicas fisicoquímicas (esencialmente ‘cortando’ la parte de oxígeno de la parte del carbono) o algas y otras plantas fotosintetizadoras.
EFDA-JET y ESA son miembros del EIROforumw6, el editor de Science in School.

Géiser viene de la palabra geysa del Nórdico antiguo, que significa brotar. Usado por primera vez para El Gran Geysir, una fuente termal en el valle Haukadalur, Islandia, que arroja agua hirviendo hasta 70 m en el aire. El término se utiliza ahora de manera más general para fuentes con erupciones intermitentes de chorros de agua. Al igual que existen géiseres impulsados por agua hirviendo, también hay géiseres fríos, impulsados por CO2. Subiendo por las profundidades de la Tierra, el gas se acumula por debajo de un depósito de agua subterránea, aumentando la presión. Esta presión se libera regularmente en forma de fuente de agua fría. Puede que tengas una más cerca de tu casa de lo que te imaginas – por ejemplo en Herl’any, en Eslovaquia, o en Wallenborn y cerca de Andernach, en Alemania.

Si no, puedes hacer uno por tu cuenta. Coloca 200 ml de agua en una botella de plástico con una boquilla retráctil (por ejemplo, una que contuvo jabón líquido; ver imagen más abajo), añade una cucharadita colmada de bicarbonato sódico y mezcla bien.
Añade cerca de 35 ml de jabón líquido y agita otra vez. Utilizando un embudo, rápidamente añade tres cucharaditas colmadas de cristales de acido cítrico. Muy rápidamente, enrosca y presiona la boquilla cerrando la botella, agita brevemente y tira de la boquilla hacia arriba para abrirla.
Una fuente de espuma se disparará en el aire hasta 5 m de altura. Alternativamente, puedes esperar hasta que la boquilla se abra sola. Hagas como lo hagas, después de un rato, la presión se liberará y la fuente se parará. Cierra la botella apretando la boquilla hacia abajo; unos 30 segundos más tarde, la presión volverá a ser suficientemente alta para empezar de nuevo el géiser. Se puede repetir varias veces.
Información general sobre CO2 (PDF o formato Word®)
Historias reales sobre efectos letales del dióxido de carbono (PDF o formato Word®)
de Vries T (2002) Vitamintabletten einmal anders. Chemkon 9(3): 144-146. doi: 10.1002/1521-3730(200207)9:3<144::AID-CKON144>3.0.CO;2-K
Johnson S (2008) Sembrando ideas: actividades sobre el cambio climático para la escuela primaria. Science in School 10: 55-63. www.scienceinschool.org/2008/issue10/psiclimate/spanish
Shallcross D, Harrison T (2011) Is climate change all gloom and doom? Introducing stabilisation wedges. Science in School 20: 60-64. www.scienceinschool.org/2011/issue20/wedges
Este artículo ofrece maneras sencillas de desentrañar algunos misterios de la ciencia. Ayuda a comprender fenómenos naturales y realidades, tanto diarias (respiración) como ocasionales (actividad volcánica). Puede estimular el desarrollo de otros experimentos prácticos. Tanto a nivel global (cambio climático) como a un nivel mucho menor (experimentos), puede permitir a los estudiantes darse cuenta que los peligros existen y que es necesario tomar medidas para evitarlos.
El artículo puede relacionarse con noticias de la actualidad o fenómenos naturales como las erupciones volcánicas islándicas o depósitos geotermales. Puede también contribuir al despertar de una consciencia más ecológica. Vínculos interdisciplinarios pueden establecerse entre asuntos medioambientales y ecológicos en química y física, biología (respiración), ciencias de la tierra, matemáticas (medidas y proporciones) y el conocimiento práctico (instrucciones y normas).
A los más pequeños les encantarán los globos efervescentes y los géiseres; Yo reservaría las actividades más explosivas para los estudiantes mayores.
Maria João Lucena, Portugal