Supporting materials
Dioxyde de carbone- connaissances de base (Word)
Dioxyde de carbone- connaissances de base (Pdf)
Histoires de dioxyde de carbone (Word)
Histoires de dioxyde de carbone (Pdf)
Download
Download this article as a PDF

Traduit par Nathalie Bisson. Marlene Rau présente quelques activités pétillantes et amusantes impliquant le dioxyde de carbone, développées par « Chemol and Science » dans « the Shelves »

Le dioxyde de carbone (CO2) n’est pas seulement l’un des plus importants gaz à effet de serre, mais il se trouve partout autour de nous : dans l’air (0.0388% en vol) que nous respirons; dans l’air que nous rejetons (4 % en vol), dans les boissons gazeuses ; dans les gâteaux, qui lèvent grâce au CO2 produit par la levure ; et quand des produits organiques comme la paraffine, le papier, le bois ou le pétrole sont brûlés. Sous sa forme liquide, il est utilisé dans les extincteurs et comme réfrigérant dans l’industrie alimentaire (par exemple pour conserver et transporter les crèmes glacées).
A fortes concentrations, le CO2 peut devenir dangereux pour les humains et les autres animaux, mais c’est aussi la source de toute vie: pendant la photosynthèse, les plantes utilisent le CO2 et l’énergie de la lumière pour produire des sucres, de l’amidon, des graisses et des protéines, de même que le dioxygène dont nous avons besoin pour survivre.
Les activités suivantes, issues de « Chemolw1 » et « Science on the Shelvesw2 » (voir boite à outils) permettent d’introduire l’étude de ce gaz très important auprès d’enfants d’école primaire. Pour accompagner les activités, des données complémentaires de base sur la chimie, l’importance physiologique, la détection et la répartition du CO2 sont disponibles dans la section ressources w3.

Note: les quantités de dioxyde de carbone utilisées dans ces activités ne sont pas suffisamment importantes pour être dangereuses.
Lorsqu’on ajoute de l’eau à des cachets effervescents ou à de la levure chimique, il se forme des bulles : un gaz est produit. On peut utiliser ce gaz pour gonfler un ballon sans avoir à souffler dedans. Quel est ce gaz ? récoltons le et analysons le.
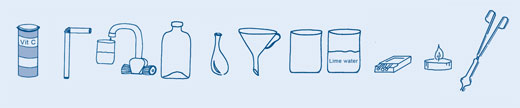

Les six premières étapes sont communes à 2 activités. Ensuite, deux options différentes permettent de continuer.
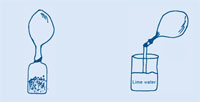
Quand le ballon a fini de se gonfler, le tordre pour le fermer et éviter que le gaz ne s’échappe, et l’enlever du goulot de la bouteille.
Si l’eau de chaux rentre en contact avec les yeux, les rincer immédiatement avec de l’eau. Voir aussi les consignes générales de sécurité.
Le test à l’eau de chaux permettant de détecter le CO2 a été mis au point par le chimiste Joseph Black (1728–1799). Le ciment et le mortier contiennent tous les deux de l’hydroxyde de calcium (Ca(OH)2). Quand du CO2 est ajouté à Ca(OH)2 en solution dans l’eau, de toutes petites particules de carbonate de calcium (CaCO3) se forment ; C’est ce qui trouble l’eau de chaux.
D’où vient le CO2 produit? La levure chimique et les cachets effervescents contiennent tous les deux du bicarbonate de sodium (NaHCO3) et un acide fort (comme l’acide citrique ou le phosphate de calcium). Au contact de l’eau, le bicarbonate de sodium et l’acide réagissent ensemble en produisant de l’eau et du CO2. Ce gaz forme les bulles que l’on voit quand on dissous un cachet effervescent ; C’est aussi ce qui permet aux gâteaux de lever.
La bougie devrait s’arrêter de brûler car le gaz (CO2) éteint la flamme.
Une nouvelle fois, la flamme s’éteint, montrant qu’il a été possible de transférer le gaz d’un bécher à l’autre, comme si c’était un liquide. Ceci démontre que le CO2 est plus lourd que l’air.
Chemolw1 est un projet basé à l’Université d’Oldenburg, Allemagne, destiné à permettre aux enfants d’école primaire de rentrer en contact avec la chimie. L’équipe, qui inclut des professeurs stagiaires et qui est dirigée par le Dr Julia Michaelis, propose des ateliers pour les enfants sur les thèmes du feu, de la terre, de l’air et de l’eau, de même que des formations pour les enseignants du primaire.
D’autres activités proposées par Chemol autour du dioxyde de carbone incluent la fabrication de votre propre extincteur à CO2, des expériences avec des boissons carbonatées, la mesure de la quantité de CO2 produite par l’effervescence d’un cachet, le test de l’effet de la température sur la solubilité du CO2 dans l’eau. Des détails peuvent être trouvés sur le site internet de Chemolw1.
Science on the Shelves est un site webw2 diffusant des protocoles pour une grande variété d’expériences simples à partir d’aliments ou d’autres produits de supermarché, adaptées au 6-11 ans et à leurs enseignants et leurs familles. Ce projet basé en Grande Bretagne, coordonné par le Dr Nigel Lowe, est une collaboration entre l’Université de York et le « Engineering and Physical Sciences Research Council ». Si vous avez des idées d’expériences intéressantes, Nigel sera ravi de vous aider.
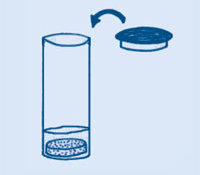
Mélanger 3 cuillères de bicarbonate de sodium avec 1 cuillère de cristaux d’acide citrique (qualité alimentaire). Pour améliorer le goût, ajouter aussi 2 à 4 cuillères de sucre glace ou une cuillère de gélatine en poudre instantanée. Votre sorbet est prêt à goûter !
Les cristaux d’acide citrique se dissolvent sur votre langue et réagissent avec le bicarbonate de sodium. Ceci produit des bulles de dioxyde de carbone, qui causent l’impression de pétillement sur votre langue. Pour faire une boisson gazeuse, mélanger le sorbet avec de l’eau.
Les fusées et les explosifs fonctionnent à partir de grandes quantités de gaz produites en un temps très court. Vous pouvez créer vos propres fusées en utilisant de l’acide citrique et de la poudre à lever ou des cachets effervescents.
Les expériences suivantes produisent des projections à haute vitesse. Suivez toutes les règles de sécurité ci-dessous et portez des lunettes de sécurité. Faites toutes ces expériences dehors, car elles sont salissantes. Voir aussi les consignes générales de sécurité.
Ne jamais laisser personne regarder par dessus le canon une fois qu’il est “chargé”. S’il n’explose pas (comme cela arrive parfois si le bouchon fuit), l’ouvrir en faisant très attention et en gardant le visage à l’abri.

Quand les cristaux d’acide citrique et la levure se dissolvent dans l’eau, ils réagissent ensemble pour produire du dioxyde de carbone. Les cachets effervescents contiennent déjà les deux ingrédients (l’acide et le bicarbonate de sodium), qui réagiront ensemble quand on ajoutera de l’eau. Le gaz produit se dilate, fait pression sur les parois et le bouchon du canon. Quand la pression devient plus forte que la résistance la plus faible des parois environnantes (le bouchon), le canon explose brutalement et le bouchon peut sauter jusqu’à 5 m en l’air, libérant le gaz.
Chronométrer le temps qu’il faut au bouchon pour sauter puis essayer de tester les quantités : par exemple, essayez de faire sauter le bouchon au bout d’exactement une minute.

Le dioxyde de carbone peut être un danger s’il s’accumule en concentrations suffisamment importantes. Pour mesurer son taux et celui d’autres gaz dangereux sur les lieux de travail, EFDA-JETw4 utilise une variété d’instruments de mesure, apportés ou installés dans les bâtiments, pour détecter les gaz qui abaissent le taux de dioxygène et peuvent conduire à une asphyxie. Les gaz mesurés comprennent non seulement le dioxyde de carbone et d’autres gaz cryogéniques comme l’hélium, mais aussi l’azote (utilisé pour l’extinction des feux), le sulfure hexafluoré (SF6, un gaz utilise comme isolant électrique) et les vapeurs de fluides réfrigérants comme le Galden®. Avant de travailler dans les zones où ces gaz peuvent être dangereux, les équipes doivent en consulter les taux sur les instruments installés ou demander une mesure avec un instrument portable pour confirmer que l’atmosphère est saine.
Le dioxyde de carbone est aussi un danger potentiel 350 km au dessus de la Terre- pour les astronautes à bord de la station spatiale internationale (SSI), une collaboration entre l’agence spatiale européenne (ESA)w5 et d’autres partenaires internationaux.
Lorsque les hommes respirent, ils consomment du dioxygène et rejettent du dioxyde de carbone. Par conséquent, dans des espaces confinés comme les sous-marins, les avions, et la SSI, le taux d’oxygène s’abaisse et le dioxyde de carbone s’accumule, mettant en danger l’équipage (comme décrit dans le film Apollo 13). Le taux de chacun des deux gaz doit donc être régulé.
Habituellement, dans la SSI est utilisée une méthode directe : il s’agit de piéger le dioxyde de carbone par des pièges spécifiques (par exemple l’hydroxyde de lithium, LiOH, pour former du carbonate de lithium et de l’eau) et de transporter des bouteilles d’oxygène depuis la Terre. Dans le futur, la SSI utilisera une solution plus pertinente et permettant le recyclage : produire du O2 à partir du CO2, en utilisant soit des techniques physico-chimiques (essentiellement en séparant les atomes de C et de O) soit des algues et d’autres plantes (photosynthèse).
EFDA-JET et ESA sont membres du EIROforumw6, les éditeurs de Science in School.

Geyser vient d’un vieux mot nordique geysa, qui signifie jaillir.Utilisé d’abord pour le grand geyser, une source chaude de la vallée Haukadalur, en Islande, qui projette de l’eau bouillante jusqu’à 70 m dans les airs, le terme est aujourd’hui utilisé de façon plus générale et désigne aussi des sources avec des jets d’eau intermittents. De même qu’il y a des geysers propulsés par de l’eau bouillante, il y a des geysers froids, propulsés par du CO2. Remontant des profondeurs de la Terre, le gaz se concentre dans des réservoirs d’eau souterrains et augmente en pression. Celle-ci est régulièrement dissipée par l’intermédiaire d’une fontaine d’eau froide. Il pourrait y en avoir une plus près de chez vous que vous ne le pensez, par exemple à Herl’any en Slovaquie, ou à Wallenborn et près de Andernach en Allemagne.

Dans le cas contraire, vous pouvez en fabriquer un vous-même. Mettre 200 mL d’eau dans une bouteille en plastique à bouchon rétractable (par exemple un flacon de liquide vaisselle, voir l’image ci-dessous), ajouter une cuillère à café rase de bicarbonate de sodium et bien mélanger.
Ajouter environ 35 mL de liquide vaisselle et mélanger à nouveau. En utilisant un entonnoir, ajouter rapidement 3 cuillères à café rases d’acide citrique cristallisé. Très vite, visser le bouchon sur la bouteille (bouchon rétractable fermé), agiter brièvement et ouvrir le bouchon rétractable.
Une fontaine de mousse jaillira dans les airs, jusqu’à peut être une hauteur de 5 m. Autrement, vous pouvez aussi attendre que le bouchon rétractable saute spontanément. Quelque soit votre choix, après un court instant, la pression aura baissé et la fontaine s’arrêtera. Refermer la bouteille en appuyant sur le bouchon rétractable ; environ 30 secondes plus tard, la pression sera de nouveau suffisante pour propulser un geyser. Vous pouvez répéter l’opération plusieurs fois.
de Vries T (2002) Vitamintabletten einmal anders. Chemkon 9(3): 144-146. doi: 10.1002/1521-3730(200207)9:3<144::AID-CKON144>3.0.CO;2-K
Johnson S (2008) Planter des idées: activités sur le changement climatique pour l’école primaire. Science in School 10. www.scienceinschool.org/2008/issue10/psiclimate/french
Shallcross D, Harrison T (2011) Sommes-nous condamnés au changement climatique? Des cales anti-carbone. Science in School 20. www.scienceinschool.org/2011/issue20/wedges/french
Cet article révèle des façons simples de percer des mystères scientifiques. Il aide chacun à comprendre les phénomènes naturels et les faits soit de la vie quotidienne (la respiration), soit plus occasionnels (l’activité volcanique).Ceci peut motiver la classe pour poursuivre d’autres expériences. A la fois à un niveau global (le changement climatique) ou à un plus petit niveau (les expériences), il permet aux élèves de réaliser que des dangers existent et qu’il est nécessaire de prendre des mesures pour les éviter.
Cet article peut être mis en relation avec les évènements courants ou des phénomènes naturels locaux comme l’éruption du volcan islandais ou les sources géothermales. Il peut aussi contribuer à éveiller une conscience écologique. Des liens interdisciplinaires peuvent être faits sur les questions environnementales et écologiques en chimie et physique, biologie (respiration), géologie, maths (mesures et proportions) et langage (instructions et règles).
Les plus jeunes enfants aimeront les ballons et les geysers ; je réserverai les activités plus explosives aux élèves plus âgés.
Maria João Lucena, Portugal