Kunststoffe im Auto: Polymerisation und Recycling Teach article
Übersetzt von Anne Käfer. Welche Kunststoffe benötigt man, um ein Auto zu bauen? Wie werden sie synthesiert und rezyklisiert? Marlene Rau und Peter Nentwig stellen zwei Aktivitäten aus dem 'Chemie im Kontext'-Projekt vor.

von Niko Guido / iStockphoto
Viele Teenager interessieren sich für Autos, die zahlreiche verschiedene Kunststoffe enthalten: Polymere, hergestellt aus Rohöl und nachwachsenden Rohstoffen. Das Interesse für Autos kann also genutzt werden, um das Thema Kunststoffe und Polymere vorzustellen, z.B. in Unterrichtsstunden zur organischen Chemie.
Betrachte mit deinen Schülern einige Autos.Was wissen sie schon über die Kunststoffe, die im Automobilbau verwendet werden? Was möchten sie gerne herausfinden? Sie könnten ihre Ideen zu den verschiedenen Teilen des Autos zuordnen. (s. Tabelle unten)
Tabelle 1: Verwendung von Kunststoffen im Auto
- Machen Kunststoffe ein Auto umweltfreundlicher? (geringerer Treibstoffverbrauch, Recycling von Kunststoffteilen)
- Transparente Scheinwerfer und Rücklichter
- Sommer- und Winterreifen
- Starke Sicherheitsgurte
- Hitzebeständige Kunststoffe in der Nähe des Motors
- Schaumstoffe in den Autositzen
Wichtig ist, dass die Komponenten von Fahrzeugen spezifische Anforderungen erfüllen (z.B. müssen Sicherheitsgurte stark aber flexibel sein). Das bedeutet, dass ihre Bestandteile spezifische Eigenschaften haben müssen (z.B. sollte das Material nicht reißen). Es sollten also bestimmte Arten von Materialien (z.B. Polyethylenterephthalat) eingesetzt werden. Wenn die Schüler nicht selbst auf diese Zusammenhänge kommen, solltest du sie fragen, warum ein bestimmter Typ von Kunststoff sich nicht für den Automobilbau eignet.
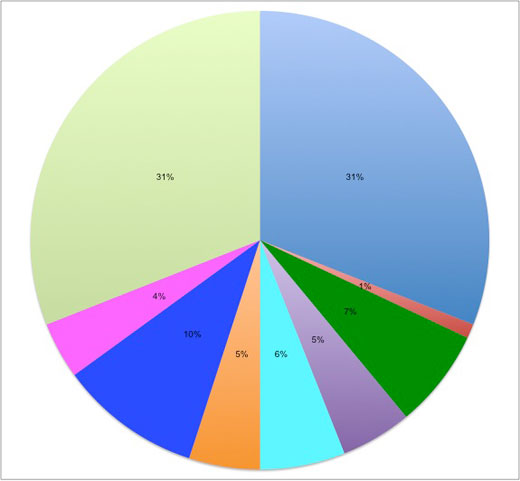
Acrylnitril-Butadien-Styrol-Terpolymer: 31%
Polyethylenterephthalat: 1%
Polycarbonat/Acrylnitril-Butadien-Styrol-Terpolymer: 7%
Acrylglas: 7%
Polypropylen: 6%
Polybutylenterephthalat: 5%
Polyacetat: 10%
Polycarbonat: 4%
Polyamid: 31%
Mit freundlicher Genehmigung von Leibniz Institut für die Pädagogik der Naturwissenschaften und Mathematik
Die Aktivitäten in diesem Artikel sprechen zwei der Punkte in Tabelle 1 an: Kunststoffe für Rücklichter und wie Kunststoffe aus Autos wiederaufgearbeitet werden. Jede Aktivität besteht aus einem Arbeitsblatt und Hintergrundinformation. Die Aktivitäten sind Teil eines Unterrichtsplans (s. Kasten) der für Schüler ab 16 geeignet ist, die in Zweier- oder Dreiergruppen arbeiten sollten. Sieh ein oder zwei Unterrichtsstunden für jede Aktivität vor.
Das ‚Chemie im Kontext‘-Projekt
Das ‚Chemie im Kontext‘-Projekt ist ein Projekt, das vom Leibniz Institut für die Pädagogik der Naturwissenschaften und Mathematik an der Universität Kiel in Deutschland koordiniert wird. Zwischen 2002 und 2008 entwickelten Chemie-Lehrer, Lehrer anderer Naturwissenschaften und Vertreter der Schulen Lern-Einheiten für die chemische Ausbildung – für alle Stufen und Arten von Schulen, wobei die Anforderungen des Lehrplans in einen Alltags-Zusammenhang gebracht wurden. Beispiele für die Quellen und Empfehlungen zum Entwickeln von weiterem Material sind online verfügbarw1. Eine Sammlung von Hilfsmitteln, die von Lehrern entwickelt wurden, kann kostenlos bestellt werden und vier der Unterrichtspläne sind frei verfügbar (alle in deutscher Sprache). Ein Textbuch und ein Lehrer-Handbuch (in deutsch) sind beim Cornelsen-Verlag veröffentlicht.
Dieser Artikel ist ein Auszug aus einem der Unterrichtspläne. Der komplette Unterrichtsplan umfasst sechs verschiedene Aktivitäten, jeweils für eine der Kästen in Tabelle 1.
Polymerisation: Kunststoffe für Beleuchtungseinrichtungen von Autos

Mit freundlicher Genehmigung
von BASF 1998
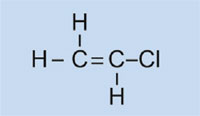
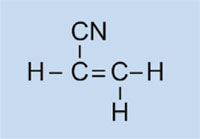
Beleuchtungen von Autos haben Kunststoff-Abdeckungen, um sie sauber und trocken zu halten, und – in einigen Fällen – zur farbigen Ausstattung (z.B. rot für Rücklichter und gelb für Blinker). Das verwendete Material muss transparent, leicht, anfärbbar, leicht verarbeitbar und einigermaßen stabil sein. In dieser Aktivität synthetisieren wir den verwendeten Kunststoff: Polymethylmethacrylat oder PMMA.
Polymethylmethacrylat ist allgemein als Acrylglas oder Plexiglas bekannt und gehört zur Gruppe der Polymerisate. Generell enthalten deren Monomer-Bausteine eine oder mehrere Doppelbindungen. Unter dem Einfluss von Radikalen (Moleküle mit einem ungepaarten, freien Elektron) polymerisieren diese Einheiten radikalisch zu langkettigen Makromolekülen.
Die Eigenschaften von Makromolekülen hängen davon ab, welche Seitenketten vorliegen; dies wiederum hängt vom verwendeten Monomer ab. Durch Verwendung von verschiedenen Monomeren bei der Bildung von Kunststoff-Polymerisaten können wir Kunststoffe für verschiedene Anwendungen im Auto schaffen. Zum Beispiel verhindern die sperrigen Seitengruppen in PMMA die Bildung kristalliner Strukturen bei der Verfestigung, die das Licht brechen würden. Amorphe Kunststoffe sind dagegen transparent; dadurch eignen sie sich als Ersatz für Glas: heller, verformbarer und weniger zerbrechlich.
Wir können die radikalische Polymerisation am Treibstofftank von Autos verdeutlichen, der aus Polyethylen hergestellt ist. Polyethylen bildet sich aus Ethen (Ethylen, C2H4) in einer Reaktion, die durch Dibenzoylperoxid initiiert wird. Beim Erhitzen auf 90°C wird Dibenzoylperoxid in zwei Radikale gespalten. Wenn eines der Radikale sich an ein Ethylen-Molekül bindet, bricht die Doppelbindung des Ethylen-Moleküls auf und es entsteht ein neues, größeres Radikal. Auf diese Art startet eine Kettenreaktion, die erst abbricht, wenn zwei Radikale miteinander reagieren.
|
Monomer |
Polymer |
|---|---|
|
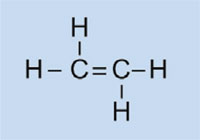
Ethylen
|
Polyethylen
|
|
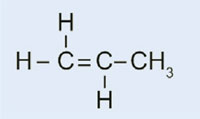
Propylen
|
Polypropylen
|
|
Vinylchlorid
|
Polyvinylchlorid
|
|
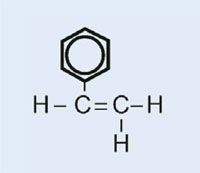
Styrol
|
Polystyrol
|
|
Acrylnitril
|
Polyacrylnitril
|
|
Methylmethacrylat
|
Polymethylmethacrylat
|
|
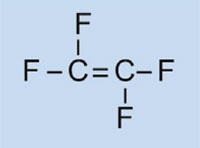
Tetrafluorethylen
|
Polytetrafluorethylen
|


Figure 2: die einzelnen Polymerisationsschritte
Mit freundlicher Genehmigung von Leibniz Institut für die Pädagogik der Naturwissenschaften und Mathematik
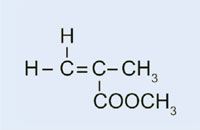
In unserem Versuch werden wir Dibenzoylperoxid nutzen, um einen ähnlichen Prozess zu initiieren: Statt Ethylen zur Bildung von Polyethylen zu verwenden, verwenden wir Methyl-2-methylpropenoat um Polymethylmethacrylat herzustellen.
Schüler-Arbeitsblatt 1: Synthese eines transparenten Polymers
Materialien

Mit freundlicher Genehmigung
von Leibniz Institut für die
Pädagogik der
Naturwissenschaften und
Mathematik
- Methyl-2-methylpropenoat (auch bekannt als Methylmethacrylat; C5H8O2)
- Dibenzoylperoxid (C14H10O4)
- Sudanrot Farbstoff
- Wasser
- Aceton (Propanon, C3H6O)
Ausrüstung für die Gruppe
- Eine Waage
- Eine Heizplatte
- Ein Reagenzglas
- Ein Becherglas
- Ein Uhrglas
- Ein Spatel
- Eine Pipette
- Die Aluminium-Fassung aus einem Teelicht
Sicherheitshinweis
Benutze Handschuhe und Sicherheitsbrille und arbeite unter dem Abzug. Methyl-2-methylpropenoat, Dibenzoylperoxid und Aceton sind entzündlich; Aceton ist außerdem reizend. Alle drei müssen mit Vorsicht behandelt werden. Reste an Sudanrot dürfen nicht über das Abwasser entsorgt werden.
Mit freundlicher Genehmigung
von Leibniz Institut für die
Pädagogik der
Naturwissenschaften und
Mathematik
Versuchsdurchführung
- Wiege 0,2 g Dibenzoylperoxid in das Reagenzglas.
- Gib 10 ml Methyl-2-methylpropenoat zu.
- Zum Einfärben des gebildeten Kunststoffs gib etwas Sudanrot zu (etwa eine Spatelspitze).
- Erwärme das Reagenzglas in einem Becherglas mit Wasser auf 90°C; s. Figure 3, unten.
Die Reaktion dauert etwa 20 Minuten, danach sollte die Mischung sichtlich viskos sein. Lies in der Zwischenzeit die Information mit dem Titel ‘‚Polymerisation: Kunststoffe für Fahrzeug-Beleuchtungen’ und erarbeite den Reaktionsmechanismus für die radikalische Polymerisation von Methyl-2-methylpropenoat.
- Gieße die Lösung in die Aluminium-Fassung eines Teelichtes.
Wenn der Kunststoff im Reagenzglas sich zu verfestigen beginnt, kannst du ihn wieder mit Aceton lösen. Du kannst den Versuch dann wie beschrieben fortsetzen und dem Aceton genügend Zeit zum Verdampfen lassen.
- Bedecke die Aluminium-Fassung mit einem Uhrglas, um den Kunststoff warm zu halten und ihn schneller aushärten zu lassen.
- Das Polymethylmethacrylat benötigt 24 h zur Verfestigung. Entferne es danach aus der Aluminium-Fassung.
Wie kannst du die Eigenschaften deines Kunststoffs untersuchen und mit denen von Glas vergleichen?
Recycling von Kunststoffen aus Autos

verschiedenen Brennstoffen;
von links nach rechts: Heizöl;
Kunststoffabfall wie Olefine;
Lignit. Zum Vergrößern auf
das Bild klicken
Mit freundlicher Genehmigung
von Leibniz Institut für die
Pädagogik der
Naturwissenschaften und
Mathematik
In dieser Aktivität lernen die Schüler zunächst etwas darüber, wie Kunststoffe aus Autos rezyklisiert werden können. Danach versuchen sie selbst das Recycling, indem sie eine Kunststoffflasche in ein Stück geformten Kunststoff umwandeln.
Was passiert, wenn wir ein Auto fertiggestellt haben? Man könnte an Halden von rostenden Autos und alten Reifen denken, die für die Abfalldeponie bestimmt sind, aber in Wirklichkeit werden viele Teile im Auto rezyklisiert, um wertvolle Rohstoffe wiederzugewinnen, insbesondere Metalle.
Die Kunststoffe im Auto können aber auch auf drei Arten rezyklisiert werden: als Teile, chemische Komponenten oder Brennstoff.
- Autos können repariert werden, indem man alte Kunststoffteile als Stoßfänger einsetzt. Wenn die Teile jedoch älter werden, ändern sich ihre Eigenschaften und sie sind für eine Wiederverwertung unbrauchbar: Sonneneinstrahlung, zum Beispiel, macht die meisten Kunststoffe brüchig. Zum Glück können einige Kunststoffteile aufgeschmolzen werden und zu Teilen umgeformt werden, die niedrigere Qualitätsanforderungen aufweisen, wie Zaunpfosten oder Gartenbänke.
- Durch chemische Umsetzungen können einige Polymere in ihre Monomerkomponenten aufgespalten werden, die dann für neue Synthesen zur Verfügung stehen. Kunststoffe können auch verwendet werden, um andere Rohstoffe für die chemische Industrie zu produzieren; eine Tonne eines bestimmten Typs an verbrauchtem Kunststoff ergibt z.B. etwa 600 kg Methanol, das ein wichtiger Rohstoff für die Kunststoffindustrie ist und auch in Brennstoffzellen zur Erzeugung von Energie eingesetzt wird.
- Zerkleinerte Kunststoffe können direkt als Brennstoff verwendet werden und Öl und Kohle ersetzen, z.B. in Ersatzbrennstoffanlagen. Sie können auch Koks ersetzen, der für die Stahl-Herstellung in Hochöfen eingesetzt wird. (s. Fig. 4).
Schüler-Arbeitsblatt 2: Recycling von Kunststoffen im Unterricht
In dieser Aktivität werdet ihr Kunststoffabfall von einer Flasche in geformte Kunststoffstücke rezyklisieren. Was ihr damit macht, ist eurer Phantasie überlassen: Schlüsselringe, Anhänger, Weihnachtsbaumschmuck.

Mit freundlicher Genehmigung
von hippokrat / iStockphoto
Materialien für die Gruppe
- Ein Bunsenbrenner
- Ein Dreifuß mit einem Drahtnetz
- verschiedene Ausstechformen
- Aluminiumfolie
- Ein Messer
- Kunststoffabfall (vzw. PET-Flaschen für Mineralwasser)
- Eine Auswahl an Farbstoffen
Sicherheitshinweis
Verwende Sicherheitsglas und arbeite unter dem Abzug. Lass die Flamme nicht in direkten Kontakt mit dem Kunststoff kommen. Achte darauf, dich nicht zu verletzen.
S. auch den allgemeinen Sicherheitshinweis.
Versuchsdurchführung
- Nutze das Messer, um den Kunststoffabfall so klein wie möglich zu schneiden.
- Bedecke den Boden und die Seiten der Ausstechformen mit Folie und fülle sie bis zu einer Tiefe von 0,5 cm mit zerkleinertem Kunststoffabfall. Wenn du willst, versuche ein kleines Stück Farbstoff zum Kunststoffabfall zuzugeben.
- Lege die Ausstechformen auf das Drahtnetz über den Bunsen-Brenner und erhitze sie langsam, bis der Kunststoff schmilzt.
- Nimm nach dem Abkühlen den Kunststoff heraus und entferne die Folie.
Vergleiche die Eigenschaften des Kunststoffs vor und nach dem Recycling. Welchen Schluss kannst du über das Kunststoff-Recycling ziehen?
Diskutiere in deiner Gruppe die drei Recycling-Methoden, die unter der Überschrift ‘Recycling von Kunststoffen aus Autos’ beschrieben sind, und vergleiche mögliche Anwendungen. Denke über den Versuch, den du durchgeführt hast, nach: Welche möglichen Anwendungen gibt es für deinen Kunststoff?
Untersuchung von Kunststoffen mit Röntgenstrahlen

An der European Synchrotron Radiation Facility (ESRF)w2, werden seit mehr als 10 Jahren Hochleistungsfasern wie der Kunststoff Kevlar® untersucht. Kevlar ist (bez. auf das Gewicht) fünfmal stärker als Stahl und wird verwendet in Fahrradreifen, Körperpanzerungen, Racingsegeln und Haltetauen.
Ein großer Teil der Arbeit der ESRF in Bezug auf Hochleistungsfasern bezieht sich auf deren Haut-Kern-Morphologie: die Strukturunterschiede zwischen den äußeren Schichten der Faser und dem Inneren. Diese Unterschiede können die mechanischen Eigenschaften der Fasern beeinflussen. Durch das Verständnis der Haut-Kern-Morphologie lassen sich die Eigenschaften der Fasern beim Herstellungsprozess maßschneidern.
Mikrofocus-Röntgenröhren werden bei der ESRF routinemäßig zu neueren Untersuchungen dieser bemerkenswerten Materialien eingesetzt. Keine andere Technik liefert ähnliche Informationen, ohne die Faser zu teilen und dabei möglicherweise deren interne Mikrostruktur zu verändern. Weitere Informationen, s. Capellas Espuny, 2009.
ESRF ist ein Mitglied von EIROforumw3, Herausgeber von Science in School.
References
- Capellas Espuny M (2009) A new look into fibre-reinforced composite materials. ESRF News 50: 12-13. www.esrf.eu/UsersAndScience/Publications/Newsletter
Web References
- w1 – Nähere Information über das Projekt (in Englisch und Deutsch) und Herunterladen der Quellen (in Deutsch), s. Chemie im Kontext website: www.chik.de
- w2 – Ein internationales Forschungszentrum in Grenoble, Frankreich. ESRF erzeugt Röntgenstrahlen mit außerordentlicher Helligkeit, die von Tausenden von Wissenschaftlern in der ganzen Welt jedes Jahr genutzt werden. Nähere Information, s.: www.esrf.eu
- w3 – Mehr über EIROforum, s. www.eiroforum.org
Resources
- Mehr über das Projekt ‚Chemie im Kontext‘ s.:
-
Parchmann I et al. (2006) Chemie im Kontext: a symbiotic implementation of a context-based teaching and learning approach. International Journal of Science Education 28(9): 1041-1062
-
Nentwig P et al. (2007) Chemie im Kontext: situated learning in relevant contexts while systematically developing basic chemical concepts. Journal of Chemical Education 84: 1439
-
- Eine Drama-Aktivität über die radikalische Polymerisation von Ethylen zu Polyethylen im Unterricht, s.:
-
Sturm B (2009) Darstellendes Spiel in den Naturwissenschaften. Science in School 13: 29-33.
-
- Mehr über die Erforschung von bioabbaubaren Kunststoffen s.:
-
Bradley D (2007) Plastics, naturally. Science in School 5: 66-69.
-
Review
Die Chemie wird von Schülern gewöhnlich als weit entfernt und gefährlich angesehen, aber wir sind von ihr umgeben und sie spielt eine große Rolle bei der Verbesserung unserer Lebensqualität. Aktivitäten wie in diesem Artikel, bei denen Material des täglichen Lebens eingesetzt wird, können dazu beitragen, die Wertschätzung für die Chemie zu erhöhen und das Interesse dafür bei Schülern zu steigern.
Diese Aktivitäten könnten in Unterrichtsstunden zur organischen Chemie und auch in der Biologie eingesetzt werden, um die Bedeutung des Recyclings zu diskutieren. Obwohl die Autoren die Aktivitäten für Schüler ab 16 Jahren vorschlagen, könnten sie auch bei jüngeren Schülern (ab 14) eingesetzt werden.
Mireia Guell Serra, Spanien