Il mercurio: una soluzione tossica Understand article
Traduzione di Francesco Marchi Sigrid Griet Eeckhout, del Centro Europeo sulla Radiazione di Sincrotrone di Grenoble, in Francia, studia le cause della tossicità dei composti del mercurio, avvalendosi dei raggi-X come strumento per risolvere il mistero.

Immagine cortesemente messa a
disposizione da Mark Evans/
iStockphoto
I metalli costituiscono circa il 75% di tutti gli elementi conosciuti. Essi possono formare leghe fra loro e con non-metalli; i metalli sono ampiamente usati, ad esempio, nella fabbricazione di auto e computer e nella realizzazione di autostrade e ponti. I metalli (oro, argento, rame, mercurio, stagno, ferro e piombo) erano la base su cui furono fondate le civiltà antiche. L’oro fu il primo metallo ad essere scoperto, intorno al 6000 a.C.; tracce di mercurio, invece, sono state trovate in tombe risalenti al 1600 a.C. Gli antichi Greci impiegavano il mercurio nella produzione di unguenti; i Romani lo utilizzavano per i cosmetici. Dall’inizio dell’età industriale i metalli hanno cominciato lentamente a penetrare nell’ambiente, accumulandosi nei suoli, nei sedimenti e nelle acque di superficie.
Di particolare interesse ecologico sono i metalli traccia, metalli necessari come nutrienti in piccole quantità, ma che si rivelano tossici se presenti in quantità troppo elevate negli organismi o nell’ambiente. Gli elementi traccia nutrienti includono il magnesio, il manganese, il rame e lo zinco, alcuni dei quali diventano vere e proprie sostanze nocive ad alte concentrazioni. Altri, compresi i metalli pesanti, come il mercurio, il cadmio, l’arsenico e il piombo, sono di interesse ambientale a causa della loro alta tossicità e del vasto uso industriale. Il mercurio è presente nell’ambiente in concentrazioni inferiori allo 0.1%, ma è estremamente tossico perché si lega a gruppi funzionali di vari enzimi e proteine, inibendo o alterando negativamente funzioni organiche cruciali. Il mercurio è usato per estrarre l’oro; esso, inoltre, si trova nei termometri, nell’amalgama usato dai dentisti, in termostati, relé, interruttori, barometri, misuratori di vuoto e altri apparati scientifici. La sua tossicità, tuttavia, ha destato serie preoccupazioni, e ciò ha portato ad un graduale abbandono dei termometri a mercurio in ambito clinico.
Il mercurio è un elemento traccia con sorgenti sia naturali (metallo nativo, Hg; cinabro, HgS) sia antropogeniche (cioè prodotto dall’uomo). Le sorgenti antropogeniche sono legate ad usi agricoli del mercurio (fungicidi), all’impiego in ambito metallurgico (estrazione e fusione), all’utilizzo in industrie plastiche e discariche di rifiuti. La maggior parte del mercurio nel suolo, nei sedimenti e nelle acque di superficie proviene dalla combustione di carburanti fossili. Questo metallo volatile può percorrere lunghe distanze o direttamente nella sua forma gassosa, oppure attaccandosi a piccole particelle di polvere. Il mercurio gassoso può rimanere nell’atmosfera fino ad un anno prima di esser depositato sulla terra attraverso le piogge.
Una volta depositati, i metalli e i metalloidi (elementi con proprietà sia dei metalli che dei non-metalli) vanno incontro a processi biogeochimici in prossimità della superficie, dove il suolo è costituito da una mistura di rocce, terra, acqua, aria e organismi viventi.

Immagine cortesemente messa a
disposizione da Klaas Lingbeek-van
Kranen / iStockphoto
I processi biogeochimici interessano la forma atomica del metallo (speciazione) e perciò la sua solubilità, mobilità, bioreperibilità e tossicità. Di norma, meno una specie chimica è solubile, meno è mobile e tossica. Perciò, la trasformazione di specie solubili in specie poco solubili, sia in situ che in discariche, può ridurre l’impatto dei pericolosi metalli pesanti sugli organismi viventi e sull’ambiente.
micro-organismi possono trasformare i metalli per mezzo di processi di ossido-riduzione o attraverso altre reazioni chimiche. Un esempio è costituito dal cromo esavalente, Cr(VI), una forma molto pericolosa di cromo idro-solubile. L’ingestione di grandi quantità di Cr(VI) può causare disturbi allo stomaco e ulcere, convulsioni, danni ai reni e al fegato, varie forme di cancro e perfino la morte. Per contro, il cromo trivalente, Cr(III), è un micronutriente essenziale, che aiuta il corpo ad utilizzare zucchero, proteine e grassi. Il Cr(III) non è solubile in acqua; la riduzione di Cr(VI) in Cr(III) tramite micro-organismi lo rende insolubile in acqua, limitando così la sua disponibilità e tossicitàw1.
Questo tipo di trasformazione può avvenire anche in senso inverso. Nel suolo, organismi microscopici possono trasformare la forma meno velenosa di mercurio, quella inorganica (che non contiene carbone) in una forma organica (che contiene carbone), che è velenosa. In questa reazione, chiamata metilazione, un atomo (tipicamente un atomo di idrogeno) è rimpiazzato da un gruppo metile (-CH3). Il metilmercurio (CH3Hg+) essendo uno ione positivo, si combina rapidamente con anioni come lo ione cloruro (Cl–), lo ione idrossido (OH–) o lo ione nitrato (NO3–).
La trasformazione del mercurio in un composto di metilmercurio produce un metallo che diventa lipofilico (cioè solubile nei grassi) e può perciò passare attraverso le membrane cellulari, la barriera sangue-cervello e la placenta. In questa forma organica può entrare nella catena alimentare e accumularsi nel pesce, negli animali che si cibano di pesce e nell’uomo. In altre parole, la forma del mercurio meno velenosa, quella inorganica, che normalmente sarebbe eliminata in modo sicuro dagli organismi, si trasforma in una forma organica che diventa disponibile e velenosa.
Ma come avviene questa trasformazione del mercurio dalla forma meno velenosa a quella velenosa? Ricercatori svedesi ed americani che lavorano al Centro Europeo sulla Radiazione di Sincrotrone (ESRF) hanno impiegato la luce di sincrotrone per caratterizzare la speciazione del mercurio in materia naturale organica, in concentrazioni rilevanti per l’ambiente, usando tecniche di spettroscopia ad assorbimento di raggi-X (XAS) (see box).
Essi hanno scoperto che il mercurio, che si trova in suoli naturali organici, si lega a gruppi organici ridotti di solfuro, principalmente i tioli (-SH). Il gruppo tiolo è l’equivalente, nel caso dei solfuri, del gruppo idrossile (-OH), che si trova negli alcoli. Esperimenti di laboratorio indicano che le specie inorganiche di mercurio-tiolo e mercurio-solfuro determinano il tasso di metilazione. Questo significa che l’instaurarsi di un legame tra il mercurio e gruppi tiolo in materia naturale organica rende l’elemento disponibile per processi di metilazione ad opera di batteri presenti nell’ambiente. Inoltre, a causa della loro solubilità, questi complessi mercurio-tiolo divengono mobili, e possono essere trasportati in punti dove vivono batteri in grado di portare avanti la metilazione.
Il passo successivo per le ricerche sulla trasformazione del mercurio nella sua forma velenosa è quello di identificare il ruolo giocato dalle diverse molecole che contengono solfuro, frequentemente presenti in materia organica del suolo.
L’impiego di tecniche di tipo XAS per caratterizzare la speciazione del mercurio è piuttosto nuova. Si tratta di un grande passo in avanti, soprattutto se paragonato a precedenti metodi biochimici (in cui si lavorava in fase liquida), ed è la prima volta che concentrazioni così basse di mercurio (0.1 grammi di mercurio per 1000 grammi di suolo) sono state misurate.
Riuscire a decifrare la chimica di metalli e metalloidi traccia presenti nell’ambiente è piuttosto difficile perché i materiali naturali sono complessi, per struttura e per composizione. Con l’avvento di sorgenti avanzate di luce di sincrotrone, che garantiscono una maggiore risoluzione spaziale grazie all’impiego di raggi-X di alta intensità, gli scienziati sono in grado di determinare sia le forme e le distribuzioni dei metalli in sistemi eterogenei (come diversi tipi di terreno o piante), sia le interazioni minerale-microbo-metallo. A questo scopo possono essere applicate congiuntamente tre tecniche micro-analitiche. La tecnica a fluorescenza di micro-raggi-X (vedi riquadro) può mappare le distribuzioni dei diversi metalli e aiutare ad identificare le associazioni di metalli (Figura 3). In seguito, la specie che ospita il metallo (come un campione di terreno o di minerale) è determinata in punti di interesse sulle mappe chimiche attraverso diffrazione a micro-raggi-X e micro-XAS. La figura di diffrazione riproduce la struttura interna del materiale. La proporzione di ciascuna specie nel volume del metallo è poi calcolata tramite combinazione lineare delle diverse specie componenti (in altre parole sommando le quantità presenti negli spettri).
In conclusione, le tecniche che impiegano raggi-X sono estremamente preziose nella determinazione delle forme e delle distribuzioni dei metalli nei suoli, nei sedimenti e nelle acque di superficie. Una volta appresa la speciazione del metallo, possiamo cercar di capire come limitare la sua solubilità e biodisponibilità. Con la continua crescita della popolazione e delle economie mondiali, specialmente nei paesi in via di sviluppo, la richiesta di metalli continuerà a crescere, ma il loro uso aumenterà i rischi di contaminazione per suoli e acque. Poiché questo potrebbe avere serie conseguenze per la salute umana e per la qualità dell’ambiente, gli studi ambientali sono estremamente importanti.
tecniche a raggi-X (per lettori avanzati)
Per una semplice spiegazione di queste tecniche vedi Capellas (2007).
Spettroscopia ad assorbimento di raggi-X (XAS)
I raggi-X sono luce con energia compresa tra i 500 elettronvolt (eV) circa e i 500 keV (1 keV è equivalente a 1000 eV).
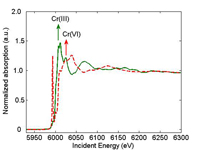
di raggi-X di un campione di Cr(III)
(verde) e di Cr(VI) (rosso). La freccia
indica la posizione del picco di
assorbimento. au=unità arbitrarie.
Cliccare sull’immagine per ingrandire
Immagine cortesemente messa a
disposizione da Sigrid Griet Eeckhout
In una misura di spettroscopia a raggi-X (XAS) viene variata l’energia dei raggi-X incidenti. Quando l’energia del raggio-X incidente uguaglia l’energia di legame di un elettrone dei livelli più interni (generalmente un elettrone 1s), l’elettrone viene espulso dall’atomo. Il corrispondente spettro di assorbimento dei raggi-X mostra una ripida salita, nota come picco di assorbimento (Figura 1). La posizione del picco di assorbimento è determinata dallo stato di ossidazione della specie. Ad esempio, il picco di assorbimento del Cr(VI) è ad un’energia maggiore di quello del Cr(III). L’elettrone espulso interagisce con gli atomi circostanti, dando origine ad oscillazioni nello spettro oltre il picco. Queste oscillazioni forniscono informazioni sugli atomi circostanti.
Poiché in ogni atomo gli elettroni dei livelli più interni hanno energie di legame caratteristiche ben definite, la tecnica XAS è elemento-specifica. Questo significa che è possibile studiare un elemento specifico (ad es. il mercurio) all’interno di un campione di materia eterogenea, come ad esempio terreni composti da materia organica, microbi, minerali, metalli ed altro ancora.
Lo spettro XAS varia a seconda dello stato di ossidazione (che riflette il numero degli elettroni disponibili per formare legami con altri atomi), della chimica di coordinazione (ad esempio coordinazione ottaedrica o tetraedrica), delle distanze, del numero di coordinazione e delle specie atomiche che circondano l’elemento prescelto.
Fluorescenza a raggi-X
Il fatto che le energie di legame caratteristiche di un elemento siano ben definite costituisce una sorta di impronta digitale dell’elemento nella tecnica della fluorescenza a raggi-X. L’osservazione di un picco ad una particolare energia è indice che l’elemento corrispondente è presente (Figura 2).
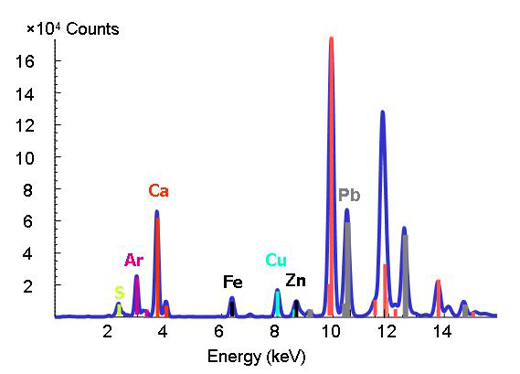
Immagine cortesemente messa a disposizione dall ESRF
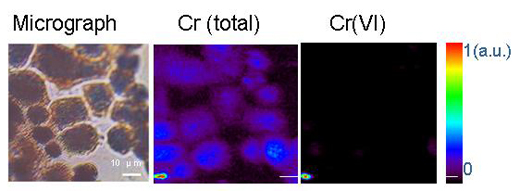
Riprodotto col permesso di Chemical Research in Toxicology. Copyright (2005) American Chemical Society
References
- Capellas M (2007) Recuperare Pompei. Science in School 6. www.scienceinschool.org/2007/issue6/pompeii/italian
- Skyllberg U, Bloom PR, Qian J, Lin CM, Bleam WF (2006) Complexation of mercury(II) in soil organic matter: EXAFS evidence for linear two-coordination with reduced sulfur groups. Environmental Science & Technology 40: 4174-4180
- Questo articolo è stato scelto fra più di 1100 articoli in Environmental Science and Technology come il principale contributo del 2006 per quanto riguarda le scienze ambientali.
Web References
-
w1 –Per una discussione sul cromo in riferimento al film Erin Brockovich, vedi:
Stevens J (2007) Erin Brockovich. Science in School 4. http://www.scienceinschool.org/2007/issue4/erinbrockovich/italian
Resources
- Una breve spiegazione dell’uso della luce di sincrotrone all’ESRF è disponibile al seguente indirizzo web: www.scienceinschool.org/2006/issue1/maryrose#esrf
- Per informazioni sull’ESRF, vedi: www.esrf.eu





