Due enzimi idrolitici ed un approccio storico-epistemologico Teach article
Traduzione di Isabella Marini. Perché gli enzimi sono così speciali? Cosa li rende diversi dai catalizzatori inorganici? Isabella Marini dell’Università di Pisa, Italia, descrive un protocollo sperimentale di scoperta guidata che consente agli studenti di rispondere a queste domande.

alcuni dei suoi studenti del
Liceo Scientifico Ulisse Dini
di Pisa
Immagine gentilmente
concessa da Isabella Marini
La storia e l’epistemologia possono aiutarci ad insegnare scienze?
I miei studenti, quando introduco loro l’idea di reazione chimica, ragionano in termini alchemici, non chimici: osservando una reazione pensano in termini di trasmutazione (come facevano gli alchimisti) e non di trasformazione (come fanno i chimici). Nell’apprendere i nostri studenti ripercorrono le tappe fondamentali dello sviluppo delle conoscenze umane; questo è un processo critico che noi docenti non possiamo trascurare.
Gli insegnanti non devono fare lezioni specifiche di storia della scienza, ma è importante che siano consapevoli della sua importanza. La storia della scienza e l’epistemologia (la filosofia della conoscenza) sono fondamentali perché, insieme alla psicologia, ci aiutano a capire cosa è adatto ad ogni fase del processo educativo. Sapere che l’uomo ha osservato per secoli alcuni fenomeni dandone un’interpretazione che poi non si è rivelata corretta e che la soluzione di questi nodi concettuali è alla base delle discipline scientifiche, ci aiuta a capire che molti argomenti sono incomprensibili per i nostri studenti senza un approccio graduale ai significati.
Quando introduco l’idea di enzima ai ragazzi del biennio di scuola superiore, cerco di guidarli a scoprire autonomamente cosa rende gli enzimi così speciali ed importanti. Ho scelto l’amilasi e l’invertasi, due enzimi facilmente reperibili la cui attività catalitica può essere facilmente evidenziata ad occhio nudo senza bisogno di strumenti sofisticati.
Cenni storici
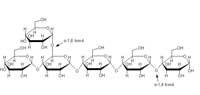
schematica dell’amido.
L’amilasi catalizza
l’endoidrolisi dei legami
glicosidici α(1-4)
Immagine gentilmente
concessa da Isabella Marini
Nel 1812, Kirchhoff riuscì ad idrolizzare l’amido scaldandolo in presenza di acido solforico. Sorprendentemente durante la reazione il pH non variava; quindi l’acido non prendeva parte alla reazione, sebbene la sua presenza fosse indispensabile per l’idrolisi.
Venti anni dopo Payen and Persoz, grazie ad una precipitazione in etanolo, isolarono dall’orzo germinante una sostanza bianca, amorfa e solubile in acqua (Payen & Persoz, 1833). Questa sostanza in grado di idrolizzare l’amido fu chiamata diastasi. In seguito il suo nome fu cambiato in amilasi, ma da allora il suffiso -asi è rimasto a far parte del nome di quasi tutti gli enzimi che conosciamo.
Nel 1835 Berzelius dimostrò che l’estratto di orzo germinante catalizzava l’idrolisi dell’amido molto più efficacemente rispetto all’acido solforico. Coniò il termine catalisi. Piccolissime quantità di un catalizzatore erano in grado di aumentare la velocità di una particolare reazione senza essere consumate. La velocità delle reazioni biochimiche poteva essere spiegata grazie al concetto di catalizzatore; nelle cellule c’erano degli speciali catalizzatori capaci di operare in condizioni blande. Questa è la stessa idea che è alla base di questi esperimenti.
Le amilasi
Per utilizzare l’amido sia come riserva energetica che come precursore metabolico, l’apparato digerente umano deve idrolizzare il polimero in carboidrati più piccoli. L’ α-amilasi salivare (1,4-α-D-glucan glucanoidrolasi; codice Enzyme Commission (EC) 3.2.1.1) è responsabile della digestione iniziale dei polisaccaridi in bocca (il processo viene poi completato nell’intestino dall’amilasi pancreatica). E’ una glicoproteina monomerica calcio-dipendente, capace di idrolizzare il legame glicosidico α(1,4) dell’amido (vedi figura).
La β-amilasi (1,4-α-D-glucan maltoidrolasi, EC 3.2.1.2) catalizza l’idrolisi del legame glicosidico α(1,4) dell’amido, rimuovendo unità di maltosio dall’estremità non riducente della catena polisaccaridica. E’ una delle principali proteine che si trovano nell’endosperma dei semi di orzo (Hordeum vulgare) ed è un enzima chiave per l’idrolisi dell’amido nel processo di produzione della birra.
L’invertasi
L’invertasi o saccarasi (saccarosio-α-D-glucoidrolasi; EC 3.2.1.48) catalizza l’idrolisi di saccarosio e maltosio. Il saccarosio, il comune zucchero da cucina, è un disaccaride formato da una molecola di α-D-glucosio ed una di β-D-fruttosio legate mediante un legame glicosidico α1-β2. Quando questo legame viene idrolizzato si ottiene una miscela equimolare di glucosio e fruttosio (vedi figura). Nel lievito (Saccharomyces cerevisiae), l’invertasi è presente sia in una forma intracellulare che extracellulare.
Protocolli sperimentali
Materiali
- Tampone fosfato 50 mM, pH 7 (tampone A). Si prepara solubilizzando 3.55 g di fosfato di sodio dibasico (Na2HPO4) in acqua distillata e portando il pH a 7.0 (con un pHmetro) con acido cloridrico (HCl) prima di portare a 500 mL con acqua distillata.
- Soluzioni in tampone A: amido 10 g/L, saccarosio 0.1 M, glucosio 0.1 M e fruttosio 0.1 M.
- Reattivo di Lugol N/50. 20 g KI e 12,7 g di iodio ed acqua distillata fino ad 1 L. Questa soluzione va diluita 1:5 con acqua distillata.
- Reattivo di Fehling A (7 g CuSO4 in 100 mL di acqua distillata) e B (34 g tartrato di sodio e potassio e 12 g di NaOH in 100 mL di acqua distillata).
- 5 M idrossido di sodio (NaOH)
- 5 M acido cloridrico (HCl)
- Saliva. Nella saliva, l’a-amilasi è già in soluzione e non ha bisogno di omogenazione. E’ sufficiente diluirla 1:10 col tampone A.
- Isolamento della b-amilasi dall’orzo. I semi di orzo germinati da 3-5 giorni vengono omogenizzati con un mortaio ed un pestello col tampone A (circa 1 g di semi/mL di tampone). Questo estratto va centrifugato per 5 minuti a 15.000xg; il sovranatante costituisce il nostro estratto di β-amilasi. Se non si dispone di una centrifuga si può utilizzare la parte solubile dell’omogenato dopo averla filtrata.
- Soluzione di lievito 0.4 g/L nel tampone A (lievito di birra, si trova facilmente al supermercato).
Metodi
Il test di Lugol
Lo iodio in soluzione acquosa forma con l’amido un complesso colorato ad alta sensibilità e specificità. Il complesso iodio-amido è blu-violetto mente le amilodestrine ed il maltosio, in presenza di iodio, sono rispettivamente rosa o incolori.
Il test di Fehling
Se riscaldata in presenza di zuccheri riducenti (come glucosio o fruttosio, ma non saccarosio o amido), una soluzione alcalina di ioni Cu2+ è ridotta a Cu+ formando un precipitato colorato giallo-rosso di Cu2O.
Procedure
Per mettere a punto il metodo, saggiare le quattro soluzioni di carboidrati (amido, saccarosio, glucosio e fruttosio) sia col test di Fehling che col Lugol. L’amido è il substrato dell’amilasi; il saccarosio è il substrato dell’invertasi, mentre glucosio e fruttosio ne sono i prodotti.
Le amilasi
L’idrolisi dell’amido è testimoniata sia dalla scomparsa del colore blu in presenza di Lugol, che dalla presenza del precipitato rosso-arancione col test di Fehling.
Sia per l’α-amilasi (saliva) che per la β-amilasi (estratto d’orzo), preparare sette provette con 2 mL di tampone A e 400 µL di soluzione d’amido. Poi procedere per ciascuna provetta con il trattamento indicato nella Tabella 1.
|
Provetta |
HCl |
Saliva o estratto d’orzo |
Scaldare sul Bunsen per: |
Lasciare a temperatura ambiente per: |
|---|---|---|---|---|
|
1* |
2 gocce |
|
5 min |
|
|
2* |
2 gocce |
|
|
5 min |
|
3 |
|
|
5 min |
|
|
4 |
|
|
|
5 min |
|
5 |
|
0.5 mL |
|
5 min |
|
6* |
2 gocce |
0.5 mL |
|
5 min |
|
7 |
|
0.5 mL** |
|
5 min |
Dividere in due parti il contenuto di ciascuna provetta: saggiare una parte con due gocce di Lugol e l’altra con µL di Fehling A e 500 µL di Fehling B. Inserire i risultati dei test nella Tabella 3.
Per mostrare la specificità dell’amilasi ripetere la procedura indicata per la provetta 5, sostituendo la saliva con 300 µL dell’estratto di lievito (il lievito non contiene amilasi).
L’invertasi
Preparare sette provette con 1 mL di tampone A e 0.5 mL di soluzione di saccarosio. Poi procedere per ciascuna provetta con il trattamento indicato nella Tabella 2.
|
Provetta |
HCl |
Saliva o estratto d’orzo |
Scaldare sul Bunsen per: |
Lasciare a temperatura ambiente per: |
|---|---|---|---|---|
|
1* |
1 goccia |
|
5 min |
|
|
2* |
1 goccia |
|
|
5 min |
|
3 |
|
|
5 min |
|
|
4 |
|
|
|
5 min |
|
5 |
|
1 mL |
|
5 min |
|
6* |
1 goccia |
1 mL |
|
5 min |
|
7 |
|
1 mL** |
|
5 min |
Saggiare ciascuna provetta con 500 µL di Fehling A e 500 µL di Fehling B.
Inserire i dati sperimentali ottenuti nella Tabella 3.
|
Provetta |
α-amilasi (saliva) |
β-amilasi (estratto d’orzo) |
Invertasi |
||
|---|---|---|---|---|---|
|
Test Lugol |
Test Fehling |
Test Lugol |
Test Fehling |
Test Fehling |
|
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
4 |
|
|
|
|
|
|
5 |
|
|
|
|
|
|
6 |
|
|
|
|
|
|
7 |
|
|
|
|
|
Per evidenziare la specificità dell’inverstasi, ripetere la procedura prevista per la provetta 5 , sostituendo l’estratto di lievito con 500 µL di saliva diluita 1:10.
Sicurezza
Questi esperimenti non utilizzano nè generano sostanze pericolose, tranne HCl o NaOH. Questi reagenti e la saliva devono essere maneggiati con cura, indossando i guanti. E’ opportuno indossare una mascherina quando si pesa lo iodio, poiché sublima. La solubilizzazione dell’amido va fatta a caldo, quindi richiede attenzione, così come il riscaldamento delle provette sul becco Bunsen.
Risultati
Sia l’idrolisi dell’amido che quella del saccarosio si possono osservare solo utilizzando condizioni drastiche, ovvero sia in presenza di acido cloridrico che del trattamento termico. Preso singolarmente nessuno dei due trattamenti è efficace.
In condizioni blande (senza aggiungere acido né riscaldare) la saliva, l’estratto di orzo e l’estratto di lievito sono in grado di idrolizzare i rispettivi substrati. Anzi sia il riscaldamento che il trattamento con l’acido prevengono l’idrolisi: gli estratti sono termolabili e sensibili all’abbassamento del pH.
Discussione
Paragonare le condizioni drastiche richieste dalla catalisi chimica (pH estremi e/o temperatura elevata) con quelle blande degli estratti biologici fa nascere nei ragazzi l’idea di una “sostanza speciale e potente” presente nei viventi, termolabile, specifica (al contrario dei catalizzatori inorganici) e capace di catalizzare le reazioni. L’ipotesi che viene formulata è che nelle cellule i processi chimici avvengano in condizioni moderate proprio per la presenza di particolari invisibili sostanze: l’idea embrionale di catalizzatore biologico. In questo modo gli studenti possono ripercorrere la prima tappa dello sviluppo storico del concetto di enzima; il termine enzima non sembrerà più loro oscuro perché “…le parole possono isolare e conservare un significato solo allorché esso è stato in precedenza implicato nei nostri contatti diretti con le cose” (Dewey, 1910).
Ringraziamenti
Desidero ringraziare il Professor Umberto Mura del Dipartimento di Biologia dell’Università di Pisa per il suo costante incoraggiamento. Ringrazio anche la collega Prof. Rosanna Striccoli per la revisione in inglese del manoscritto ed anche i miei alunni per le loro preziose osservazioni ed i loro dubbi.
References
- Dewey J (1910) How we think. Boston, MA, USA: D.C. Heath & Co
- Payen A, Persoz JF (1833) Mémoire sur la diastase, les principaux produits de ses reactions et leur applications aux arts industriels. Annales de chimie et de physique 53: 73-92
Resources
- Marini I (2005) Discovering an accessible enzyme: salivary α-amylase. Prima digestio fit in ore: a didactic approach for high school students. Biochemistry and Molecular Biology Education 33: 112-116. doi:10.1002/bmb.2005.494033022439
- Inhelder B, Piaget J (1958) The Growth of Logical Thinking from Childhood to Adolescence. New York, NY, USA: Basic Books
- Voet D, Voet JG (2004) Biochemistry, 3rd Edition. Hoboken, NJ, USA: J. Wiley & Sons
- van der Maarel MJ et al. (2002) Properties and applications of starch-converting enzymes of the alpha-amylase family. Journal of Biotechnology 94: 137-155. doi:10.1016/S0168-1656(01)00407-2





