Miért mérgező a higany? Understand article
Fordította: Adorjánné Farkas Magdolna. Sigrid Griet Eeckhout aki a franciaországi Grenoble-ben működő European Synchrotron Radiation Facility (Európai Szinkrotron-sugárzási Létesítmény) munkatársa, azt vizsgálja, hogy miért mérgezőek a higanyvegyületek – és hogyan lehet…

Mark Evans/ iStockphoto szíves
hozzájárulásával
A kémiai elemek 75 %-a a fémek közé tartozik. Egymással és egyes nem-fémes elemekkel ötvözeteket alkotnak és széles körben alkalmazzák őket, pl. autók, számítógépek, utak vagy hidak gyártásánál. Az ősi civilizációk a fémek, nevezetesen az arany, az ezüst, a réz, a higany, az ón, a vas és az ólom használatára alapultak. Az aranyat i.e. 6000 körül fedezték fel, higanyt pedig már az i.e.1600-as évekből származó sírokban találtak. Az ókori görögök a higanyt gyógykenőcsökben, a rómaiak pedig kozmetikumokban használták. Az ipari korszak kezdete óta a fémek lassan bekerülnek a környezetbe és felhalmozódnak a talajban, az üledékben és a felszíni vizekben.
Sok fém esetében már egészen kis mennyiségek jelenlétének van ökológiai jelentősége, ugyanis a fémek egy része vagy élettanilag fontos vagy mérgező. Az élettanilag nélkülözhetetlen nyomelemek közé tartozik a magnézium, a mangán, a réz és a cink, némelyik közülük nagyobb koncentrációban mérgező. Más elemek, közöttük a nehézfémek, mint például a higany, a kadmium, az arzén és az ólom már kis koncentrációban is erősen mérgezőek. Mivel az ipar széles körben használja ezeket, komoly veszélyt jelentenek a környezetre. A higany csak 0,1%-nál kisebb koncentrációban van jelen a környezetben, mégis nagyon erősen mérgező, mert a különféle enzimek és fehérjék funkciós csoportjához kapcsolódik, így gátolja, vagy megváltoztatja ezeknek a kulcsfontosságú vegyületeknek a működését. A higanyt több helyen alkalmazzák, többek között az arany kinyerésénél, a fogtömésekhez használt amalgám ötvözetben, valamint a hőmérőkben, a termosztátokban, a relékben, a kapcsolókban, a nyomásmérőkben, és más tudományos mérőeszközökben. A fém mérgező hatása miatt a higanyos lázmérőket nagyrészt száműzték a kórházakból.
A higany nyomelem, amely a természetben elemi állapotban és vegyületben is előfordul (HgS azaz cinóber). Az emberi tevékenység következtében is bekerülhet a természetbe: a vegyületeit a mezőgazdaságban gombaölőszerként alkalmazzák, az elemi higanyt fémek bányászatánál és olvasztásánál használják, valamint a műanyaggyártásnál. A szeméttelepeken is előfordul. A legtöbb higany a fosszilis energiahordozók elégetése során kerül a talajba, az üledékbe és a felszíni vizekbe. Ez a könnyen párolgó fém nagy távolságba eljut légnemű állapotban illetve a porszemek felületére tapadva. A gázhalmazállapotú higany egy évig is a légkörben maradhat, mielőtt a csapadékkal a talajra hullik.
A felszínre kerülve a fémek és a félfémek (olyan elemek, amelyek fémes és nemfémes tulajdonságokkal egyaránt rendelkeznek) gyorsan átalakulnak a bio-geokémiai folyamatok során a talajban, amely kövek, termőtalaj, víz, levegő és élő szervezetek keveréke.

Klaas Lingbeek-van Kranen / iStockphoto
szíves hozzájárulásával
A bio-geokémiai folyamatok megváltoztatják az atomok elektronszerkezetét és ezzel az oldhatóságát, mobilitását, felszívódó képességét és mérgező hatását. Szabályként megjegyezhetjük, hogy minél kevésbé oldódik egy anyag, annál kevésbé lehet mérgező. Ezért ha a vízben oldható vegyületet akár a helyszínen, akár a szemétlerakóban oldhatatlanná alakítják, ezzel csökkentik a veszélyes nehézfémek élő szervezetekre és a környezetre gyakorolt káros hatását.
A mikroorganizmusok a fémeket redoxi reakciók és más kémiai folyamatok során alakítják át. Például egy másik nehézfém, a króm a természetben kétféle oxidációs állapotban van jelen: az egyik, a hatos oxidációs állapotú Cr(VI) erősen mérgező, vízben oldódik. Ha ebből aránylag nagy mennyiség kerül az emberi szervezetbe, az gyomorpanaszokat, fekélyt, vese- és májkárosodást, görcsös rángatózást, különféle rákos megbetegedéseket, sőt halált is okozhat. A hármas oxidációs állapotú Cr(III) azonban létfontosságú nyomelem, amely a szervezetben segíti a szénhidrátok, a fehérjék és a zsírok lebontását. A Cr(III) nem oldódik vízben. Ha a mikroorganizmusok a Cr(VI) formát Cr(III)-á redukálják, akkor vízben oldhatatlanná teszik, ezért az nem szívódik fel az élő szervezetekben és nem lesz többé mérgezőw1.
Az oxidációs állapot átalakulása azonban másféleképpen is törénhet. A talajban a baktériumok a higany kevésbé mérgező szervetlen vegyületeit át tudják alakítani erősebben mérgező szerves vegyületeivé. Ennél a folyamatnál, amit metilációnak nevezünk, a vegyület egyik atomját, általában a hidrogénatomot egy metilcsoport (-CH3) helyettesíti. Így pozitív töltésű higanymetil-ion (CH3Hg+) keletkezik, amely azután összekapcsolódhat anionokkal, például klorid-ionnal (Cl–), hidroxid-ionnal (OH-) vagy nitrát-ionnal (NO3–).
Amikor a higany higanymetillé alakul át, egy olyan vegyület keletkezik, amely lipofil tulajdonságú, vagyis zsírban oldódik és így keresztül tud hatolni a sejtmembránon, a vér-agy-gáton és a placentán. Szerves vegyület összetevőjeként be tud kerülni a táplálékláncba, és fel tud halmozódni a halakban, a halevő állatokban és az emberben. Másféleképpen megfogalmazva: a kevésbé mérgező szervetlen higanyvegyületből szerves higanyvegyület keletkezik, amely felszívódhat az élő szervezetekben és mérgező azok számára.
Hogyan alakul át a kevésbé mérgező szervetlen higanyvegyület mérgező szerves higanyvegyületté? Svéd és amerikai kutatók a szinkrotronsugárzás segítségével az Európai Szinkrotron-sugárzási Létesítményben (European Synchrotron Radiation Facility, ESRF) meghatározták a higany speciációját, vagyis oxidációs állapotát a természetben jelentős mennyiségben előforduló szerves higanyvegyületeknél a röntgen abszorpciós spektroszkópia (XAS) alkalmazásával (ld. a kiegészítő anyagot box).
Úgy találták, hogy a higany a talajban lévő szerves molekulákban kétféle kéntartalmú atomcsoporthoz kötődik. Ezek közül a tiol (-SH) a fontosabb. A tiol csoport az alkoholokra jellemző hidroxilcsoport (-OH) kén tartalmú megfelelője. A laboratóriumi vizsgálatok azt mutatták, hogy az oldatok szervetlen higany-tiol és higany-szulfid tartalmától függ a metiláció mértéke. Ez azt jelenti, hogy amikor a higany a természetes szerves vegyületek tiol csoportjához kapcsolódik, akkor a környezetben előforduló metiláló baktériumok számára elérhetővé válik. Ezen felül, mivel a higany-tiol komplexek vízben oldhatóak, a talajban elvádorolhatnak olyan helyekre is, ahol a metiláló baktériumok élnek.
A következő lépés az, hogy kiderítsük, hogy mi a szerepük a higany mérgező formába alakításában a különböző kéntartalmú vegyületeknek, amelyek gyakran megtalálhatók a talaj szerves anyagában.
A röntgensugár abszorpciós spektroszkópiát (XAS) nemrégen használják a higany speciációjának megállapítására. Ez nagy előrelépés a korábbi folyékony fázisban elvégzett biokémiai módszerekhez képest. Ezzel a módszerrel már alacsony higany-koncentráció (0,1 gramm higany/ 1000 gramm talaj) is mérhető.
Nehéz megfejteni a környezetben nyomokban előforduló fémek és az átmeneti fémek kémiai viselkedését, mivel bonyolult szerkezetű összetett rendszerekben találhatók. A szinkrotron sugárforrások fejlődésével, amelyek intenzív röntgensugárzást használnak és nagyobb térbeli felbontást tesznek lehetővé, a tudósok meg tudják határozni, hogy a fémek milyen formában és milyen eloszlásban fordulnak elő egy heterogén rendszerben, például a talajban, a növényekben, vagy az ásvány-mikróba-fém kapcsolatokban. Ennek érdekében három mikroanalitikai módszert alkalmaznak együtt. A mikro-röntgensugár-flureszcencia (ld. a háttéranyagban) alkalmazásával fel tudják térképezni a különböző fémek eloszlását és kapcsolódásait (3 ábra ). Azután a fémet tartalmazó anyagot (például agyagot vagy ásványt) mikro- röntgensugár-diffrakcióval és mikro-XAS módszerrel vizsgálják. A diffrakciós mintázat megmutatja az anyag belső szerkezetét. A különböző összetevők lineáris kombinációjával határozzák meg az összetevők arányát az anyagmintában (más szavakkal, meghatározzák, hogy milyen mértékben járul hozzá a spektrumhoz.).
Összegezve, a röntgen-technikák, amelyeknél szinkrotron-sugárzást használnak, különösen alkalmasak arra, hogy a segítségükkel meghatározzák, hogy a fémek milyen formában és milyen eloszlásban fordulnak elő a talajban, az üledékben és a felszíni vizekben. Ha már tudjuk, hogy a fém milyen oxidációs állapotban fordul elő, akkor tudjuk megakadályozni, hogy oldódjon és az élőlények szervezetébe kerüljön. Mivel a Föld lakossága és a termelés folytosan növekszik, különösen a fejlődő országokban, a fémek iránti kereslet is nő. Ezért növekedni fog a talaj és a víz fémszennyezettsége. Mivel ez nagy veszélyt jelent az emberek egészségére és a környezet minőségére, ezért nagyon fontos, hogy figyelemmel kövessük a környezet állapotát.
röntgensugár-technikák (a tájékozottabb olvasóknak)
Ennek a két módszernek az egyszerű magyarázata Capellas cikkében (2007) található.
Röntgensugár abszorpciós spektroszkópia (XAS)
A röntgensugár olyan elektromágneses sugárzás, amelynek az energiája a körülbelül 500 electronvolttól (eV) 500 keV-ig (1 keV = 1000 eV) terjedő tartományban található.
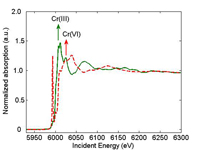
minta (piros) röntgen abszorpciós
spektruma. A nyilak mutatják az
abszorpciós csúcsokat. au =
önkényesen választott egység.
Kattincson a képre a nagyobb változatért
Sigrid Griet Eeckhout szíves hozzájárulásával
A röntgensugár abszorpciós spektroszkópiás (XAS) mérések során az anyagmintára különböző energiájú röntgensugarakat bocsátanak. Ha a röntgensugár energiája megegyezik az atommaghoz legközelebb található (általában 1s) elektronok kötési energiájával, az elektronok kilépnek az atomból. Ilyenkor a röntgensugár abszorpciós spektrumban éles csúcs jelenik meg (1. ábra). Az abszorpciós csúcs helyét az atom oxidációs állapota is módosítja. Például a Cr(VI) abszorpciós csúcsa magasabb energián jelenik meg, mint a Cr(III)-é. A kilépő elektronok kölcsönhatásba lépnek a környező atomokkal, ez az abszorpciós csúcs kiszélesedését vonja maga után. Ez a jelenség információt ad a környező atomokról.
Mivel minden atom esetében a maghoz legközelebb lévő elektronok kötési energiája jól meghatározott, az atomra jellemző érték, a XAS technika elemspecifikus. Ez azt jelenti, hogy a segítségével meg lehet állapítani, hogy tartalmazza-e az adott elemet (pl. a higanyt) egy heterogén öszzetételű anyag, mint például a talaj, amely szerves vegyületekből, mikroorganizmusokból, ásványokból, fémekből és egyéb összetevőkből áll.
A XAS spektrumból az elem oxidációs állapotára (amely azt mutatja meg, hogy az atom hány elektronnal tud kapcsolódni más atomokhoz), és a koordinációs állapotára (pl. octahedral vagy tetrahedral coordináció) is lehet következtetni, valamint arra is, hogy az atom közvetlen környezetében található többi atom milyen távol van, mennyi a koordináció száma és az oxidációs állapota.
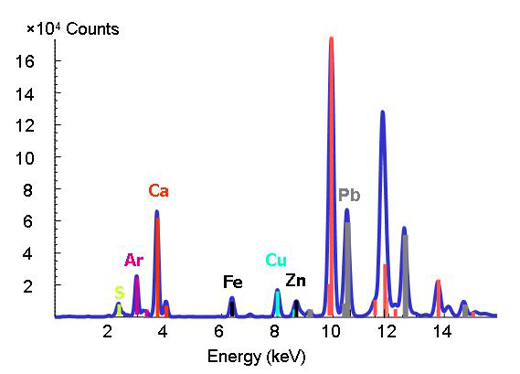
Röntgensugár fluoreszcencia
A röntgensugár fluoreszcencia segítségével jól meghatározott kötési energiák olyanok az elemeknél, mint az ujjlenyomatok. Ha megváltoztatják a röntgensugár energiáját és egy meghatározott értéknél egy csúcs jelenik meg, a kutatók ebből meg tudják állapítani, hogy a kérdéses elem jelen van a mintában (2. ábra).
ESRF szíves hozzájárulásával
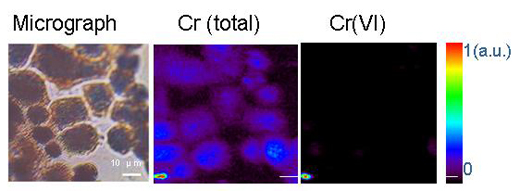
A Chemical Research in Toxicology-ból engedéllyel újranyomtatva. Copyright (2005) American Chemical Society
References
- Capellas M (2007) Fusión en el Universo: el origen de la joyería. Science in School 6. www.scienceinschool.org/2007/issue6/pompeii/hungarian
- Skyllberg U, Bloom PR, Qian J, Lin CM, Bleam WF (2006) Complexation of mercury(II) in soil organic matter: EXAFS evidence for linear two-coordination with reduced sulfur groups. Environmental Science & Technology 40: 4174-4180
- Ezt az írást az Environmental Science and Technology több mint 1100 cikke közül 2006 legjobb környezettudományi cikkének választották.
Resources
- Információk az ESRF-ről: www.esrf.eu





