Mercure: une solution qui nous empoisonne Understand article
Traduit par Maurice A.CASIMIR – IUT Aix-Marseille III Sigrid Griet Eeckhout de l’Installation Européenne de Rayonnement Synchrotron à Grenoble, France, recherche ce qui détermine la toxicité des composés du mercure – et la manière dont les rayons X durs hyper brillants aident à…

Image reproduite avec l’aimable
autorisation de Mark Evans/ iStockphoto
Les métaux représentent environ 75% des éléments connus. Ils peuvent former des alliages entre eux et avec des éléments non métalliques et sont largement utilisés, par exemple, dans les véhicules, les ordinateurs, les autoroutes et les ponts. La civilisation repose sur les métaux de l’antiquité, or, argent, cuivre, mercure, étain, fer et plomb. L’or fut isolé vers 6000 AC et du mercure a été découvert dans des tombes remontant à 1600 AC. Les anciens Grecs utilisaient le mercure en onguents; les Romains dans leurs cosmétiques. Depuis le début de la Révolution Industrielle, les métaux ont lentement pénétré l’environnement, s’accumulant dans les sols, les sédiments et les eaux de surface.
De nombreux oligo-éléments sont importants pour le milieu vivant, soit qu’ils soient nécessaires sous forme de nutriments, soit qu’ils se comportent en polluants toxiques. Les nutriments incluent le magnésium, le manganèse, le cuivre et le zinc, certains devenant toxiques à haute concentration. D’autres, incluant les éléments lourds comme le mercure, le cadmium, l’arsenic et le plomb, sont un problème pour l’environnement, du fait de leur toxicité élevée et d’une utilisation largement répandue dans l’industrie. Le mercure est présent dans l’environnement à des concentrations inférieures à 0.1%, mais il est extrêmement toxique car il se lie aux groupes fonctionnels de diverses enzymes et protéines, bloquant ou affectant ainsi négativement des fonctions organiques clé. Le mercure est utilisé dans l’extraction de l’or, et on le trouve dans des thermomètres, de l’amalgame dentaire, des thermostats, des relais, des commutateurs, des baromètres, des indicateurs de vide et autres appareils scientifiques, bien que des préoccupations au sujet de sa toxicité aient conduit à éliminer pratiquement les thermomètres à mercure du secteur hospitalier.
Le mercure est un oligo-élément que l’on trouve dans la nature (métal vierge, Hg, et cinabre, HgS) et sous forme anthropogénique (transformé par action humaine). Les sources anthropogéniques incluent des utilisations en agriculture (fongicides) et en métallurgie (exploitation minière et élaboration), le secteur des matières plastiques, la disposition finale des déchets et les centres d’enfouissement technique. La plus grande partie du mercure présent dans les sols, les sédiments et les eaux de surface provient de la combustion de combustibles fossiles. Ce métal volatil peut voyager sur de longues distances sous forme gazeuse ou en se liant à de petites particules de poussière. Le mercure gazeux peut rester dans l’atmosphère jusqu’à un an avant d’être déposé sur le sol par les précipitations.
Une fois déposés, les métaux et les métalloïdes (éléments présentant à la fois des propriétés métalliques et non métalliques) entrent dans des processus biogéochimiques dynamiques dans l’environnement proche de la surface, qui est un mélange de roches, de sol, d’eau, d’air et d’organismes vivants.

bandes de poissons
Image reproduite avec l’aimable autorisation
de Klaas Lingbeek-van Kranen / iStockphoto
Les processus biogéochimiques affectent la structure atomique du métal (spéciation), et donc sa solubilité, sa mobilité, sa disponibilité biologique et sa toxicité. En règle générale, moins un composé chimique est soluble, moins il est mobile et toxique. Par conséquent, transformer des composés solubles en formes peu solubles, soit in situ soit dans des centres d’enfouissement technique après excavation, peut diminuer l’impact de métaux lourds nocifs sur les organismes vivants et sur l’environnement.
Des micro-organismes peuvent transformer les métaux par réaction chimique d’oxydo-réduction ou autre. Un exemple en est un autre métal lourd, le chrome hexavalent, Cr(VI), qui est une forme très dangereuse de chrome, soluble dans l’eau. L’ingestion de grandes quantités de Cr(VI) peut causer des maladies de l’estomac et des ulcères, des convulsions, des lésions des reins et du foie, diverses formes de cancer et même la mort. Le chrome trivalent, ou Cr(III), de son côté, est un nutriment essentiel sous forme de trace en aidant le corps à métaboliser les sucres, les protéines et les graisses. Le Cr(III) est insoluble dans l’eau. Réduire le Cr(VI) en Cr(III) en utilisant des micro-organismes le rend insoluble dans l’eau, limitant ainsi sa disponibilité et sa toxicitéw1.
Ce type de transformation peut également intervenir dans l’autre sens. Dans le sol, des organismes microscopiques peuvent transformer la forme la moins toxique, inorganique (sans atome de carbone) du mercure en une forme toxique, organique (avec atomes de carbone). Dans une telle réaction, appelée méthylation, un atome, habituellement d’hydrogène, est remplacé par un groupe méthyle (-CH3). Sous forme d’ion chargé positivement, le méthylmercure (CH3Hg+) se combine facilement à des anions tels que chlorure (Cl–), hydroxyde (OH-) ou nitrate (NO3–).
La transformation du mercure en un composé de méthylmercure produit une forme métallique qui devient lipophile (c.à.d. qui peut se dissoudre dans une graisse) et peut ainsi passer à travers les membranes des cellules, la barrière sang – cerveau et le placenta. Sous sa forme organique, il peut pénétrer la chaîne alimentaire et s’accumuler dans les poissons, les animaux piscivores et les êtres humains. En d’autres termes, la forme la moins toxique, inorganique du mercure, qui serait normalement excrétée sans danger par les organismes, est transformée en une forme organique, présente dans ces organismes et toxique pour ceux-ci.
Alors, comment la forme de mercure la moins toxique, inorganique, se transforme-t-elle en une forme organique toxique? Des chercheurs suédois et américains ont utilisé les rayons X durs hyper brillants à l’Installation Européenne de Rayonnement Synchrotron (ESRF) pour déterminer la spéciation du mercure en composé organique naturel à des concentrations appropriées à l’environnement, en utilisant les techniques de spectroscopie d’absorption de Rayons X (XAS) (voir box encadré).
Ils ont découvert que le mercure se lie dans la matière organique naturelle du sol à deux fonctions sulfurées organiques réduites, principalement des thiols (-SH). La fonction thiol est l’équivalent soufré de la fonction hydroxyle (-OH) des alcools. Des expériences de laboratoire montrent qu’un thiol neutre, inorganique lié au mercure et des composés sulfurés du mercure en solution déterminent les vitesses de méthylation. Cela signifie que la liaison du mercure à des fonctions thiol dans de la matière organique naturelle rend l’élément apte à l’action des bactéries de méthylation dans l’environnement. En outre, comme ces complexes mercure – thiol sont solubles, ils peuvent être rendus mobiles et transportés dans des endroits où vivent les bactéries de méthylation.
La prochaine étape sera d’identifier le rôle que les différentes molécules contenant du soufre que l’on trouve fréquemment dans la matière organique du sol jouent dans la transformation du mercure en sa forme toxique.
L’utilisation de la XAS pour caractériser la spéciation du mercure est pratiquement nouvelle. Il s’agit d’un grand pas en avant si on le compare aux méthodes biochimiques par voie humide antérieures (en phase liquide) et c’est la première fois que l’on a pu mesurer des concentrations de mercure (0.1 gramme de mercure par 1000 grammes de sol) aussi faibles.
Décrypter la chimie des métaux et métalloïdes en trace dans l’environnement est difficile car les matériaux naturels sont d’une composition et d’une structure complexes. Avec l’arrivée de sources de rayons X durs hyper brillants, qui fournissent des techniques utilisant des rayons X de forte intensité et une meilleure résolution spatiale, les scientifiques sont capables de déterminer les formes et les distributions des métaux dans des systèmes hétérogènes tels que les sols, les plantes ainsi que les interactions composé minéral – microbe – métal. Pour ce faire, on peut appliquer ensemble trois techniques de microanalyse. Le spectromètre à micro fluorescence X (voir encadré) permet de dresser la carte des distributions des différents métaux et aide à identifier des associations de métaux (figure 3). On détermine ensuite les supports du métal (comme l’argile ou un composé minéral) en des points intéressants sur la carte chimique par micro diffraction aux rayons X et micro XAS. L’image de diffraction montre la structure interne du matériau. La proportion de chaque composé dans le matériau brut est ensuite calculée par combinaison linéaire des différents composés (en d’autres termes, en additionnant les quantités figurant sur le spectre).
En conclusion, les techniques utilisant un synchrotron à rayons X durs hyper brillants sont extrêmement valables pour déterminer les formes et les distributions des métaux dans les sols, les sédiments et les eaux de surface. Une fois connue la spéciation du métal, on peut étudier la manière de limiter sa solubilité et sa disponibilité biologique. Alors que la population et les économies mondiales continuent à croître, en particulier dans les pays en développement, les besoins en métaux augmenteront, mais leur utilisation amplifiera le risque d’une contamination du sol et de l’eau. Comme cela pourrait avoir des implications sérieuses sur la santé humaine et la qualité de l’environnement, les études sur cet environnement sont extrêmement importantes.
Techniques utilisant des Rayons X (pour lecteurs avertis)
Pour une explication simple de ces deux techniques, voir Capellas (2007).
Spectroscopie d’absorption de Rayons X (XAS)
On utilise des Rayons X durs hyper brillants avec des énergies allant de ~500 électron volts (eV) à 500 keV (1 keV est équivalent à 1000 eV).
X-rays are light with energies ranging from ~500 electron volts (eV) to 500 keV (1 keV is equivalent to 1000 eV).
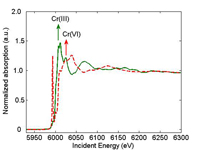
Rayons X d’un échantillon de Cr(III)
(vert) et d’un échantillon de Cr(VI)
(rouge). La flèche montre la position
de la discontinuité d’absorption. au =
unité arbitraire. Cliquer sur l’image
pour l’agrandir.
Image reproduite avec l’aimable autorisation
de Sigrid Griet Eeckhout
Lorsque l’on réalise une mesure par spectroscopie d’absorption de Rayons X (XAS), on fait varier l’énergie des Rayons X incidents. Quand l’énergie du Rayon X incident est égale à l’énergie de liaison d’un électron du noyau (habituellementélectron 1s), l’électron est éjecté de l’atome. Le spectre d’absorption de Rayons X correspondant montre un pic important, également connu sous le nom de discontinuité d’absorption (Figure 1). La position de la discontinuité est également déterminée par l’état d’oxydation. Par exemple, la discontinuité intervient pour le Cr(VI) à une énergie plus élevée que pour le Cr(III). L’électron arraché agit sur des atomes voisins, créant ainsi des oscillations dans le spectre au-delà de la discontinuité. Ces oscillations fournissent des informations sur ces atomes voisins.
Comme chaque atome a dans son noyau des électrons aux énergies de liaison caractéristiques bien définies, la technique XAS est spécifique pour chaque élément. Cela signifie que l’on peut étudier un élément donné (p.e. le mercure) à l’intérieur d’un matériau hétérogène, comme un sol constitué de matière organique, microbes, sels minéraux, métaux, etc.
Le spectre XAS est sensible à l’état d’oxydation formel (qui reflète le nombre d’électrons pouvant se lier à d’autres atomes), à la chimie de coordination (p.e., coordination octaédrique ou tétraédrique), et aux distances, à la coordinence et aux types d’atomes entourant immédiatement l’élément sélectionné.
Micro fluorescence X
Les énergies de liaison caractéristiques bien définies d’un élément sont utilisées comme empreinte digitale dans la technique de micro fluorescence X . En changeant l’énergie, si l’on observe un pic pour une énergie particulière, on sait que l’élément correspondant est présent (Figure 2).
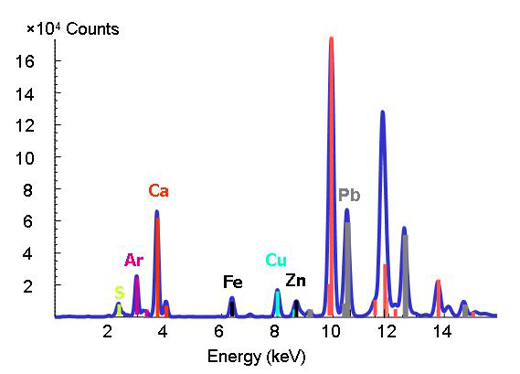
Image reproduite avec l’aimable autorisation de ESRF
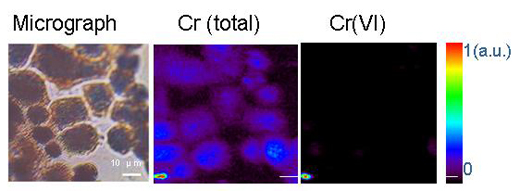
Reproduit avec l’autorisation de Chemical Research in Toxicology. Copyright (2005) American Chemical Society
References
- Capellas M (2007) Recovering Pompeii. Science in School 6: 14-19. www.scienceinschool.org/2007/issue6/pompeii
- Skyllberg U, Bloom PR, Qian J, Lin CM, Bleam WF (2006) Complexation of mercury(II) in soil organic matter: EXAFS evidence for linear two-coordination with reduced sulfur groups. Environmental Science & Technology 40: 4174-4180
- Cet article a été choisi parmi plus de 1100 articles de Environmental Science and Technologycomme contribution majeure aux sciences de l’environnement en 2006.
Web References
-
w1 –Pour une discussion sur l’action du chrome avec référence au film Erin Brockovich, voir:
Stevens J (2007) Erin Brockovich. Science in School 4: 67-69. www.scienceinschool.org/2007/issue4/erinbrockovich
Resources
- Une brève explication de l’utilisation des rayons X durs hyperbrillants à l’ESRF est disponible dans: www.scienceinschool.org/2006/issue1/maryrose#esrf





