Regarder vers le ciel: expériences sur le changement climatique Teach article
Traduit par Camille Ducoin. Dudley Shallcross, Tim Harrison, Steve Henshaw et Linda Sellou proposent dans ce nouvel article des expériences de physique et chimie sur l'exploitation de l'énergie solaire et la mesure des taux de dioxyde de carbone.

l’aimable autorisation d’
Alohaspirit / iStockphoto
Le thème du changement climatique peut conduire à aborder de nombreux sujets en classe de science; mais la question des différentes sources d’énergie et de leurs conséquences aura probablement un rôle. La discussion pourra inclure les différents types de combustibles qui peuvent être utilisés, leur efficacité, comment ils sont produits; les alternatives à la combustion; l’énergie solaire; l’importance du dioxyde de carbone dans le réchauffement global. Nous proposons ici deux activités expérimentales pour accompagner les cours de physique et chimie sur le changement climatique. Trois activités sur les combustibles ont été publiées dans Shallcross et al (2009).
1) Les cellules de Grätzel: l’énergie venue du Soleil
Le Soleil, bien sûr, est source de la plupart de l’énergie utilisée sur Terre, outre l’énergie géothermique et nucléaire – y compris celle qui provient des combustibles fossiles ou “verts”. La lumière solaire est aussi utilisable directement comme source d’énergie: on peut démontrer cela en classe en utilisant des cellules de Grätzel, également appelées “cellules solaires nanocristallines à pigments” ou “cellules solaires organiques”. Baptisées d’après leur inventeur, l’ingénieur suisse Michael Grätzel, ces cellules convertissent directement la lumière solaire en électricité par photosynthèse artificielle. Pour cela, elles utilisent des pigments naturels présents, par exemple, dans les cerises, mûres, framboises et cassis. Ces pigments rouges-violets, appelés anthocyanesw1, peuvent facilement être extraits des fruits et feuilles par les élèves: il suffit de les faire bouillir dans un petit volume d’eau, puis de filtrer.
Ces cellules sont très prometteuses, car elles sont faites de matériel peu coûteux et peuvent être produites sans appareillage sophistiqué. Bien que leur efficacité de conversion soit plus faible que celle des meilleures cellules à couche mince, leur rapport performance/prix est suffisamment élevé pour les rendre compétitives face aux combustibles fossiles pour la production d’électricité. Les applications commerciales, qui ont été retardées par des problèmes de stabilité chimique, sont maintenant annoncées sur la feuille de route photovoltaïque de l’Union Européennew2 comme une contribution significative à la production d’électricité renouvelable d’ici à 2020.
Les cellules de Grätzel séparent les deux fonctions remplies par le silicium dans une cellule traditionnelle: normalement, le silicium agit comme source de photoélectrons, tout en fournissant le champ électrique qui sépare les charges et crée le courant. Dans une cellule de Grätzel, le semi-conducteur est utilisé seulement pour le transport des charges, tandis que les photoélectrons sont fournis séparément par un pigment photosensible (l’anthocyane). La séparation de charge a lieu à la frontière entre le pigment, le semi-conducteur et l’électrolyte.
Les molécules de pigment sont assez petites (de l’ordre du nanomètre); ainsi, pour capter une quantité raisonnable de lumière incidente, il faut une couche assez épaisse de ces molécules – beaucoup plus épaisse que leur taille. Pour traiter ce problème, on utilise un nano-matériel comme armature pour maintenir un grand nombre de molécules de pigment dans une matrice 3D, augmentant ainsi le nombre de molécules présentes par unité de surface de la cellule. Dans les modèles existants, cette armature est fournie par le matériel semi-conducteur (oxyde de titane), qui remplit ainsi une double fonction.
Les cellules de Grätzel peuvent être fabriquées de toute pièce, mais il est difficile de se procurer le verre pré-traité de façon à avoir une face conductrice. De plus, il faut les passer au four pendant environ 24 heures pour faire pénétrer la pâte d’oxyde de titane dans la surface de verre. Ainsi, il est plus facile d’utiliser un kit commercial comme ceux proposés par la compagnie allemande Mansolarw3, qui permettent d’assembler six cellules de Grätzel pour environ 80 Euros. Si toutefois vous avez déjà de l’expérience avec l’équipement requis et que vous préférez construire vos propres cellules de Grätzel, voici une description de la procédure:
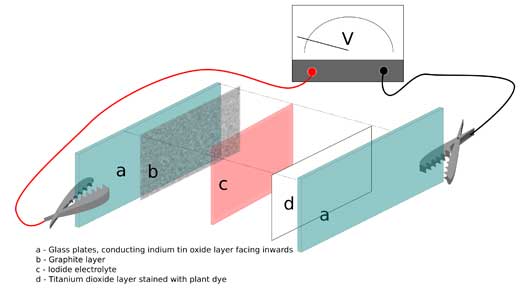
Image reproduite avec l’aimable autorisation de Marcus Medley, Bristol ChemLabS
- Prenez deux plaques de verre, chacune ayant à peu près la taille d’une plaque de microscope, avec une face couverte d’oxyde d’indium-étain de façon à conduire l’électricité.
- L’une des plaques doit, par cuisson, fixer du dioxyde de titane sur sa face non- traitée. Le dioxyde de titane forme une structure très poreuse, présentant une grande surface disponible où le pigment peut se fixer. Attention: la poudre de dioxyde de titane peut facilement être arrachée de la plaque de verre; bien que l’on puisse acheter la pâte de dioxyde de titane, les heures de cuisson nécessaires pour former une nouvelle couche sont peu commodes. Il faut donc manipuler avec précaution. La solution la plus facile est d’acheter du matériel pré-fabriqué.
- Recouvrez l’autre plaque d’une couche de graphite de crayon, simplement en frottant la pointe d’un crayon sur la face non traitée du verre.
- Remplissez une boîte de Petri avec du pigment anthocyane. Induisez le dioxyde de titane de pigment photosensible en plaçant la plaque correspondante dans le récipient, puis séchez avec un séchoir à cheveux. Le pigment reste attaché à la surface du dioxyde de titane par des liaisons covalentes. Après utilisation, il est facile de retirer les pigments anthocyanes en utilisant de l’éthanol ou du propanone (acétone).
- Assemblez la cellule de bas en haut, de la façon suivante:
- En bas, placez la plaque avec graphite, la face graphite vers le haut: ce sera la cathode.
- Comme électrolyte, utilisez une solution d’iodure de potassium, qu’il faut introduire entre les plaques.
- En haut, placez la plaque pigmentée, la face couverte d’oxyde d’indium-étain vers le haut. L’ oxyde d’indium-étain servira d’anode transparente.
- Utilisez un trombone pour maintenir les plaques jointes.
- Utilisez deux pinces crocodiles prolongées de fils électriques pour connecter chacune des plaques de la cellule de Grätzel à un voltmètre (voir image), et pouvoir prendre des mesures.
- Mettez la cellule à la lumière. Si vous expérimentez le dispositif dans un pays du Nord pendant l’hivers, une lampe de microscope ou de bureau pourra être utile pour intensifier la lumière.
- Utilisez un photomètre pour déterminer l’intensité lumineuse reçue par les cellules de Grätzel.
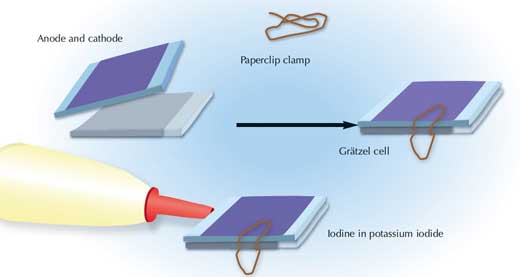
Image reproduite avec l’aimable autorisation de Nicola Graf
Vous pouvez vous amuser à utiliser des cellules de Grätzel pour faire fonctionner différents appareils. Par exemple, vous pouvez remplacer les piles d’une machine à calculer par un circuit de plusieurs petites cellules de Grätzel; ou encore, alimenter avec ces cellules un circuit de carte d’anniversaire musicale, ou un petit moteur.
- Des anthocyanes issus de différentes sources
- Des pigments végétaux autres que les anthocyanes
- Des solutions contenant différentes concentrations d’anthocyanes
- L’aire de la surface de dioxyde de titane exposée aux anthocyanes
- La température des cellules
- La fréquence de la lumière (en utilisant des filtres de couleur)
- L’intensité de la lumière (en utilisant une lampe de microscope comme source lumineuse)
- Plusieurs cellules en série ou en parallèle.
Les détails sur les mécanismes chimiques à l’oeuvre dans ces cellules se trouvent dans un article en lignew4.
2) Détecter les taux de gaz carbonique dans l’atmosphère
liaisons. Cliquez pour
agrandir l’image
Image reproduite avec
l’aimable autorisation de
Marcus Medley, Bristol
ChemLabS
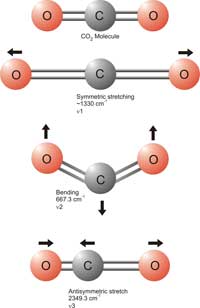
Le CO2 est le plus connu des gaz à effet de serre, et l’une des principales préoccupations dans les discussions sur le changement climatique. On peut se demander comment les taux de CO2 sont mesurés dans les échantillons d’air, d’autant que la concentration de ce gaz est faible: la réponse réside dans la spectroscopie infra-rouge. Les molécules de dioxyde de carbone absorbent des fréquences spécifiques de rayons infra-rouges qui, selon leur énergie, affectent les liaisons covalentes entre atomes de carbone et d’oxygène. Les énergies les plus basses provoquent une inclinaison des liaisons, les énergies les plus élevées les étirent. Les fréquences impliquées sont situées dans la partie infra-rouge du spectre électromagnétique (nombre d’ondes compris entre 4000 et 650 cm-1 – le nombre d’ondes est l’inverse de la longueur d’onde: c’est une unité couramment employée en spectroscopie infra-rouge). Cet effet peut être utilisé pour déterminer la concentration en CO2, de la façon suivante.
Il existe deux principaux types de détecteurs de dioxyde de carbone (voir Harrison et al, 2006). Les détecteurs destinés à la recherche, plus coûteux, pompent l’air à travers la partie sensible; les appareils les moins chers utilisent la diffusion de l’air. L’air passe dans une cellule absorbante, qui consiste en un petit cylindre noir situé à l’intérieur du détecteur.
À l’une des extrémités du détecteur est située une source de lumière infra-rouge couplée à un filtre de longueur d’onde, de façon à fournir une bande étroite autour du nombre d’ondes 2350 cm-1 À l’autre extrémité du tube se trouve un détecteur de rayons infra-rouges: un compteur de photons qui mesure l’intensité de la lumière infra-rouge. Plus il y a de molécules de CO2 dans l’échantillon, plus le rayonnement est absorbé, et moins il y a de rayons infra-rouges atteignant le détecteur. Pour de petites absorptions, la loi de Beer-Lambert nous donne:
Concentration = (1-(I/I0)) / σl
où:
- l est la distance parcourue (longueur de la cellule)
- σ est la section efficace d’absorption par le CO2 du rayonnement de longueur d’onde utilisée; ce nombre est connu avec une grande précision
- (I/I0) est le rapport entre l’intensité du rayonnement infra-rouge détecté après traversée de l’échantillon d’air (I), et celle qui est détectée lorsque la cellule est vide (I0)

de dioxyde de carbone
Image reproduite avec
l’aimable autorisation de Bristol
ChemLabS
L’intensité I0 n’est pas déterminée à chaque mesure, mais doit être vérifiée assez fréquemment pour s’assurer qu’il n’y a pas de trop grandes fluctuations dans l’intensité de production de la lumière infra-rouge.
Les élèves qui ont utilisé de tels détecteurs, prêtés par l’Université de Bristol, ont été surpris de mesurer un taux de CO2 plus élevé dans une salle de classe vide qu’à l’extérieur, et bien supérieur aux 0.037% (0.037/100 x 1 x 106 = 370 ppm) rapportés dans les livres pour la concentration atmosphérique. Il se trouve que les nouveaux bâtiments scolaires du Royaume Uni ont des fenêtres qui n’ont pas été conçues pour s’ouvrir, ainsi le CO2 expiré s’accumule!
Les détecteurs de CO2 utilisés par les élèves sont réglés sur le nombre d’ondes 2349, correspondant à un étirement asymétrique des liaisons du CO2(Harrison et al, 2006). Un étirement asymétrique a lieu lorsque les doubles liaisons entre carbone et oxygène (C=O) absorbent de l´énergie, et l’une des doubles liaisons s’allonge tandis que l’autre se contracte (voir schéma). Pour le CO2 il ne peut y avoir qu’un étirement asymétrique; celui-ci est particulièrement important car le dioxyde de carbone est la seule molécule présente en grande quantité dans l’atmosphère à absorber du rayonnement de nombre d’ondes 2349. Ainsi, seule l’absorption par le CO2 peut causer un changement d’intensité de la lumière infra-rouge émise à cette fréquence.
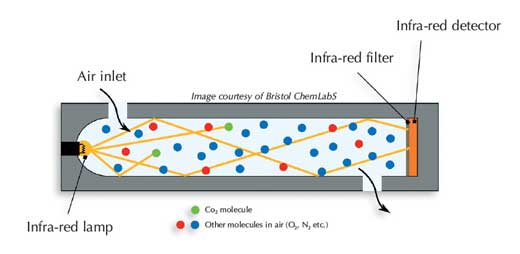
Image reproduite avec l’aimable autorisation de Bristol ChemLabS
Bristol ChemLabS serait intéressé de recevoir des demandes d’autres écoles en Europe qui souhaiteraient emprunter l’un de ces détecteurs faciles à utiliser, pour effectuer des mesures de taux de dioxyde de carbone dans des échantillons d’air. Bien que ces appareils puissent se trouver dans le commerce, ils sont assez chers, et ne se trouvent pas couramment dans les établissements scolaires.
References
- Harrison T, Shallcross D, Henshaw S (2006) Detecting CO2 – the hunt for greenhouse-gas emissions. Chemistry Review 15: 27-30
- Shallcross D, Harrison T (2008a) Modélisation du changement climatique en classe. Science in School 9. www.scienceinschool.org/2008/issue9/climate/french
- Shallcross D, Harrison T (2008b) Practical demonstrations to augment climate change lessons. Science in School 10: 46-50. www.scienceinschool.org/2008/issue10/climate
- Shallcross D, Harrison T, Henshaw S, Sellou L (2009) Fuelling interest: climate change experiments. Science in School 11: 38-43. www.scienceinschool.org/2009/issue11/climate
Web References
- w1 – Pour plus d’informations sur les anthocyanines et leurs fonctions naturelles, voir sur Wikipédia: http://en.wikipedia.org/wiki/Anthocyanin
- w2 – La feuille de route photovoltaïque 2002 de l’Union Européenne peut être téléchargée sur le site PV-NET (http://paris.fe.uni-lj.si/pvnet) ou à l’adresse: http://tinyurl.com/n8cwfv
- w3 – L’un des fournisseurs de kits de cellules de Grätzel est la compagnie allemande Mansolar: www.mansolar.com
- w4 – Pour en savoir plus sur les mécanismes chimiques à l’oeuvre dans les cellules de Grätzel, voir le site de la Royal Society of Chemestry (www.rsc.org) ou l’adresse: http://tinyurl.com/mr3bec
Resources
- Pour une liste complète des articles de Science in School sur le changement climatique, voir: www.scienceinschool.org/climatechange
- Pour une liste complète des articles de Science in School sur l’énergie, voir: www.scienceinschool.org/energy
- SchoolCO2Web fournit des informations et du matériel scolaire pour la mesure et le partage de données sur le dioxyde de carbone entre écoles en Europe: http://fwn-school-co2-net.hosting.rug.nl
Review
Cet article est un bon complément de la précédente trilogie d’articles écrite par les mêmes auteurs, sur le changement climatique (Shallcross et al, 2008a) et les expériences à réaliser en classe (Shallcross et al, 2008b, 2009). Cette fois-ci, les auteurs soulignent l’aspect technologique du changement climatique. Ils proposent des activités pratiques: une possible alternative aux cellules solaires conventionnelles, et une recherche sur les taux de CO2 présents dans différents environnements en utilisant un équipement professionnel qu’ils proposent de prêter à d’autres écoles.
Je recommande cette série d’articles aux enseignants de science du secondaire qui recherchent un sensemble complet de matériel didactique pour aborder le sujet complexe du changement climatique, réchauffement global et ressources énergétiques. Le style est abordable pour des lecteurs non anglosaxons, et les références Internet permettent d’en apprendre davantage sur le sujet. Cet article est aussi un bon point de départ pour envisager un curriculum scientifique interdisciplinaire stimulant.
Suggestions de questions de compréhension:
- Laquelle des affirmations suivantes sur les anthocyanes est vraie?
- Elles peuvent réaliser une photosynthèse artificielle
- Elles réalisent la photosynthèse dans les plantes
- Elles sont utilisées dans les cellules à films minces
- Elles sont chimiquement stables
- Laquelle des affirmations suivantes sur le dioxyde de titane est fausse?
- Il agit comme un semi-conducteur
- Il fournit une armature 3D pour les molécules de pigment
- Il doit être cuit sur la surface du verre
- Il conduit l’électricité
- Les capteurs de dioxyde de carbone mesurent
- L’effet de serre
- L´absorption de la lumière infra-rouge
- la pollution de l’air
- l’absorption de la lumière UV
Giulia Realdon, Italie





