La grande migration Understand article
Pourquoi les cellules sont-elles comme les gnous? Laura Spinney explore la migration des cellules et la formation des organes à l'aide du poisson-zèbre, fin et transparent.
Chaque année en mai de grandes hordes de gnous se déplacent depuis les plaines sèches de l’Est africain vers les forêts à la recherche de nourriture. Ils reviennent en novembre, quand les faibles pluies arrosent à nouveau la plaine, terminant ainsi leur migration annuelle. Chaque gnou se comporte selon son instinct de survie, qui le pousse à rechercher la compagnie des autres gnous. Une fois qu’une horde est formée, elle se comporte comme une nouvelle unité, avec ses propres règles. Les cellules ont le même instinct de groupe. Elles sont génétiquement programmées pour travailler avec d’autres cellules, mais il n’y a pas d’ensemble figé d’instructions qui détermine un comportement précis pour chaque cellule d’un embryon. « Nous nous rendons compte maintenant que de nombreux événements qui arrivent après la fécondation sont en quelque sorte libres, plastiques, et basés sur des principes d’auto-organisation» dit Darren Gilmour du Laboratoire Européen de Biologie Moléculaire (EMBL) d’Heidelberg, en Allemagne.
En tant que biologiste du développement Darren souhaiterait comprendre ces principes faisant qu’une masse de cellules en migration parvient à donner naissance à une sculpture de systèmes complexes et intriqués comme ceux des vaisseaux sanguins ou du système respiratoire. Comme les cellules, dans ces groupes en migration, semblent être identiques vis-à-vis des gènes exprimés, le fait de supprimer (inactiver complètement) ou d’inactiver (réduire l’activité) de certains gènes conduit à stopper la migration de tout le groupe. Il doit alors utiliser une approche plus subtile, en cherchant des moyens de rompre le réseau social cellulaire et en observant comment ceux-ci affectent leur capacité à migrer et à construire des organes. « C’est fondamentalement social» dit-il. « Nous voulons savoir qui dit à qui de faire quelque chose et comment il le dit ».

Image reproduite avec l’aimable autorisation de Darren Gilmour, EMBL
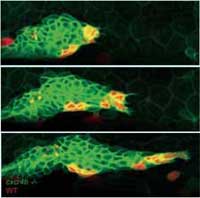
Le groupe de Darren explore ces principes au niveau du primordium de la ligne latérale du poisson-zèbre, une structure transitoire qui ne peut être vue qu’au début du développement, et dont la fonction est d’équiper le poisson-zèbre d’organes contenant des cellules ciliées – organes sensitifs qui lui permettent de détecter la présence d’autres poissons au moindre changement de la pression de l’eau. «Le primordium est un amas de plus de 100 cellules qui rampent sous la peau de l’animal comme une limace» explique Darren. « Il commence derrière l’oreille, se déplace en direction de la queue, et laisse une traînée d’environ deux cellules d’épaisseur, ponctuée de petits amas de cellules qui deviendront éventuellement des organes à cellules ciliées».
En tant que système vivant modèle, le poisson-zèbre est la réponse aux prières des biologistes, du fait de sa transparence et donc du confortable suivi visuel des cellules marquées par des protéines fluorescentes. Le système de la ligne latérale est relativement facile à concevoir génétiquement, et est aussi en quelque sorte un cadeau pour ceux qui s’intéressent à la migration des cellules., parcequ’il utilise des mécanismes de signalisation très importants dans la santé humaine et donc très étudiés. Un signal chimique nommé SDF1, l’équivalent chez le poisson-zèbre d’un signal que l’on trouve chez les humains, provoque une série de changements dans les cellules primordiales en se fixant à un récepteur appelé Cxcr4b que la cellule possède à sa surface. Cxcr4b est une protéine qui traverse la membrane cellulaire. Elle est notamment nécessaire à l’infection du VIH chez l’homme. En plus de son rôle dans le développement elle est aussi impliquée dans les métastases et la dispersion des cellules tumorales.
L’équipe de Darren a montré que, chez un mutant de poisson-zèbre chez qui le signal Cxcr4b est réduit, le primordium perdait son orientation directionnelle – il n’y a plus de mouvement en avant et le primordium ne laisse plus de traînée de cellules en arrière. De plus, la structure devenue statique, semble cesser de produire de nouveaux amas de cellules. Un des traits les plus surprenants chez ce mutant est que, bien que la migration du primordium soit stoppée, une observation fine montre que ses cellules bougent encore, se heurtant les unes aux autres de façon apparemment désordonnée.
Pour essayer de « soigner » le mutant et de restaurer la progression du primordium, les chercheurs ont fabriqué une mosaïque génétique en transplantant des cellules normales, qui expriment le récepteur Cxcr4b, et peuvent donc répondre au signal SDF1a, à l’intérieur d’un tissu « mutant ». Les cellules normales et « mutées » furent marquées en rouge et en vert respectivement afin de pouvoir les suivre. Très rapidement, et ce malgré le mouvement désordonné des cellules dans le primordium, les cellules sensibles au signal trouvent leur chemin vers l’avant et le primordium reprend sa progression.
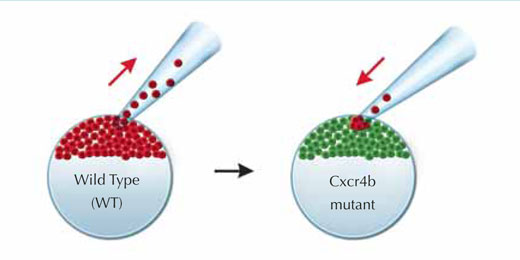
Schémas reproduites avec l’aimable autorisation de Petra Riedinger, EMBL
les cellules sauvage (en rouge)
trouvent leur chemin vers
l’extrêmité du primordium et
progressent en avant en tirant
avec elles les cellules mutantes
(en vert)
Image reproduite avec l’aimable
autorisation de Darren Gilmour, EMBL
Ce qui est étrange dans ces expériences, dit Darren, c’est que toutes les cellules exprimant la protéine Cxcr4b, et donc sensibles au signal SDF1, ne vont pas vers l’extrémité du primordium. Dès que quelques unes de ces cellules sont là, le mouvement désordonné cesse et le primordium progresse vers l’avant. Les cellules sensibles qui n’ont pas migré vers l’avant du primordium restent là où elles sont -«comme figés dans la glace»-. « Nous pensons que le système alors instable trouve un point d’ancrage» dit-il. « Il tourne sur lui et fait des mouvements désordonnés, ce qui lui permet d’être sûr que les cellules qui peuvent guider la progression sont bien en position de leader. Et lorsqu’elles tirent, les autres se figent.»
Mais qu’est ce qui fait qu’une cellule est guide, puisque toutes les cellules sensibles ne deviennent pas des guides ? D’abord cela ne semble pas être une différence dans l’activité des gènes. « Ce ne sont pas les gènes qui disent, tu es un guide, tu es une suiveuse” dit Darren. «C’est plutôt que les gènes équipent toutes les cellules avec le récepteur et ensuite c’est un problème de lutte entre elles». «Avec sa collaboratrice Petra Haas, il pense que la dominance doit probablement être définie par la nature instable du groupe. Les mouvements désordonnés des cellules conduisent à une sorte d’attirance mutuelle temporaire pour les cellules du fait de la proximité de la source du signal. Ensuite elles s’y accrochent et, si elles sont capables de maintenir l’activation de leur récepteur, elles progressent vers l’avant. De toute façon ceci n’est pas le fin mot de l’histoire.
Une théorie de la migration cellulaire consiste à dire que les cellules guides transportent en quelque sorte les autres qui se laissent entraîner. Cependant Darren est sceptique vis-à-vis de ce modèle qu’il désigne comme celui de l’auto-stoppeur. Il préfère penser que les guides indiquent aux autres la bonne direction, et que le primordium est organisé de façon à ce que les autres suivent. Il pense qu’un principe semblable doit s’appliquer au développement de tous les organes. « Si on regarde le branchement des vaisseaux sanguins, je prédis que l’on trouvera un petit nombre de cellules à l’avant qui sont sensibles au signal environnemental et qu’ensuite, par des interactions avec les autres cellules, elles influencent leur comportement» dit-il. «Les autres n’ont pas à voir le monde». Il fait l’analogie avec un faucon guettant une nuée d’étourneaux. Tous les oiseaux n’ont pas besoin de voir le faucon pour répondre par la fuite, ils n’ont besoin que de détecter la panique des voisins.
Pour l’instant tout va bien mais l’histoire se complique parce que les suiveurs ne se comportent pas tous de la même façon. Dans leurs expériences avec prise de vue sur le vivant, Darren et son équipe ont noté que, alors que les cellules de l’avant progressaient, les cellules de queue ralentissaient, conduisant ainsi le tissu à se tendre. Le thésard Guillaume Valentin vient d’identifier un autre récepteur, exprimé dans ces cellules de queue, qui répond aussi à SDF1a, mais qui conduit à un comportement différent de celui du mécanisme SDF1a/Cxcr4b – en donnant à ces cellules un certain degré d’indépendance par rapport aux cellules guide.
Quand le primordium progresse en déposant des amas de cellules en arrière, le mouvement global des cellules au sein du primordium est celui d’un recul. Darren suggère que les cellules reculant changent de récepteur. Peut-être, propose-t-il, que la combinaison des deux populations exprimant chacune un récepteur donne lieu à une sorte de mouvement capillaire dans lequel le front et la queue du primordium change alternativement. Des indices de ce processus viendraient d’expériences réalisées avec des embryons de poisson-zèbre dont l’activité de ce second récepteur est réduite et, pour la moitié d’entre eux, chez qui le mouvement coordonné manque. «La tête tire et tire mais la queue ne suit pas et parfois elle renonce et retourne à la queue » dit-il.
Si cela est exact, ces résultats posent des questions sur la manière dont l’information dynamique est transmise entre toutes les cellules du groupe. Il devient nécessaire de comprendre non seulement la signalisation mais la propagation des forces à travers des populations cellulaires, en terme d’interactions de cellule à cellule. C’est vers cela que Darren espère maintenant porter son effort. Pour l’instant la découverte du second récepteur SDF1a dans le primordium du poisson-zèbre l’enthousiaste. «L’idée selon laquelle les cellules internes peuvent aussi être sensibles est entièrement nouvelle» dit-il. Si ce même principe peut être appliqué aux gnous, c’est une autre histoire.
Resources
- Haas P, Gilmour D (2006) Chemokine signaling mediates self-organizing tissue migration in the zebrafish lateral line. Developmental Cell 10: 673-680. doi: 10.1016/j.devcel.2006.02.019
Institutions
Review
J’ai été ravie d’être sollicitée pour commenter cet article, car sinon j’aurais pu ne pas le lire avec autant d’attention. Il est si bien écrit, avec de nombreuses comparaisons imagées, comme celle de la migration des cellules dans l’organisme en développement avec la migration des troupeaux d’animaux en Afrique. Il n’y a pas que la biologie a être fascinante ici, avec les protéines-signal, l’infection à HIV, le poisson-zèbre, les cellules cancéreuses et les cellules mutantes « aveugles », mais la description des méthodes employées par une équipe de recherche, qui se lit comme un roman policier, l’est tout autant, avec ses théories, le rejet des modèles, la venue de nouvelles idées et les expériences pour les mettre à l’épreuve.
Cet article est fort intéressant pour la plupart des professeurs de biologie. Il peut aussi servir d’exercice de compréhension ou de complément de cours de qualité pour des étudiants en biologie à partir de 16 ans. D’un autre côté il peut être utilisé dans des dicussions portant sur l’embryologie, le développement des vertébrés, le génie génétique, la communication entre cellules par rapport à la communication entre organismes, les protéines-signal, le cancer, les mutations, les étapes de la recherche scientifique ou encore de l’élaboration des modéles théoriques.
Sue Howarth, Royaume Uni





