Untersuchung der Wirkung von Urease Teach article
Übersetzt von: Maren Lorenzen (www.ezy-traduction.com). Anna Lorenc vom Volvox-Projekt erklärt die Bedeutung des Enzyms Urease und beschreibt einen Versuch zur Demonstration der Ureasewirkung im Unterricht.
von Alamy
Enzyme spielen im Stoffwechsel aller Organismen eine wesentliche Rolle. Sie katalysieren und kontrollieren die meisten biochemischen Reaktionen in unserem Körper – von der Verdoppelung der genetischen Information (DNA-Polymerase) bis hin zur Verdauung. Jedoch kann Enzymaktivität nicht immer ohne Weiteres sichtbar gemacht werden. Hier wird ein einfacher und günstiger Versuch vorgestellt, der dabei helfen soll, das Thema „Enzymaktivität“ im Unterricht zu behandeln. Alle benötigten Materialien sind einfach zu beschaffen und ungefährlich.
Im hier beschriebenen Versuch spaltet das aus Sojabohnen (Glycine max) gewonnene Enzym Urease Harnstoff in Ammoniak und Kohlendioxid:
CO(NH2)2 + H2O → 2 NH3 + CO2
Ammoniak (NH3)-Lösung hat einen hohen pH-Wert, der sich mit einem einfachen pH-Indikator nachweisen lässt. Einen solchen Indikator kann man beispielsweise aus Rotkohl gewinnen. Das erzeugte Ammoniak kann außerdem über den Geruch nachgewiesen werden.
Da Urease von zahlreichen verschiedenen Organismen erzeugt wird, kann dieser Versuch bei folgenden Lehrstoffthemen eingesetzt werden:
- Der Stickstoffkreislauf
- Der Einfluss von Organismen auf ihre Umwelt
- Die Anpassung von Tieren an unterschiedliche Nahrung
Grundlagen
Was ist Harnstoff?
Alle Organismen zersetzen Nukleinsäuren und Proteine und erzeugen dabei stickstoffhaltigen Abfall, denn Nukleinsäuren und Proteine enthalten Stickstoff. Säugetiere, Amphibien und einige Wirbellose scheiden Stickstoffabfälle als Harnstoff aus, der in der Leber hergestellt wird. Harnstoff ist zur Beseitigung von Stickstoff besonders geeignet, da er wasserlöslich und weniger giftig als Ammoniak ist, dem Ausscheidungsprodukt der Fische. Menschlicher Urin enthält 2 % Harnstoff.
Harnstoff war auch die erste künstlich hergestellte organische Verbindung. Friedrich Wöhler synthetisierte im Jahr 1828 Harnstoff aus anorganischen Verbindungen (Bleicyanat und Ammoniumhydroxid). Damit war ein Meilenstein erreicht: Bis dahin glaubte man, dass nur lebende Organismen in der Lage seien, organische Verbindungen herzustellen. Man dachte, diese Verbindungen seien etwas Besonderes und benötigten eine „lebendige Kraft“ für ihre Erzeugung. Wöhler überbrückte die Kluft zwischen der lebenden und der nicht-lebenden Welt. Er bekam trotzdem nicht den Nobelpreis für diese Entdeckung, da dieser damals noch nicht existierte. Heute wird Harnstoff in großen Mengen synthetisiert: Er wird bei der Kunststoffherstellung verwendet und als billiger Stickstoffdünger.
Was ist Urease?
Urease katalysiert die Hydrolyse von Harnstoff in Kohlendioxid und Ammoniak. Sie kommt hauptsächlich in Samenkörnern, Mikroorganismen und Wirbellosen vor. In Pflanzen ist Urease ein Hexamer – sie besteht aus sechs gleichen Ketten – und befindet sich im Zytoplasma. In Bakterien besteht sie entweder aus zwei oder aus drei Untereinheiten. Zur Aktivierung muss Urease zwei Nickelionen pro Untereinheit binden.
Wie wurde Urease berühmt?
Urease aus Jackbohnen (Canavalia ensiformis) war das erste Enzym überhaupt, das gereinigt und kristallisiert wurde. Dies gelang James B. Sumner im Jahr 1926, zu einer Zeit, als die meisten Wissenschaftler glaubten, es sei unmöglich, Enzyme zu kristallisieren. Dafür bekam Sumner 1946 den Nobelpreis für Chemie. Heute nutzen Wissenschaftler die Kristallisation von Proteinen, um ihre Struktur zu erforschen und ihre Funktionsweise zu verstehen. Dieses Wissen ermöglicht die Entwicklung von Substanzen, die mit Enzymen wechselwirken, wie beispielsweise Medikamente gegen AIDS, die die Wirkung von HIV-Enzymen behindern oder kürzliche Entwicklungen einer möglichen Behandlung von Tollwut (Ainsworth, 2008).
Welchem Zweck dient Urease in Sojabohnen?

Mit freundlicher Genehmigung
von iStockphoto
Die Rolle von Urease in Sojabohnen ist nicht völlig geklärt, obwohl es Vermutungen darüber gibt. In Sojablättern ist ebenfalls Urease enthalten, jedoch hat das Enzym hier eine tausendfach geringere Aktivität als in den Bohnen. Es ist bekannt, dass die Blattenzyme dabei helfen, den Stickstoff der Proteine zu recyceln (die Proteine werden in Harnstoff zersetzt). Wenn die Bohnen keimen, erfüllt die Urease dort dieselbe Aufgabe. Das Ammoniak, das bei dieser Reaktion entsteht, schützt möglicherweise gleichzeitig die Pflanze gegen Krankheitserreger – es scheint, als würde das Pflanzenenzym selbst als Insektizid wirken.
Wo findet man Urease noch?
Viele Bakterienarten – einschließlich Helicobacter pylori, verantwortlich für Magengeschwüre – erzeugen Urease. Auf diese Weise erhöht H. pylori den pH-Wert der Magensäure von etwa 3 auf 7, den optimalen pH-Wert für sein Wachstum. Ein kommerziell erhältlicher Test auf H. pylori prüft, ob Urease in der Atemluft vorhanden ist, und wird so für die Diagnose von Magengeschwüren verwendet.
Wiederkäuer (wie Kühe und Schafe) haben in ihrem Pansen – dem ersten ihrer verschiedenen Mägen – Zellulose verdauende Bakterien, die ihnen bei der Verdauung ihrer pflanzlichen Nahrung helfen. Die Wiederkäuer sondern Harnstoff in diesen Teil des Magens ab. Diese Harnstoff ist eine exzellente Stickstoffquelle für die Bakterien. Um den Stickstoff aufzunehmen, scheiden die Bakterien Urease aus und spalten den Harnstoff. Anschließend verdauen die Tiere die Bakterienmasse.
Ist die in Sojabohnen enthaltene Urease für Menschen gefährlich?
Urease ist nicht schädlich. In rohen Sojabohnen sind jedoch andere Stoffe enthalten, die die Gesundheit gefährden, wie zum Beispiel ein Protein-Hemmstoff (ein Protein-Inhibitor), der das Verdauungsenzym Trypsin in seiner Arbeit behindert und rohe Sojabohnen ungenießbar macht. Der Hemmstoff ist nicht einfach nachzuweisen, ist aber glücklicherweise ähnlich hitzeempfindlich wie Urease – beide werden durch Erhitzen inaktiviert. Um sicherzustellen, dass der Hemmstoff inaktiviert ist, werden deshalb kommerzielle Sojaprodukte (Sojamehl oder Lebensmittel, die Soja enthalten wie Tofu und Tempe, ein Grundnahrungsmittel in Indonesien) in ähnlicher Weise auf Ureaseaktivität getestet, wie es hier beschrieben wird. Wenn keine Ureasewirkung nachgewiesen werden kann, ist der Hemmstoff vermutlich ebenfalls inaktiviert.
Urease im Stickstoffkreislauf
Stickstoff ist ein für das Pflanzenwachstum wesentliches Element, aber die meisten Pflanzen können ihn nur in Form von Ammonium oder Nitrat aufnehmen. Nur Leguminosen (dank der Bakterien, mit denen sie in Symbiose leben) und Cyanobakterien können elementaren Stickstoff aus der Luft aufnehmen.
Viele Tiere scheiden Harnstoff mit dem Urin aus. Mikroorganismen im Boden ernähren sich von tierischem Urin, wobei sie Urease erzeugen, um Harnstoff in Ammoniak umzuwandeln, der dann wiederum für Pflanzen verfügbar ist. Dies ist Teil des Stickstoffkreislaufes, dem Prozess bei dem Stickstoff aus Proteinen und anderen Verbindungen immer wieder recycelt wird.
Der Versuch
Anhand dieser Versuchsanleitung können Schülerinnen und Schüler die Aktivität von Pflanzenenzymen in Saatkörnern nachweisen. Wenn das Substrat (Harnstoff) vorhanden ist, spaltet Urease es in Kohlendioxid und Ammoniak auf. In Wasser gelöst erhöht Ammoniak den pH-Wert – ein Effekt, der mit Rotkohl als pH-Indikator sichtbar gemacht wird. Im Experiment erkennen die Schülerinnen und Schüler, dass sowohl ein Substrat (Harnstoff) als auch ein Enzym (Urease) notwendig sind, um das Produkt (Ammoniak) zu erhalten. Sie beobachten, dass die Enzymaktivität den pH-Wert erhöht.
Rotkohlauszug – ein großartiger pH-Indikator
In diesem Versuch verwenden wir Rotkohlauszug als pH-Indikator. Er enthält Anthozyanine. In Lösung sind sowohl Struktur als auch Farbe dieser Verbindungen pH-abhängig. Bei einem pH-Wert von 7 ist die Lösung violett/blau, im sauren Bereich wird sie rot. Wenn der pH-Wert auf über 7 ansteigt und die Lösung also basischer wird, wird der Auszug grün. Diese Farbänderungen sind reversibel. Das lässt sich leicht überprüfen, indem Zitronensäure und Backpulver (Natriumbikarbonat) nacheinander zugegeben werden.
Materialien und Ausrüstung
Für jede/n Schüler/in oder jede Gruppe von Schüler/innen:
- 20 ml 10%ige Harnstoffdünger-Lösung (Harnstoffdünger: ein festes Düngemittel aus reinem Harnstoff)
- 5 ml 10%ige Zitronensäure (oder andere Lösung mit niedrigem pH-Wert)
- 5 ml 10%ige Natriumbikarbonat-Lösung (NaHCO3) (oder andere Lösung mit hohem pH-Wert)
- 40 ml Rotkohlindikator, wie unten beschrieben vorbereitet
- 10 ml Sojabohnenauszug, wie unten beschrieben vorbereitet (aus 1g getrocknete Sojabohnen)
- 10 destilliertes Wasser
- Pasteurpipetten oder ein Plastikstrohhalm, um die Lösungen umzufüllen
- 6 Reagenzgläser und ein Reagenzglasständer
Für die Vorbereitung des Sojabohnenauszugs und des Rotkohlindikators werden ein Stabmixer, kochendes Wasser, Kaffeefilter und ein Trichter benötigt.
Zeitrahmen
Das Experiment kann innerhalb von 30 Minuten vollständig durchgeführt werden.
Der Sojabohnenauszug und der Rotkohlindikator können entweder vorher vorbereitet oder aber deren Herstellung kann im Unterricht vorgeführt werden. Dies dauert nur 10 Minuten. Denken Sie aber daran, dass die Sojabohnen vor dem Unterricht mindestens eine Stunde lang in Wasser eingeweicht werden müssen.
Die Reaktion zwischen der Urease aus den Sojabohnen und dem Harnstoff dauert ebenfalls etwa 10 Minuten.
Vorbereitung
Rotkohlindikator
- Zwei große Rotkohlblätter in Streifen schneiden und in einen hitzbeständigen Behälter geben, zum Beispiel ein Becherglas. 200 ml kochendes Wasser darüber gießen, so dass alle Blätter vollständig bedeckt sind.
- Die Flüssigkeit nach 5 Min. umfüllen und abkühlen lassen.
- Die Blätter wegwerfen.
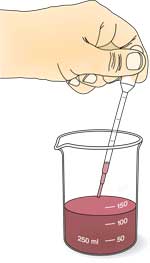

Sojabohnenauszug (enthält die Urease)
- Die Sojabohnen 1 h lang (besser über Nacht) in Wasser einweichen.
- Die eingeweichten Bohnen zusammen mit etwa 10 ml Wasser pro Gramm trockener Sojabohnen (das Einweichwasser kann hierzu verwendet werden) etwa 5 Min. lang mit dem Stabmixer pürieren, bis eine glatte Mischung entsteht.
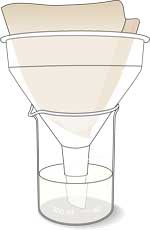
- Das Sojabohnenpüree filtern, dafür einen Kaffeefilter im Trichter verwenden.
- Das Filtrat auffangen und aufheben, es enthält Urease.


Durchführung
Die unten angegebenen Volumina sind für Standard-Reagenzgläser (≈10 ml) vorgesehen.
Zunächst sollen die Schüler/innen untersuchen, wie der pH-Wert die Farbe des Rotkohlauszugs beeinflusst:
- 3 ml Rotkohlindikator in je drei Reagenzgläser füllen.
- Zwei Tropfen Zitronensäure-Lösung in das erste Reagenzglas geben. Mischen und die Farbänderung beobachten. Nach dem Hinzufügen jeder Komponente die Pipette mit Wasser spülen.
- Zwei Tropfen Natriumbikarbonat-Lösung in das zweite Reagenzglas geben. Mischen und die Farbänderung beobachten.
- Zwei Tropfen destilliertes Wasser in das dritte Reagenzglas geben. Mischen und die Farbänderung beobachten.
- Die Farben aller drei Reagenzgläser vergleichen. Die Gläser als Referenz zur Seite stellen.
Nun wird die Wirkung von Sojabohnen-Urease auf Harnstoff untersucht.
- Je 2 ml Rotkohlindikator in drei weitere Reagenzgläser füllen.
- In zwei dieser Reagenzgläser je 2 ml Harnstoff zugeben. Die Farbe beobachten.
- Jeweils 2 ml der Soja-Suspension in eins der beiden Gläser mit Harnstoff und in das dritte Glas ohne Harnstoff geben.
- Die Farben und Gerüche der Mischungen in allen Reagenzgläsern vergleichen. Diese Beobachtungen nach 3 min wiederholen.
Interpretation
Rotkohlindikator wird mit steigendem pH-Wert grün. Dieser Farbwechsel kann, gemeinsam mit dem Ammoniak-Geruch, in dem Reagenzglas beobachtet werden, das sowohl das Enzym als auch das Substrat enthält. In Gläsern, die entweder nur das Enzym oder nur das Substrat enthalten, bleibt der pH-Wert unverändert, so dass der Rotkohlindikator violett bleibt.
Sicherheit
Etwa 1 % der Kinder kann auf Sojabohnenauszug allergisch reagieren (siehe McGee, 2004). Lehrkräfte sollten vor Beginn des Versuchs sicherstellen, dass keine/r ihrer Schüler und Schülerinnen davon betroffen sind.
Weiterführende Untersuchungen
Es kann ein hierauf aufbauendes Experiment durchgeführt werden, um die Faktoren zu untersuchen, die die Enzymaktivität beeinflussen (wie z. B. Temperatur, pH-Wert und Konzentrationen von Enzym, Substrat und Produkt).
Danksagungen
Diese Versuchsanleitung wurde von Anna Lorenc für das Volvox-Projekt entwickelt, das vom 6. Rahmenprogramm der Europäischen Kommission finanziert wird.
The Volvox project
Das Volvox-ProjektDas Volvox-Projektteam ist eine Gruppe von Biologielehrern und -lehrerinnen sowie Fachleuten aus zehn Ländern der Europäischen Union, die sich zum Ziel gesetzt haben, Biologielehrkräften von u. a. weiterführenden Schulen geprüfte Laborprotokolle, Simulationen, Anregungen zu Unterrichtsaktivitäten und zahlreiche andere Materialien zur Verfügung zu stellen. Informationen gibt es unter: www.eurovolvox.org
References
- Ainsworth C (2008) Gefangen im eigenen Leib. Science in School 8. www.scienceinschool.org/2008/issue8/rabies/german
- McGee H (2004) On food and cooking. London, UK: Hodder & Stoughton. ISBN: 0340831499
Review
Enzymaktivität wird häufig anhand der Wirkungsweise von Amylase auf Stärke untersucht, was Bezüge zu den Themen „Nahrung“ und „Ernährung“ schafft. Die hier vorgestellte einfache Methode stellt eine gute Abwechslung dar, die einen Bezug zum Stickstoffzyklus herstellt, der für die Schüler/innen häufig schwer fassbar ist. Die Idee, einen natürlichen Indikator zu verwenden, den die Schüler/innen selbst herstellen können, erhöht den Spaß am Unterricht. Außerdem können sie das Reaktionsprodukt wegen der Freisetzung von Ammoniak riechen! Die Faktoren, die die Enzymaktivität beeinflussen, können in Gruppenarbeit untersucht und in der gesamten Klasse diskutiert werden.
Das Verständnis dieser Versuchsbeschreibung kann getestet werden mit Fragen wie:
- Wieso werden die Rotkohlblätter in kochendes Wasser gelegt?
- Welche Farbe bekommt der Indikator, wenn Ammoniak in der Lösung ist?
- Beschreibe, was du sehen würdest, wenn du einen gekochten Sojabohnenauszug nehmen würdest, und erkläre den Grund dafür.
- Gib an, welches der Reaktionsgläser das „Kontrollexperiment“ ist. Erkläre, was das bedeutet. Was kannst du in diesem Reagenzglas beobachten?
Shelley Goodman, Großbritannien





