Una mirada nueva a la luz: construye tu propio espectrómetro Teach article
Traducido por Elisa Inés López Schiaffino. ¿Qué puedes hacer con una caja de cereal y un CD? Con un poquito de ayuda de Mark Tiele Westra ¡tu propio espectrómetro! Es hora de explorar el encanto de los colores, ocultos en el objeto más prosaico de todos.
Optical Astronomy
Observatory/Association of
Universities for Research in
Astronomy/National Science
Foundation
La luz blanca en realidad no es blanca – está formada por muchos colores diferentes. La composición de la luz – su espectro – se estudia con un instrumento llamado espectrómetro. En este artículo explicaremos cómo se puede construir un espectrómetro con poco más que una caja de cereal y un CD. Utilizaremos este instrumento para observar el maravilloso mundo de colores ocultos detrás de objetos de uso diario como bombillas de luz, luces fluorescentes, monitores de computadoras y llamas de velas. ¡Vamos a explorar!
Cómo separar la luz
Hay varias maneras de separar la luz blanca en los distintos colores que la componen. Una manera es usando un prisma, como hizo Newton. Debido a variaciones en el índice de refracción, distintos colores siguen caminos diferentes a través del prisma, causando la separación de colores.

aumentada 6250 veces
Imagen cortesía de Mark Tiele
Westra
Otra manera es usando una red de difracción, que consiste en muchos surcos pequeños, colocados paralelos entre sí sobre una superficie, como se muestra más abajo.
La interacción de los pequeños surcos con las ondas de luz hace que los distintos colores se reflejen en direcciones diferentes.
Afortunadamente todos tenemos redes de difracción de alta calidad en casa: los discos compactos (CD). Los hermosos colores que se ven cuando la luz se refleja sobre la superficie de un CD son un claro indicio de que éste actúa como una red de difracción. ¿Pero por qué? La ilustración de arriba muestra cómo se vería la superficie de un CD con un gran aumento. La música está grabada en surcos cortos y largos, ubicados en una larga pista espiralada sobre la superficie del CD. Las pistas, a una distancia de 1,6 µm (1600 nm) entre sí, actúan como una red de difracción.
La construcción de un espectrógrafo con una caja de cereal
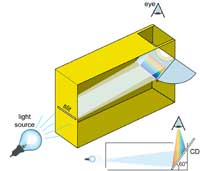
espectrómetro con una caja
de cereal. El CD está colocado
a un ángulo de 60° con
respecto al fondo de la caja
Imagen cortesía de Mark Tiele
Westra
Podemos dar buen uso a estas redes de difracción hogareñas para construir nuestro propio espectrómetro. Éste consiste en dos elementos importantes: un CD, que separa la luz en sus diferentes colores, y una rendija angosta del lado opuesto de la caja que produce un haz de luz angosto.
Se hace la rendija en un costado de la caja usando papel grueso y cinta adhesiva. Se puede hacer un modelo algo más elaborado usando dos hojas de afeitar, ubicándolas con las partes filosas enfrentadas y uniéndolas con cinta adhesiva, como se muestra en la imagen. Si la rendija es demasiado ancha, el espectro se verá borroso; y si es muy angosta, será demasiado tenue. Un ancho de 0,2 mm parece estar bien, pero se puede experimentar. La calidad de los espectros obtenidos depende de la calidad de la rendija, por eso se la debe hacer con cuidado.
Del otro lado de la caja, se coloca un CD (el autor utilizó un CD en blanco regrabable) a un ángulo de 60° con respecto al fondo de la caja. Se hace un agujero en la parte de arriba por la que se puede ver el CD. Se debe cubrir todo espacio que haya alrededor del CD con cinta oscura para reducir la dispersión luminosa.
Para observar un espectro, dirija la rendija hacia una fuente de luz (cuanto más cerca, mejor), y mire a través del agujero de arriba. Mueva la caja un poco para darse cuenta de lo que está viendo. Puede hacer fotos de los espectros observados usando una cámara digital simple con capacidad “macro” para un enfoque de primer plano, ligada a la caja con cinta o bandas elásticas. Es preferente que la cámara tenga enfoque manual, ya que obtener espectros definidos con enfoque automático puede ser difícil.
Mediciones

Imagen cortesía de Mark Tiele Westra

Imagen cortesía de Mark Tiele Westra
¡Es hora de experimentar! En nuestro primer intento, miremos el espectro de una bombilla de luz incandescente. El resultado está mostrado más abajo.
Ahora miremos dos luces fluorescentes diferentes. Ambas emiten luz blanca.
La primera, una luz fluorescente común, muestra varias líneas definidas contra el fondo de un espectro continuo. Estas líneas de emisión (ver el texto más abajo) son producidas por el vapor de mercurio de baja densidad en el tubo. El mercurio también produce luz ultravioleta, que es convertida en un espectro continuo de luz visible por una capa fina de fósforo que hay dentro del tubo.
La segunda luz fluorescente (ver más abajo) muestra un espectro muy diferente. Esto se debe a que los fabricantes pueden variar el color de la luz al usar diferentes combinaciones de fósforos. La lámpara que se muestra usa un fósforo que emite un espectro continuo, pero este tipo usa los llamados fósforos tricolores: una combinación de tres fósforos, cada uno con sus propios conjuntos de líneas de emisión. Percibimos la mezcla de color resultante como blanco.
Una pequeña sección de la pantalla de una computadora portátil con un documento Word en blanco produce el espectro que se muestra más abajo. Los tres colores de los píxeles que forman la imagen – rojo, verde y azul – son muy definidos.

Imagen cortesía de Mark Tiele Westra

Imagen cortesía de Mark Tiele Westra
Cómo se forman los espectros
Algunos de los espectros que pueden ser observados con el espectrómetro casero tienen un fondo continuo, y los colores varían suavemente del rojo oscuro al azul oscuro. Otros están formados por líneas definidas en un fondo continuo, líneas definidas sin un fondo, o incluso líneas oscuras en un fondo continuo, como en el espectro solar (ver más abajo). ¿Por qué esta diversidad? ¿Cómo se forman los espectros?

llama de una vela produce
una línea de emisión del
sodio
Imagen cortesía de Mark Tiele
Westra
Todo se debe a los átomos. Un átomo individual puede encontrarse en diferentes estados de energía, dependiendo de si sus electrones ocupan sus órbitas usuales o han sido excitados a órbitas más altas. Un átomo no puede tener cualquier nivel de energía: los niveles de energía están definidos con precisión por su detallada estructura atómica. Cuando un electrón salta de una órbita a otra, el cambio corresponde a una precisa cantidad de energía emitida como un solo fotón. La energía de este fotón emitido determina su color.
Como puede haber muchos saltos diferentes, cada átomo puede emitir una gama de colores de luz distinta. Si esta luz es separada por un prisma o una red de difracción, cada color es visto como una línea de emisión en el espectro, llamada línea espectral.
Para demostrar cómo se forma una línea de emisión, veamos qué pasa cuando ponemos un poco de sal de mesa común (cloruro de sodio, NaCl) en la llama de una vela. Las fotos de arriba muestran el espectro continuo de la llama; es igual que el de la bombilla incandescente. Cuando se pone un poco de sal de mesa sobre un cuchillo y se lo sostiene en la llama, aparece una línea naranja en el espectro, que corresponde a la línea de emisión del sodio (Na, a 589 nm).
Un átomo no solo emite luz, sino también absorbe fotones de la misma energía que emite. Si la luz pasa a través de un gas frío y de baja densidad, los átomos en el gas absorben ciertas frecuencias, lo que forma líneas oscuras en el espectro llamadas líneas de absorción.
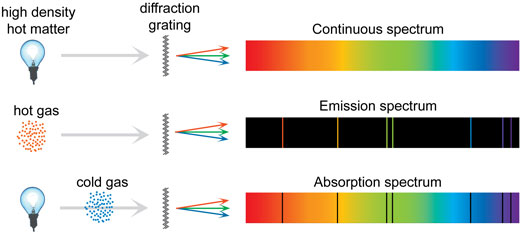
Imagen cortesía de Mark Tiele Westra
Pero si todos los espectros están formados por átomos que emiten colores muy definidos, ¿cómo se forman los espectros continuos? Para un solo átomo no afectado por factores externos, las líneas son bien definidas. Esto es lo que sucede con un gas de baja densidad, por ejemplo en un tubo fluorescente. En un gas de alta presión, por ejemplo el Sol, y también en fluidos y sólidos, hay colisiones frecuentes y muchos otros mecanismos que hacen que las líneas pierdan su definición y se vuelvan borrosas, formando un espectro continuo. En la ilustración de más abajo hay una síntesis de los tres tipos de espectros.
Los átomos (y moléculas) diferentes tienen distintos espectros de emisión y absorción. Podemos aprovechar esta diferencia: al mirar la luz que viene de un objeto distante, por ejemplo del Sol o de una estrella, se puede saber qué elementos químicos están presentes. En la Tierra, se usa esta técnica para alumbrar una muestra (a menudo un gas) y medir el espectro de absorción, y así deducir la composición de la muestra.
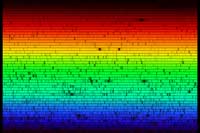
El espectro solar
Si sacamos nuestro espectrómetro afuera, podemos ver el espectro de la luz solar. El espectro, que se muestra más abajo, a primera vista parece continuo. Pero, si miramos más detenidamente, podemos identificar varias líneas oscuras, causadas por la absorción de los átomos de ciertas frecuencias de luz en las capas externas del Sol y en la atmósfera terrestre. La imagen de abajo no le hace justicia a la potencialidad del espectrómetro casero: a simple vista las líneas de absorción se ven más detalladamente.
Las líneas de absorción que observamos en el espectro solar se llaman líneas de Fraunhofer. Joseph von Fraunhofer (1787 – 1826) fue el primero en realizar el estudio sistemático y la medición cuidadosa de estas líneas oscuras, aunque no fue el primero en observarlas. En total, descubrió alrededor de 570 líneas, a las que categorizó y nombró.

Imagen cortesía de Mark Tiele Westra
Alrededor de 1860, Kirchoff y Bunsen descubrieron que cada elemento químico está asociado con un conjunto de líneas espectrales. Dedujeron que las líneas de Fraunhofer en el espectro solar eran causadas por la absorción de ciertos colores de la luz en las capas externas del Sol. Algunas líneas son también causadas por la absorción de luz que realizan los átomos en la atmósfera terrestre, tales como el oxígeno. Eventualmente, el estudio de estas líneas llevó al descubrimiento del elemento helio en el Sol, lo que finalmente probó que la energía del Sol proviene de la fusión nuclear.
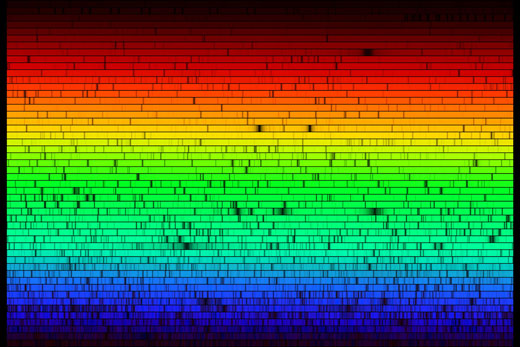
Imagen cortesía del National Optical Astronomy Observatory/Association of Universities for Research in Astronomy/National Science Foundation
Agradecimientos
Le estoy muy agradecido a Xiaojin Zhu de la Universidad de Wisconsin-Madison, cuyo sitio web me brindó toda la información necesaria para construir mi propio espectrómetro y para interpretar los resultados. Hay más espectros disponibles en ese sitio web. También agradezco a Bartjan van der Meer, que me dio pistas sobre este maravilloso proyecto de ciencia.
Resources
- Artículos en Wikipedia sobre los espectros visibles
General info on spectra
- Artículos de Wikipedia sobre el espectro electromagnético:
- Artículos en Wikipedia sobre espectroscopía
- Artículos en Wikipedia sobre las líneas de Fraunhofer
- Artículos en Wikipedia sobre las líneas de emisión:
Review
Este artículo describe un experimento práctico muy interesante que puede ser hecho fácilmente en el aula o en la casa. Se construye un espectrómetro con materiales sencillos y se lo usa para mostrar la composición de colores de la luz blanca y para comparar los espectros de varias fuentes de luz. Reviste particular interés el contexto histórico del descubrimiento del espectro de la luz del Sol y cómo fue usado para identificar la composición de sus gases.
El artículo une la física y la química y es de interés tanto para estudiantes secundarios como universitarios.
Gaetano Bugeja, Malta





