Supporting materials
Feuille de travail de l’élève (Word)
Plats à réchauffer: reactions d’oxydo-réduction, passivation et pile locale (Word)
Download
Download this article as a PDF

Traduit par Maurice A. Casimir. Avez-vous jamais eu très envie d’une boisson ou d’un repas chaud sans avoir de feu ou de fourneau à portée de main? Marlene Rau présente deux activités tirées du portail de ‘Lebensnaher Chemieunterricht’ utilisant des réactions chimiques pour…

Les plats à réchauffer – développés au départ pour un usage militaire – sont des plats tout prêts emballés pour être réchauffés tels quels. On peut les chauffer de plusieurs façons – en pressant un bouton sur l’emballage, en dépliant et secouant l’emballage, ou en mélangeant le contenu d’un emballage dans un autre et en attendant quelques minutes – toujours en utilisant des réactions exothermiques. On peut utiliser ces plats pour engager les élèves à étudier de telles réactions de manière relativement sûre sans utiliser de brûleur. Il y a en plus la valeur ajoutée de la discussion sur les aspects écologiquement négatifs des emballages jetables.
On utilise pour l’expérience suivante le système de réchauffage de nourriture Crosse & Blackwell, basé sur la réaction du magnésium avec l’eau salée pour produire de l’hydrogène:

Mg (s) + 2H2O (l) -> Mg2+ (aq) + H2 (g) ↑ + 2OH– (aq)
s: solide; l: liquide; g: gazeux; aq: en solution; la flèche verticale indique un dégagement de gaz.
Cette réaction est très lente du fait de sa passivation, si bien qu’on ajoute du fer et du sel pour l’activer. La passivation est le processus selon lequel un produit est rendu moins réactif, habituellement du fait du dépôt d’une couche d’oxyde à sa surface : si vous placez une bande de magnésium dans de l’eau froide, sa surface s’oxydera en hydroxyde de magnésium (Mg(OH)2), et ce revêtement empêchera toute réaction ultérieure.
Par conséquent, on ajoute du fer au magnésium dans le système de réchauffage, ce qui conduit à la production d’une pile locale – par corrosion à petite échelle qui se produit lorsque deux métaux différemment réactifs sont en contact en milieu humide – ce qui accélère la réaction exothermique. Comme le potentiel réducteur du magnésium est inférieur à celui du fer (le métal le moins réactif), les électrons passeront du magnésium au fer, et seulement alors à l’eau. Bien que des cations de magnésium (Mg2+) et des anions d’hydroxyde (OH–) continuent à se former, ils ont séparés par le fer en ne peuvent se combiner pour former de l’hydroxyde de magnésium. Il en résulte que le magnésium n’est pas rendu passif par une couche de d’hydroxyde de magnésium, ce qui diminuerait sa réactivité.
Comme les ions de magnésium et d’hydroxyde de charges différentes sont mobiles, ils formeraient rapidement de l’hydroxyde de magnésium dans l’eau pure, la charge s’équilibrerait et la réaction se ralentirait à nouveau. Pour empêcher cela, on ajoute du chlorure de sodium à l’eau, si bien que les ions sodium (Na+) et chlorure (Cl–) du sel peuvent migrer vers les ions magnésium et hydroxyde en équilibrant la charge.
On peut utiliser l’expérience pour introduire et discuter les thèmes du transfert d’électrons, de la pile locale, de la passivation, des anodes galvaniques et de la composition de l’eau (liaisons covalentes, polarité et degré d’oxydation). Il faut environ 45 minutes plus le temps de la discussion et le tout a été testé avec succès sur des élèves de 14 ans pour l’étude des réactions de transfert d’électrons et de la corrosion, ainsi qu’avec des élèves plus âgés pour des travaux pratiques d’électrochimie.
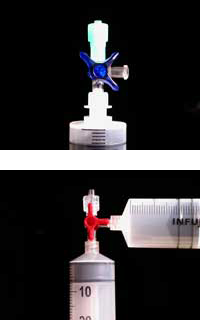
On peut se procurer les matériaux plastiques requis pour l’expérience comme partie de l’ensemble ChemZw2 développé en collaboration avec le projet Lebensnaher Chemieunterricht (LNCU)w3 mais ils sont également disponibles chez la plupart des fournisseurs de matériel médical et de laboratoire.
N.B: si vous n’utilisez que le contenu de deux des quatre emballages du mélange magnésium / fer, vous pouvez conserver le contenu des deux autres pour les expériences des élèves – cela suffira pour environ 20 groupes d’élèves. Même avec deux emballages seulement pour la démonstration, le plat à réchauffer atteindra une température de 100°C après environ une minute.
De l’hydroxyde de magnésium est produit à la pile locale. Si on le désire, on peut le détecter à la phénolphtaléine (voir ci-dessous).
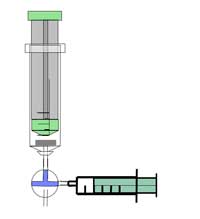
Avertissement: Porter des lunettes de protection. La réaction produit des gaz hautement inflammables – soyez prudent. Voir également la notice générale sur la sécurité.
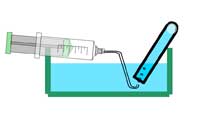
En option: ajouter une goutte de solution de phénolphtaléine à l’eau recueillie dans le bécher. Que se produit-il ? Pourquoi ?
Note santé – sécurité: on peut rejeter les liquides restants à l’évier. Nettoyer les matériaux plastiques à l’eau et les laisser sécher.
D’autres réactions communément utilisées pour les plats à réchauffer incluent l’oxydation du fer, la réaction du chlorure de calcium avec l’eau (voir ci-après) ou, pour le refroidissement, la réaction d’un engrais au nitrate d’ammonium avec l’eau.
D’autres expériences telles que la préparation de vos propres emballages de plats à réchauffer ou à refroidir, ou la détermination de la teneur en oxygène dans l’air à l’aide de la réaction d’oxydation du fer utilisée pour les plats à réchauffer sont décrites dans le site Web du LNCUw3.
La présente activité fait également partie d’une leçon dans laquelle les élèves développement un scenario pour un programme scientifique de la TV destiné à répondre aux questions des spectateurs sur la fonction des plats à réchauffer. La version anglaise de ce document de travail est disponible sur le site Web de Science in Schoolw5, l’allemande sur le site Web du LNCUw3.
Les élèves chauffent du café en utilisant du chlorure de calcium anhydre et de l’eau dans cette activité. Celle-ci entre bien dans un module d’enseignement sur la dissolution des sels dans l’eau pour introduire les aspects énergétiques du processus. Les élèves doivent être déjà familiarisés avec les liaisons ioniques et covalentes. L’activité est bien adaptée à des groupes de trois élèves âgés d’au moins 14 ans.
Il est possible de discuter de l’énergie de liaison, en utilisant par exemple des emballages refroidis en jouant sur une réaction endothermique entraînée par la courbure d’une plaque métallique. On peut donc utiliser l’activité pour introduire la notion d’énergie d’hydratation et démontrer qu’une réaction dans laquelle certains sels se dissolvent est une réaction exothermique.
L’activité est relativement sans danger – l’aspect le plus dangereux est celui de la possibilité de casser du verre en ne le manipulant pas avec précaution.
Avertissement: Portez des lunettes de protection; ne buvez pas le café.
Deux problèmes auxquels les élèves sont souvent confrontés: ajouter trop peu de chlorure de calcium à l’eau (plus il y en a, plus il y a de dégagement de chaleur) et oublier d’isoler les béchers.
Une solution simple est d’improviser un petit bain-marie en mettant l’eau et le chlorure de calcium dans un grand bécher et en fixant de la mousse de polystyrène autour du bécher avec une bande adhésive. On peut alors chauffer le café dans un bécher plus petit placé dans le bain-marie improvisé.
Le meilleur résultat, dans le contexte du projet LNCU (voir encadré), a été obtenu en remplissant un petit bécher avec de l’eau et en le mettant dans un bécher plus grand avec une couche de mousse de polystyrène entre les deux pour l’isolation. Les élèves avaient alors mis le chlorure de calcium, auquel ils avaient ajouté très peu d’eau, en place dans une petite boîte. Ils avaient laissé celle-ci reposer dans l’eau à l’aide d’un fil attaché et d’une pierre pour faire du poids. La température des 50 ml de café était passée de 0 à 44°C en moins d’une minute.
Discuter la contradiction apparente entre le comportement d’emballages froids dans les expériences précédentes et l’expérience tout juste réalisée – dans ce cas, le processus de mise en solution n’est pas endothermique. Dans les emballages froids, il faut plus d’énergie pour rompre la liaison moléculaire du sel (énergie de liaison) que ce qu’il en est libéré quand les molécules d’eau entourent les ions (énergie d’hydratation). L’énergie requise provient de l’extérieur, si bien que la solution se refroidit. Dans l’expérience sur le café, au contraire, l’énergie d’hydratation est supérieure à l’énergie de liaison, si bien que le processus dans son ensemble est exothermique. Energies d’hydratation et de liaison sont des caractéristiques déterminées d’un sel donné.
En complément à ce qui précède, les élèves pourraient essayer d’atteindre la température la plus basse possible en utilisant du chlorure de calcium, du chlorure de sodium et de la glace. Ils pourraient être surpris de constater que l’addition de chlorure de calcium anhydre à de la glace (plutôt qu’à de l’eau) n’augmente pas la température. Cela est dû à ce que les liaisons hydrogène doivent d’abord être rompues dans les cristaux de glace, ce qui exige de l’énergie, si bien que le processus complet est endothermique.
En 2003, quatre professeurs de chimie allemands unirent leurs forces pour créer un portail Web pour partages leurs idées sur l’enseignement: Lebensnaher Chimieunterrichtw3 (LNCU, leçons de chimie adaptées à la vie quotidienne). Leur collection a régulièrement augmenté, et ils offrent une vaste sélection d’activités pour tous les âges de l’école primaire à la fin d’études secondaires, en les reliant à des thèmes majeurs du programme de chimie, tels que la table périodique, les titrages, et l’air et l’eau, plus des activités en biologie et physique pour les plus jeunes élèves.
Leurs matériaux en langue allemande sont disponibles gratuitement sous forme de documents PDF et Word® téléchargeables, avec à la fois des instructions pour les enseignants et des feuilles de travail pour les élèves. En outre, le site Web offre tout un éventail de vidéos sur les activités et une liste (en allemand et en anglais) de davantage de sites Web avec des idées pour l’enseignement et des matériaux adaptés à la classe de sciences.
On peut également trouver une démonstration photographique de la manière dont sont préparés les plats à réchauffer dans : www.mlaltd.co.uk/store
Kalogirou E, Nicas E (2010) Microscale chemistry: experiments for schools. Science in School 16: 27-32. www.scienceinschool.org/2010/issue16/microscale
Le présent article permet aux élèves de découvrir le lien entre la science en classe et le monde réel. Avec des expériences ayant quelque chose de sensationnel – ce qui manque souvent dans les travaux pratiques – les élèves peuvent développer et construire savoir-faire t connaissances.
Le sujet principal traité est la chimie, mais l’enseignant peut adapter la leçon pour y incorporer des discussions sur l’énergie à partir d’autres sujets, comme par exemple le maintien au chaud, la survie en climat froid et le traitement des blessures dues aux activités sportives. Les expériences pourraient aussi amener à une discussion sur la manière dont la science agit.
Nick Parmar, Royaume Uni