CRISPR, дешевый и быстрый: революция в генной инженерии Understand article
Перевод: Надежда Волкова. Противоречивая новая технология сделала модифицирование генома простым и дешёвым – возможно, слишком простым?

принадлежат Nicola Graf
Вы печатаете предложение и понимаете, что опечатались в одной букве. Ошибка изменит смысл всего предложения, поэтому вы наводите курсор на неправильную букву, нажимаете «Backspace» и печатаете правильный символ. Это исключительно лёгкое задание. Удивительно, но теперь этот подход воспроизвели и в лабораториях, с учёными в роли писателей и ДНК в качестве сообщения, которое нужно исправить.
Это стало реальным благодаря CRISPR-Cas9 – новой технологии, совершенно покорившей научное сообщество за последние несколько лет. Помимо многообещающих биомедицинских достижений, она предоставила и новые непростые задачи. В самом деле, эта противоречивая методика породила столько шума в медиа пространстве, что вскоре и школьные учителя биологии услышат от своих учеников вопросы о CRISPR-Cas9. В этой статье мы предлагаем краткий обзор того, что такое технология CRISPR-Cas9 и почему она так важна.
Что такое CRISPR-Cas9?
CRISPR-Cas9 – это система, используемая бактериями для защиты от нападения вирусов, но недавно её удалось приспособить для редактирования генома в определённых позициях. Система состоит из двух компонентов: CRISPR и Cas9. CRISPR – аббревиатура, обозначающая «короткие палиндромные повторы, регулярно расположенные группами» – это набор позиций в геноме, где находятся повторяющиеся участки ДНК. Рядом с этими повторами расположены гены Cas, кодирующие важные ферменты, один из которых – Cas9 – способен разрезать нуклеиновые кислоты (ДНК или РНК).
Когда бактерию атакует вирус, он вводит в неё свои нуклеиновые кислоты, на что бактерия реагирует путём синтеза ферментов Cas, чтобы вырезать куски вирусных нуклеиновых кислот и записать в свою ДНК в CRISPR позициях (изображение 1). Таким образом бактерии приобретают полезный иммунитет: в следующий раз, когда её атакует тот же вид вируса, участки CRISPR вместе с вирусными нуклеиновыми кислотами будут скопированы в короткие молекулы РНК. Эти молекулы прикрепятся к ферментам Cas9 и направят получившийся комплекс к ДНК или РНК нападающего, стремясь к комплементарной последовательности. Затем Cas9 разрежет чужую цепочку нуклеиновых кислот, лишая вирус возможности захватить бактерию для самовоспроизведения.
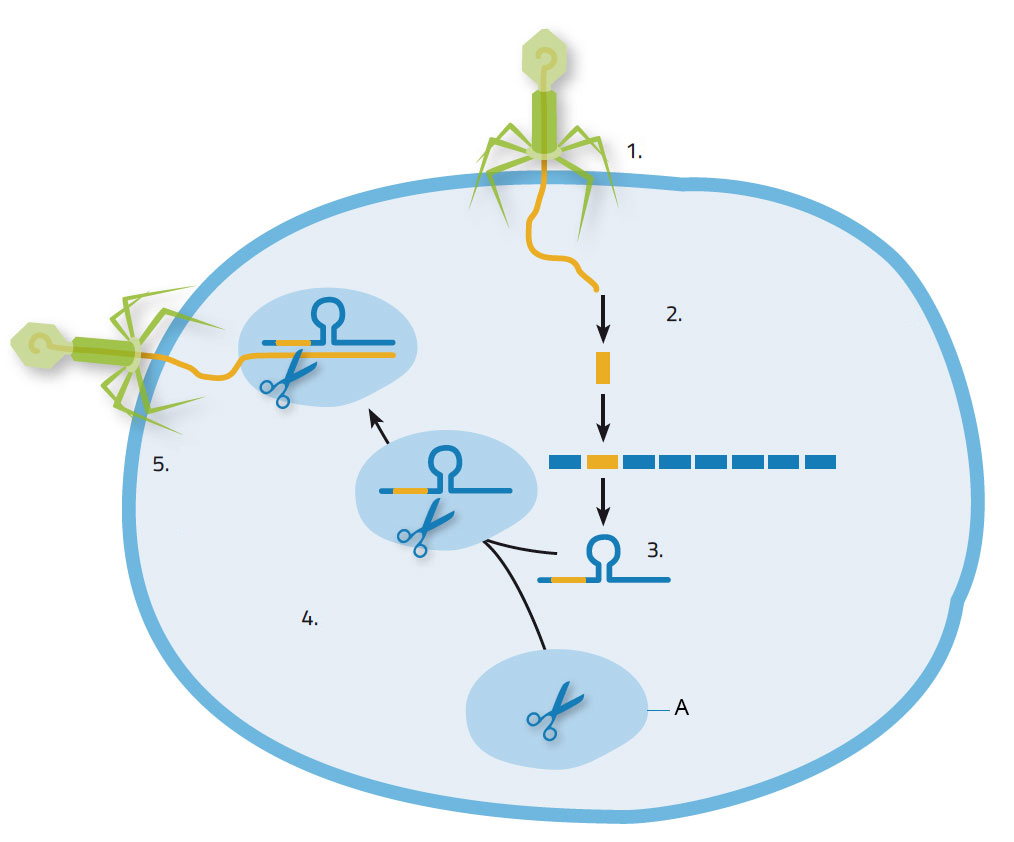
1. Вирус вторгается в бактериальную клетку; 2. Нуклеиновые кислоты вируса записываются в CRISPR участке; 3. Формирование CRISPR РНК; 4. CRISPR РНК прикрепляется к ферменту Cas9; 5. CRISPR РНК направляет фермент Cas9 к вирусу. Он разрезает и уничтожает вирусный геном.
Права на изображение принадлежат Nicola Graf
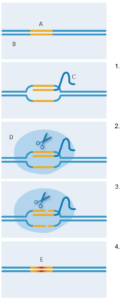
Редактирование генов при
помощи CRISPR-Cas9. А:
Заданная
последовательность; B: ДНК;
C: Направляющая РНК; D:
Cas9; E: Новая цепочка ДНК
1. Направляющая РНК
прикрепляется к заданной
последовательности ДНК;
2. Фермент Cas9 связывается
с направляющей цепочкой
РНК; 3. Фермент Cas9
разрезает обе цепи ДНК;
4. Бактериальная система
репарации вставляет новый
участок ДНК на месте
разрыва взамен исходного.
Права на изображение
принадлежат Nicola Graf
Как же удалось адаптировать бактериальную систему для использования в генной инженерии? В 2012 году команды Дженнифер Дудны в университете Калифорнии в Беркли (США) и Эммануэль Шарпентье в университете Умео (Швеция) модифицировали и сложили вместе короткие молекулы РНК, чтобы получить единую «направляющую» РНК (изображение 2). Она должна иметь конец, который может крепиться к Cas9, но оставшаяся последовательность может быть подобрана в пару к любой последовательности ДНК. Благодаря такому многообразию возможностей, CRISPR-Cas9 может вырезать конкретные заданные участки ДНК. Вскоре после этого лаборатория Фэна Чжана в Массачусетском технологическом институте (США) пошла ещё дальше, показав, что комплексы CRISPR-Cas9 способны создавать точные разрезы ДНК в человеческих и мышиных клетках (Cong et al, 2013). Кроме того, они подправили Cas9, чтобы он мог резать ДНК немного по-другому, стимулируя определенный механизм починки ДНК в клетке. Таким способом ученым удалось успешно вставить новую последовательность нуклеотидов точно на место разреза, заменив исходную (изображение 2).
Благодаря этим инновационным открытиям, CRISPR-Cas9 система была превращена из узкоспециализированного раздела микробиологии в перспективный исследовательский инструмент, позволяющий ученым легко и с высокой точностью редактировать гены для различных целей.
Зачем это нужно?
Для изучения функции генов ученые часто пытаются вывести клеточные линии или модельные организмы, в которых исследуемый ген содержит мутацию или полностью деактивирован (приём, известный как нокаут гена). CRISPR-Cas9 предоставляет быстрый и точный способ достичь этой цели. К тому же, фермент Cas9 можно изменить так, чтобы он больше не мог резать ДНК, но был способен прикрепляться к определенным последовательностям ДНК при помощи направляющей цепочки РНК. Таким образом, РНК полимераза физически не сможет прикрепиться к этому участку, что позволяет исследователям контролировать транскрипцию определенных генов – начальную точку активности гена.
Помимо упомянутых важных применений в биомедицинских исследованиях, CRISPR-Cas9 также предлагает более прямые приложения в медицине. Ученые уже пробовали использовать редактирование генома при помощи CRISPR-Cas9 для вырезания нуклеотидных последовательностей ВИЧ и предотвращения репликации этого вируса в человеческих клеточных линиях. Его также применяли для удаления мутированных последовательностей в мышах с мышечной дистрофией Дюшенна, которая вызывает мышечную слабость, что дает надежду на успешную терапию пациентам и семьям, страдающим этим и другими похожими генетическими заболеваниями. Недавно были предприняты попытки радикального редактирования генома свиных эмбрионов при помощи CRISPR-Cas9 в надежде создать способ безопасно получать органы для трансплантации человеку.
А если ученые уже модифицируют эмбрионы свиней, можно ли редактировать геном и в человеческих эмбрионах? Именно это пытались делать китайские ученые в 2015 году, используя CRISPR-Cas9 для изменения гена бета-талассемии в 86 человеческих эмбрионах (Cyranoski & Reardon, 2015). Оказалось, что эта методика пока что довольно неэффективна, так как изменить последовательность ДНК удалось менее чем в четверти эмбрионов. Тем не менее, новость об этом открытии вызывала немало разногласий касаемо этичности подобных исследований.
Вопросы этики – и будущее
Этические опасения относились не только к экспериментам на эмбрионах, но и к весьма непростой перспективе генной инженерии человека. Благодаря CRISPR-Cas9, появилась теоретическая возможность вносить генные изменения в половые клетки (сперматозоиды и яйцеклетки), которые будут могут быть переданы будущим поколениям. Помимо воодушевляющего потенциала избавить человечество от генетических болезней, эта идея поднимает и вопрос того, какие именно изменения должны быть разрешены в медицинской практике в будущем. Можно ли считать такие черты человека, как интеллект или цвет глаз, подходящими для медицинского улучшения? Подобные страхи могут казаться преждевременными, однако есть и другой повод для тревоги: генная инженерия человека может иметь совершенно непредвиденные и необратимые последствия для будущих поколений. Это соображение становится особенно актуальным в свете последних исследований в области генетики, которые показали, что взаимодействия между генами и другими механизмами наследования намного сложнее, чем считалось ранее.
Упомянутые вопросы не ускользнули от внимания ученых. Некоторые соглашаются, что инженерия человека – это минное поле этических проблем, и считают, что любые исследования с использованием CRISPR-Cas9 на человеческих эмбрионах должны быть запрещены. Другие, однако, уверены, что полный мораторий на подобные изыскания будет не только сложен на практике, но и вреден для научного прогресса. Несмотря на такую разницу во взглядах, научное сообщество сходится в том, что лучшее решение – это открытый публичный диалог, что подтверждается многочисленными совещаниями и конференциями, посвящёнными этой теме, по всему миру.
Между тем, CRISPR-Cas9 продолжает развиваться. Фармацевтические компании инвестируют в этот метод ради новых исследований в области дизайна лекарств, так что технические недостатки находят и исправляют – в то время, как ожесточённый патентный спор между основоположниками технологии (Дудна/Шарпентье против Чжана) изживает себя. Однако каким бы ни был исход, головокружительный взлёт CRISPR-Cas9 – это только начало.
References
- Cong L et al. (2013) Multiplex genome engineering using CRISPR/Cas systems. Science 339: 819–23. doi: 10.1126/science.123
- Cyranoski D, Reardon S (2015) Chinese scientists genetically modify human embryos. Nature 22 April, doi:10.1038/nature.2015.17378
Resources
- Узнайте больше о возможных применениях CRISPR в редактировании РНК.
- Узнайте больше о патентном споре касаемо технологии CRISPR-Cas9.
- Узнайте о том, как технологию CRISPR-Cas9 применяют для лечения миодистрофии Дюшенна.
- Прочитайте о том, как CRISPR-Cas9 используют для выращивания в свиньях органов для пересадки человеку.
- Лёгкая и доступная статья о этических вопросах редактирования генов в половых клетках.
- Статья с комментариями ученых-генетиков из разных стран о этических проблемах редактирования генов в половых клетках:
- Bosley K et al. (2015) CRISPR germline engineering – the community speaks. Nature Biotechnology 33: 478–86
- Прочитайте больше о инновационной методике редактирования генов, под авторством Эммануэль Шарпентье, и прослушайте её рассказ об этой работе.
Review
CRISPR-Cas9 – это мощный инструмент редактирования генов «с GPS-навигацией». Он способен открыть двери для многих научных, медицинских и сельскохозяйственных применений. Относительная простота и низкая стоимость этого метода поднимает важные этические вопросы. К тому же, они вылились в широко обсуждаемый в СМИ судебный процесс между учеными, сражающимися за ценные патентные права.
Эта статья ясно описывает поиск палиндромных повторов как основной защитный механизм бактерий и его применение в качестве программируемого инструмента редактирования генов CRISPR-Cas9. Её можно использовать вместе с наглядными видеороликами для объяснения молекулярно-биологических основ этого метода, а также причин, почему он заменил прежде существующие способы редактирования генома. Она также может послужить началом дискуссии о этических вопросах генного модифицирования эмбрионов и интеллектуальной собственности. Вопросы на понимание этой статьи могут включать:
- Что означает “CRISPR”?
- Как работает CRISPR-Cas9?
- Какие заболевания можно вылечить при помощи CRISPR-Cas9?
- Каковы потенциальные риски использования CRISPR-Cas9?
- Какие этические проблемы были подняты вокруг применения CRISPR-Cas9?
- Кому стоит дать Нобелевскую премию за открытие CRISPR-Cas9?
Мэри Бренан, Колледж Конкорд, Соединенное Королевство





