Klasowa gospodarka wodorowa Teach article
Tłumaczenie Katarzyna Badura. Czy wodór mógłby być najlepszą alternatywą dla paliw kopalnych? Poniższa prezentacja pokazuje jak gospodarka wodorowa sprawdziłaby się w praktyce.
Choć zasoby paliw kopalnych powoli się wyczerpują, rosnąca populacja naszej planety zużywa coraz więcej i więcej energii. W chwili obecnej zdajemy sobie sprawę z faktu, że wykorzystywanie tradycyjnych paliw zawierających węgiel znacząco zwiększyło poziom zanieczyszczenia środowiska, co z kolei sprawia, że rozwój technologii pozyskiwania energii ze źródeł przyjaznych dla środowiska jest coraz ważniejszy.
Jednym z najbardziej przekonywujących scenariuszy produkcji tzw. “zielonej” energii jest gospodarka wodorowa. Wodór, w porównaniu do tradycyjnych paliw kopalnych, charakteryzuje duża gęstość energii w odniesieniu do masy, a do tego niska emisja gazów cieplarnianych. W momencie bezpośredniego spalania wodoru lub utleniania go w ogniwach paliwowych w celu uzyskania ciepła i energii elektrycznej, jedynym produktem jest woda.
Pomimo tego, że niektóre firmy rozwijają technologię silników bazujących na procesie wewnętrznego spalania wodoru, to jednak ogniwa paliwowe stanowią główne przetworniki energii, na których opiera się koncepcja gospodarki wodorowej.
Ogniwa paliwowe zostały wynalezione w pierwszej połowie XIX wieku, kiedy brytyjski fizyk William Grove zasugerował, że skoro pod wpływem energii elektrycznej woda rozpada się na wodór i tlen, to próba połączenia tych dwóch pierwiastków mogłaby w efekcie wytworzyć energię elektryczną. Ponieważ jednak paliwa kopalne stały się dominujące, koncepcja ogniw paliwowych zeszła na dalszy plan.
W latach 60, NASA wykorzystywała alkaliczne ogniwa paliwowe w swoich pojazdach kosmicznych Apollo, oraz późniejszych promach kosmicznych do produkcji energii elektrycznej i wody. Obecnie ta technologia może ponownie wyjść na prowadzenie.
Produkcja i wykorzystywanie ogniw paliwowych są wciąż dość ograniczone, głównie dlatego, że produkcja i magazynowanie wodoru, podobnie jak katalizatory wykorzystywane w ogniwach paliwowych są bardzo drogie. Biorąc jednak pod uwagę fakt, iż technologia idzie do przodu, a paliwa kopalne stają się coraz droższe, oczekuje się, że ogniwa paliwowe zastąpią wyczerpujące się źródła energii i konwertery.

elektrolizera do panelu
słonecznego
Zdjęcie dzięki uprzejmości
Mario Mitov
Prezentacja założeń
By zapoznać się ze sposobem działania ogniwa paliwowego zbudowaliśmy własną, tańszą wersję ogniwa do wykorzystania w klasie. Otrzymany elektrolizer i ogniwo paliwowe mogą być użyte jako instalacja obrazująca sposób, w jaki wodór można uzyskać i wykorzystać.
Następujące kryteria zostały wybrane dla naszych modeli:
- Materiały muszą być dostępne i tanie.
- Cała konstrukcja powinna być stosunkowo prosta, by inni mogli obserwować fenomen i procesy.
- Wykonanie prototypów powinno być bezpiecznie.
Poniżej opisujemy jakie materiały i procedury są wymagane do skonstruowania elektrolizera wody oraz prototypu wodorowego ogniwa paliwowego w klasie.
Ćwiczenie klasowe

paliwowego
Zdjęcie dzięki uprzejmości
Mario Mitov
Materiały i reagenty
- plastikowe strzykawki (50ml)
- pręty grafitowe lub wkłady ołówkowe
- węglowe elektrody dyfuzji gazowej przymocowane do siatki
- małe elastyczne przewody rurowe z zaworami
- złącze szklane w kształcie litery T (T-złącze)
- naczynie z tworzywa sztucznego (butelka) na elektrolit
- stanowisko laboratoryjne z zaciskami
- folia aluminiowa lub miedziana
- papier odporny na tłuszcz
- płyta grzejna
- szklane naczynia (zlewki o pojemności 400ml)
- izolowane przewody miedziane ze złączami
- wiertarka
- pasta silikonowa
- źródło zasilania o mocy 6-12 V (panel słoneczny lub bateria 9V)

Ryc. 3: Stechiometria reakcji
rozkładu wody
Zdjęcie dzięki uprzejmości
Mario Mitov - odbiornik końcowy (słabosilnikowy elektromotor z wiatraczkiem, LED)
- zestaw rezystorów
- dwa mierniki albo woltomierz i amperomierz
- 1 M H2SO4
- 2 M HNO3 (do wytrawiania)
- roztwór PdCl2 przygotowany przez rozpuszczenie 1g soli w 50 ml 0,5M HCl, podgrzany do 50 oC i rozcieńczony do 100ml wodą destylowaną.
- 1 M KOH lub NaOH
- rękawiczki I okulary
Procedury
* operacje jednostkowe zaznaczone gwiazdką powinny być dla zachowania bezpieczeństwa wykonane przez nauczyciela.
Konstruowanie elektrolizera
- * Usuń tłoki i igły z dwóch strzykawek
- * Usuń gumowe uszczelki z tłoków i zrób w każdej uszczelce otwór na pręty grafitowe
- Wepchnij pręty grafitowe do otworów w uszczelkach i umieść je z powrotem w strzykawkach.
- * Po bokach obu strzykawek, na wysokości ok. 1cm wydrąż otwory. Otwory powinny być o ok. 1 mm szersze niż zewnętrzna średnica T-złącza.
- Przymocuj jednocentymetrowe odcinki wężyka do obu końców T-złącza.
- Połącz strzykawki z T-złączem.
- Wykorzystaj wężyki do połączenia naczynia na elektrolit z wolną końcówką T-złącza.
- Połącz cienkie elastyczne rurki z wąskimi końcami strzykawek.
- * Wlewaj 1M H2SO4 do naczynia na elektrolit tak długo, aż wypełni obie strzykawki.
- Przy pomocy miedzianych przewodów połącz obie elektrody ze źródłem energii (Ryc. 1).
Konstruowanie ogniwa paliwowego
- * Usuń tłoki I igły z dwóch strzykawek.
- * Odetnij dwa kawałki z elektrody dyfuzji gazowej by całkowicie pokryć kołnierze strzykawek.
- * Umieść kawałek folii aluminiowej lub miedzianej na płycie grzejnej, umieść na tym papier odporny na tłuszcz, a na papierze elektrodę dyfuzji gazowej.
- * Przyciśnij kołnierz strzykawki do elektrody dyfuzji gazowej – pod wpływem wysokiej temperatury plastik się stopi i elektroda będzie przytwierdzona do strzykawki.
- * Wywierć dziurę przechodzącą z jednej strony przez kołnierz strzykawki a z drugiej przez przymocowaną elektrodę dyfuzji gazowej.
- Przepchnij metalową śrubę przez otwór.
- Usuń izolację z końca kawałka drutu miedzianego, owiń ją kilka razy wokół śruby i unieruchom nakrętką.
- Zaizoluj śrubę pastą silikonową.
- Powtórz kroki 3 do 8 by przygotować drugą elektrodę.
- * Straw obie elektrody zanurzając je na 5 minut w 2 M HNO3, a następnie przemyj je wodą.
- * Wlej roztwór PdCl2 do zlewki o pojemności 400 ml i na okres 5 minut zanurz w nim przygotowane elektrody. Zgodnie z reaktywnością metali, na elektrodach dyfuzji gazowej osadzi się cienka warstwa katalityczna palladu, która będzie wynikiem reakcji jonów palladu z węglem i niklowaną siatką.
- * Wlej 100 ml 1 m NaOH (lub KOH) do drugiej zlewki i umieść w niej obie strzykawki z przymocowanymi elektrodami (ryc. 2).
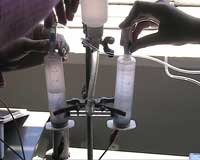
- Połącz obie strzykawki z dwoma cienkimi wężykami wychodzącymi z elektrolizera.
Po zebraniu odpowiednich ilości wodoru i tlenu, zatrzymaj produkcję gazu i otwórz zawór by gaz mógł przepłynąć do elektrod ogniwa paliwowego (ryc. 4).
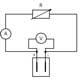
Następnie, uczniowie mogą zająć się pomiarem parametrów elektrycznych ogniwa paliwowego, wykorzystując układ przedstawiony na rycinie 5. Prąd oznaczany jako I liczy się korzystając z prawa Ohm’a:
I= V/R

pozwalające na przepływ
gazu do elektrod ogniwa
paliwowego; b) produkcja
energii elektrycznej przez
ogniwo paliwowe
Zdjęcie dzięki uprzejmości
Mario Mitov
Zamiast rezystora można wykorzystać diodę emitującą światło (LED) lub silnik elektryczny o niskiej mocy.
Ważną cechą tego systemu jest to, że każdy z modułów podstawowych można zastąpić innym urządzeniem. Na przykład, do wygenerowania elektryczności potrzebnej do zasilania elektrolizera wody, można zamiast panelu słonecznego wykorzystać specjalną turbinę wiatrową. Albo zamiast elektrolizera wody jako źródła gazowego wodoru i tlenu można otrzymać gaz drogą reakcji chemicznej (ryc. 6).
W ramach zajęć można też popracować również nad innymi wersjami ogniw paliwowych, wykorzystując ciekłe paliwa (na przykład etanol zamiast wodoru).
Zarówno elektrolizer jak i ogniwo paliwowe w zaproponowanym systemie energii ekologicznej mogą zostać zastąpione przez nasze ogniwo DeMi, która pracuje na tych samych zasadach co odwracalne ogniwo paliwowew1.
Ponieważ ogniwa DeMi nie wykorzystują niebezpiecznych elektrolitów soli, łatwiej im spełnić wymogi bezpieczeństwa.
Z pewnym zasobem wiedzy teoretycznej, studenci z różnych poziomów edukacji są w stanie opracować prototypy zaawansowanej i wyszukanej technologii (ryc. 7).
do testów na ogniwie
paliwowym
Zdjęcie dzięki uprzejmości
Mario Mitov

chemicznego generatora
gazu i zbiornika na gaz;
Zdjęcie dzięki uprzejmości
Mario Mitov

dopływu wodoru I tlenu do
ogniwa paliwowego ze
zbiorników na gaz
Zdjęcie dzięki uprzejmości
Mario Mitov

wody, ogniwa paliwowego i
ogniwa gazowego
Zdjęcie dzięki uprzejmości
Mario Mitov
Praktyczna prezentacja
Połączenie elektrolizera i ogniwa paliwowego z panelem słonecznym tak, jak jest zaprezentowano na rycinie 1, pozwoli przedstawić sposób w jaki energia słoneczna może być przechowywana w formie wodoru, jak również drogę jej ponownego uwolnienia. Energię elektryczną potrzebną do zasilenia elektrolizy wody można uzyskać naświetlając panel słoneczny sztucznym źródłem światła. W wyniku wymuszonego procesu uwalniane są gazy, które zbiera się powyżej elektrolizera do odseparowanej przestrzeni elektrolizera (strzykawek). Zawory blokują przepływ gazu do elektrolizera tak długo jak jest to wymagane.
Strzykawki pozwalają również na zaobserwowanie, że objętość gazu uwalnianego na anodzie jest dwa razy większa od objętości gazu uwalnianego na katodzie: 2 mole wodoru i 1 mol tlenu są produkowane z 2 moli wody (ryc. 3):
(-) 4 Н2О + 4 е–→ 2 Н2 + 4 ОН–
(+) 4 ОН– → 2 Н2О + О2 + 4 е–
Podsumowując 2 Н2О → 2 Н2 + О2
Web References
Resources
- Lex Solar zapewniają zestawy zawierające ogniwa paliwowe i inne odnawialne źródła energii dla szkół. Zobacz: www.lexsolar.de
- Ta książka zawiera wstęp do tematu ogniw paliwowych i ekonomii wodorowej:
- Cook B (2001) An Introduction to Fuel Cells and Hydrogen Technology. Vancouver, Canada: Heliocentris
- Aby uzyskać więcej informacji na temat pracy Maria Mitova możesz przeczytać
- Mitov M, Kondev I, Petrov Y, Bliznakov S, Popov A (2003) Fuel cells – Achievements and Perspectives. Khimiya 12: 455-466 (dostępne tylko w języku rosyjskim)
- Mitov M, Petrov Y, Manev S (2005) Demonstrational Fuel Cells. Khimiya 14: 440-445 (dostępne tylko w języku rosyjskim)
- Innym typem ogniwa paliwowego jest ogniwo mikrobiologiczne, które zamiast piwa warzy energię. W poniższej publikacji możesz poczytać o tym jak wykorzystać takie ogniwo w klasie:
- Madden D (2010) The microbial fuel cell: electricity from yeast. Science in School 14: 32-35.
Review
Ten artykuł opisuje ćwiczenie praktyczne wyjaśniające koncepcję gospodarki wodorem, która można wykorzystać jako wprowadzenie do tematu zastosowań reakcji utlenienia i redukcji. Pomimo tego, iż materiały wykorzystywane w tym ćwiczeni nie znajdują się na standardowym wyposażeniu szkoły, można je łatwo nabyć.
Chemia jest czasem postrzegana jako jedno z powodów zanieczyszczenia i zniszczenia środowiska, ale ten tekst ukazuje, że może mieć ona również znaczącą rolę w ochronie środowiska.
Co więcej, ten artykuł może być wykorzystany jako punkt startowy w rozważaniach nad zaletami i wadami źródeł energii obecnie wykorzystywanych przez społeczeństwo i potrzebą opracowania alternatyw dla źródeł paliwa.
Mireia Güell Serra, Hiszpania





