Supporting materials
Werkblad voor Activiteit 1 (Word)
Werkblad voor Activiteit 1 (Pdf)
Werkblad voor Activiteit 2 (Word)
Werkblad voor Activiteit 2 (Pdf)
Download
Download this article as a PDF

Vertaald door Piet Das. Heet, lichtgevend en destructief: vuur is een natuurkracht. Hier bekijken we hoe we het veilig kunnen beheersen met water en koolstofdioxide.

Vuur heeft een plaats in de prehistorie, cultuur en technologie. De vroege mens zal branden van natuurlijke oorsprong hebben meegemaakt – van bosbranden en bliksem tot misschien vulkaanuitbarstingen. Later leerden mensen hoe ze vuur moesten maken en zelf in stand houden en om het te gebruiken voor licht en warmte. Veel later begrepen we de chemie ervan en hoe het aan te passen voor gebruik op de meest voortreffelijke gecontroleerde wijze – zoals in bijvoorbeeld de verbrandingsmotor.
Vandaag de dag, maar ook als een essentieel onderdeel van de technologie, is vuur een gevaar: in Europa verliezen elk jaar enkele duizenden mensen hun leven als gevolg van brand, met een geschat economisch verlies van één procent van het BNPw1. Vuur is dus een belangrijk onderwerp door zowel zijn kracht als zijn risico’s.
Geïnspireerd door dit idee hebben we een reeks activiteiten ontwikkeld om de eigenschappen van vuur veilig te verkennen voor leerlingen van 11-14 jaar. In de eerste activiteit, laten we zien hoe ‘geld verbrandt’, terwijl in de tweede activiteit de vuur dovende eigenschappen van koolstofdioxide gedemonstreerd worden. Tot slot geven we de leerlingen een kans om te bespreken hoe je je kunt beschermen tegen vuur. De activiteiten vereisen in totaal ongeveer 35 minuten (de eerste activiteit ongeveer 15 minuten, en de tweede en derde 10 minuten).
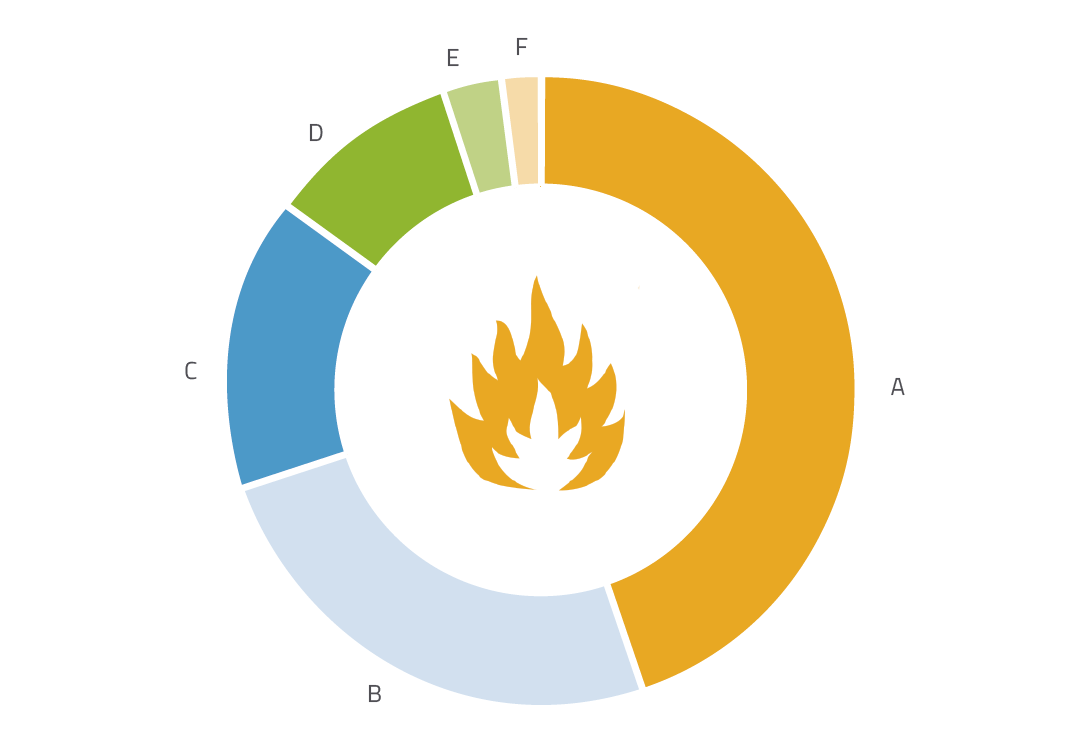
Als een voorafje op de praktische activiteiten vroegen we de leerlingen om vijf ideeën te noemen die ze associëren met het woord ‘vuur’. De meest voorkomende associaties worden in figuur 1 weergegeven.
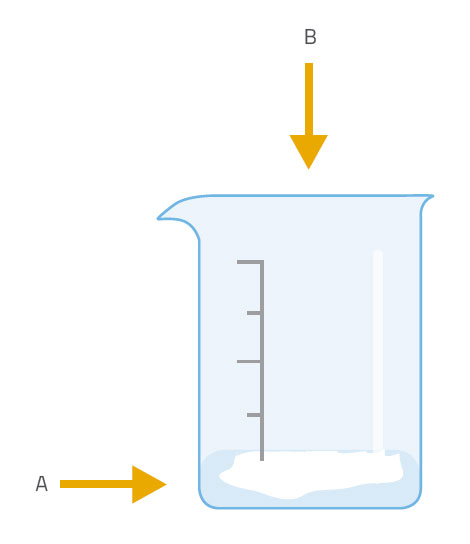
Deze activiteit is een beetje een magische truc – een demonstratie hoe je je geld kunt verbranden en het toch behouden.
Deze activiteit moet door de docent uitgevoerd worden als demonstratieproef.
Je zou een veiligheidsbril, labjas en handschoenen moeten dragen. Wees vooral voorzichtig met het open vuur en als je bezig bent met de spiritus, om brand te voorkomen.




Vraag de leerlingen na het experiment om onderling in groepjes te bediscussiëren wat er is gebeurd. Moedig ze aan om met eigen ideeën te komen, waarbij ze het werkbladw2 gebruiken, of stel de volgende vragen:
Bediscussieer de ideeën van de leerlingen met de klas, begeleid ze indien nodig naar de juiste antwoorden.
Deze activiteit wordt uitgevoerd door de leerlingen onder leraar toezicht. Er zijn twee varianten: in de eenvoudigste (versie 1), produceren we kooldioxide in een bekerglas en ontdekken dan dat het een brandende lucifer of kaars die in het bekerglas staat dooft. In versie 2, laten we kooldioxide over een vlam stromen – een handeling die lijkt op het gebruiken van een brandblusser om een brand te blussen.
Ze moeten een veiligheidsbril, laboratoriumjas en handschoenen dragen en de activiteit moet in een goed geventileerde ruimte worden uitgevoerd. Speciale aandacht moet er zijn voor de open vlammen en bij het hanteren van de spiritus om te voorkomen dat er brand ontstaat. Leerlingen moeten eraan worden herinnerd hoe ze veilig met vlammen moeten omgaan en wat ze moeten doen met de hete resten na het experiment.
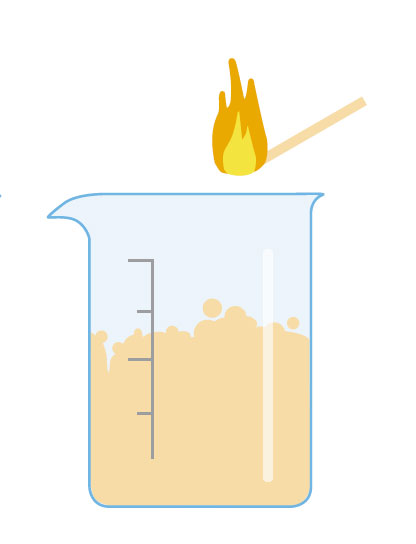
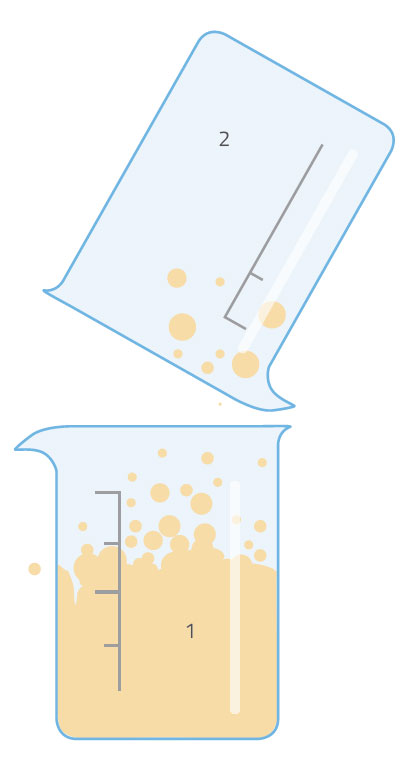

Vraag de leerlingen om in groepjes te bespreken wat er gebeurde (bij elke versie van het experiment). Inspireer hen met vragen als:
Gebruik een werkbladw2 om ze van een gestructureerde aanpak van deze vragen te voorzien, zodat je de leerlingen naar een correctie verklaring begeleidt.
Het gas dat wordt geproduceerd bij de reactie van baking soda en azijn is koolstofdioxide (CO2):
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2
Koolstofdioxide is zwaarder dan lucht daardoor blijft het in het bekerglas. Het versterkt ook de verbranding niet – het voorkomt in feite dat zuurstof, die nodig is voor de verbranding, bij de vlam komt, waardoor de vlam uitgaat. Het feit dat koolstofdioxide zwaarder dan lucht is, betekent ook dat je het van bekerglas naar bekerglas kunt overgieten.
Koolstofdioxide kan ook gevaarlijk zijn voor de mens en andere dieren, wanneer het voorkomt in hogere concentraties of in een afgesloten ruimte (daarom is het noodzakelijk dit experiment in een goed geventileerde ruimte uit te voeren). Dit is niet alleen omdat we zuurstof moeten inademen, maar ook omdat ons lichaam het kooldioxidegehalte aanvoelt en dit gebruikt om de de ademhaling te reguleren – dus een atmosfeer die maar één procent kooldioxide bevat kan invloed hebben op dit mechanisme. Maar koolstofdioxide is ook nuttig: planten gebruiken koolstofdioxide, water en licht bij de fotosynthese, waarbij zuurstof geproduceerd wordt en planten groeien.
Het doel van deze laatste activiteit is leerlingen bewuster maken van de risico’s die samenhangen met vuur. Te behandelen onderwerpen zijn onder meer:
We raden aan om te beginnen met eerst een door de leraar geleide discussie, gevolgd door een internetonderzoek door groepjes leerlingen. Elke groep kan één van de bovenstaande vragen (of soortgelijke vragen) nemen, waarvan ze een poster of presentatie samenstellen en aan de rest van de klas laten zien.
Het is ook het overwegen waard om een gastspreker uit te nodigen – idealiter een brandweerman of een EHBO-er getraind in het omgaan met brandwonden. Evenals het verstrekken van informatie, zal dit het feit onderstrepen dat branden echt gebeuren – en terwijl we rekenen op opgeleide deskundigen als er iets misgaat, is het aan ons allen om in de eerste plaats te helpen voorkomen dat branden ontstaan.
Dit artikel is een geweldige kans voor leraren om lessen te verbinden met de alledaagse ervaringen van de kinderen. Het combineert spannende activiteiten met een goede discussie over de veiligheid; Ik hou van het feit dat het artikel is gebaseerd op het leren over brandveiligheid. Bovendien maakt de laatste activiteit het artikel geschikt voor discussies met betrekking tot de beperkingen en gevaren van chemie en wetenschap en hun toepassing in het echte leven.
Christiana Nicolaou, Archangelos Basisschool, Nicosia, Cyprus