Chimica domestica: solventi e smacchiatori Teach article
Spiegare la chimica: i prodotti casalinghi come l’acetone ed il detersivo per il bucato possono essere usati per dimostrare dei concetti chimici come le forze intermolecolari e le reazioni redox.
Associare l’insegnamento delle scienze alle esperienze personali e di vita quotidiana degli studenti può spronarli ad impegnarsi e comprendere la chimica. Questo articolo descrive degli esperimenti semplici con prodotti che possono essere trovati o a casa o al supermercato. Le attività coprono diversi concetti chimici: forze intermolecolari, reazioni redox e le proprietà dei solventi.
Tutte le proposte possono essere adattate a diversi livelli scolastici, dai 13 ai 18 anni, e possono essere utilizzati per diversi metodi di insegnamento (per esempio, lavoro di gruppo, apprendimento per casi-studio).
Attività 1: Scoprire le forze molecolari con l’acetone per unghie
Esperimento 1: Analizzare il solvente acetone
L’acetone è il sovente usato solitamente per rimuovere lo smalto dalle unghie, anche se a volte si usa l’ alcol (etanolo). Il punto di ebollizione di questi due liquidi è inferiore a quello dell’acqua. Tale caratteristica li rende dei liquidi volatili.
Norme di Sicurezza
Indossare camice, guanti e occhiali propettivi. L’acetone è altamente infiammabile. Tenerlo lontano da fonti di calore, scintille e fiamme. Causa irritazione agli occhi. L’esposizione prolungata può portare a cute secca e screpolata.
Occorrente
- 2ml di acqua, acetone ed etanolo
- Palloncini di colori differenti, uno per ogni liquido
- Contenitori da 600ml o più grandi per ogni palloncino
- Acqua molto calda (sufficiente a riempire per metà i contenitori)
Procedimento
- Portare l’acqua a circa 80 gradi direttamente nei contenitori. Oppure usare un bollitore e riempire i contenitori per metà.
- In ogni palloncino, inserire 2ml circa di uno dei liquidi. Chiudere bene il palloncino.
- Immergere il palloncino nell’acqua calda. Si gonfieranno a seconda della facilità di volatilizzazione del liquidi all’interno.

Immagine cortesemente concessa dagli autori

Immagine cortesemente concessa dagli autori
- Spiegare i risultati riferendosi all’intensità delle forze intermolecolari tra le molecule dei solventi.
Un’alternativa è inserire alcuni millilitri di ogni liquido in delle provette. Pallocini di diverso colore sono posizionati su ogni provetta ed ogni provetta è immersa in acqua calda. Più i liquidi sono volatili più si gonfiano i palloncini.

Discussione
Discutere le seguenti domande con gli studenti per esplorare i concetti chiave:
- Quale palloncino si gonfia più velocemente?
- In quale palloncino pensi che le forze molecolari del solvente siano più deboli?
- Confrontando le strutture di 3 sostanze (acetone, etanolo e acqua), quale molecole formano legami idrogeno?
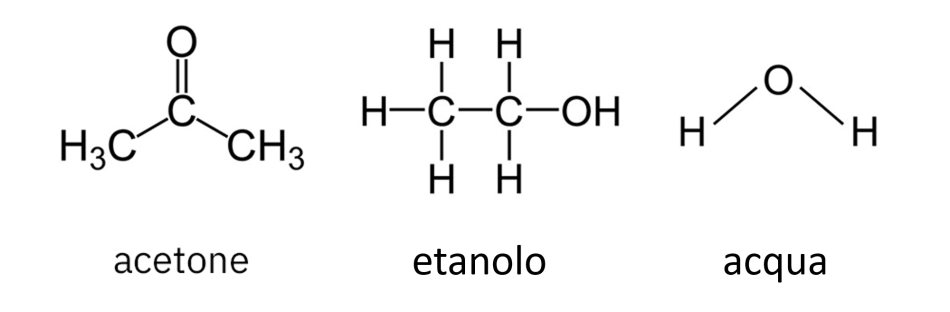
Spiegazione
Nei liquidi volatili, i legami tra le molecole sono più deboli di quelli tra le molecole d’acqua.
In questo caso, i legami più deboli sono dovuti ad una minore polarità delle molecole. E’ il caso di interazioni molto deboli, come le forze di London (dipoli indotti) facenti parte delle forze di van der Waals e legami idrogeno.
Esperimento 2: Dimostrazione di tre proprietà dell’acetone
Questa dimostrazione richiede qualche goccia di acetone. Per una dimostrazione più efficace, è meglio diminuire la luminosità della stanza.
Norme di Sicurezza
Indossare camice, guanti e occhiali propettivi. L’acetone è altamente infiammabile. Tenerlo lontano da fonti di calore, scintille e fiame. Causa irritazione agli occhi. L’esposizione prolungata può portare a cute secca e screpolata.
Occorrente
- Tubo in PVC, lungo circa 2 m e con un diametro di 2 cm, sistemato a mo’ di spirale
- Quattro supporti con morse da laboratorio
- Filo
- Acetone
Procedimento
- Posizionare i supporti a circa 40 cm uno dall’altro a formare un quadrato.
- Posizionare il tubo in PVC a mo’ di spirale rivolta verso il basso e fissarlo con del filo.
- Posizionare una piccolo candela accesa all’estremità del tubo.

Immagine cortesemente concessa dagli autori
- Versare circa 1-2 ml di acetone nell’estremità superiore del tubo.
- Dopo alcuni secondi, osservare una fiamma di colore blu percorrere il tubo.
Discussione
Discutere le seguenti domande assieme agli studenti per esplorare i concetti chiave:
- Perchè la fiamma sale lungo il tubo?
- Le lettere in basso stanno per acetone volatile densità combustione. Come questo esperimento dimosta queste tre proprietà dell’acetone?
Spiegazione
Inizialmente l’acetone si volatilizza, poi l’acetone allo stato di vapore, avendo una densità maggiore dell’aria (acetone: ρ = 2.4 g/l; aria: ρ = 1.1 g/l, in condizioni standard), scende lungo il tubo ed è acceso dalla fiamma a causa del mix di acqua ed acetone allo stato di vapore creato al’interno del tubo.
Attività 2: Sperimentare la chimica delle reazioni redox con agenti smacchianti
Norme di Sicurezza
Indossare camice e occhiali protettivi. Seguire le norme di sicurezza sulla confezione per tutti i detersivi.
Il perborato di sodio è tossico se ingerito e, se inalato, può causare irritazione delle vie respiratorie. Evitare il contatto con gli occhi. Se ciò dovesse succedere, lavare con abbondante acqua.
Il percarbonato di sodio, in condizioni d’uso normali e nella sua forma originale, non è pericoloso, ma può causare irritazione se inalato. In caso di contatto con gli occhi, lavare con abbondante acqua.
L’idrossido di sodio è una base forte. In caso di contatto con la pelle, lavare immediatamente con abbondante acqua. In caso di contatto con gli occhi, lavare attentamente con acqua per diversi minuti (rimuovere le lenti prima) e consultare il medico.
Occorrente
- Provette
- Spatola
- Contagocce
- Perossido di idrogeno al 3% (H2O2)
- Perborato di Sodio (NaBO3)
- Pastiglie di candeggina con “ossigeno attivo” basato su percarbonato di sodio, tipo Neutrex.
- Una soluzione di disinfettante iodiopovidone (spesso venduto con il nome commerciale di Betadine o Topionic)
- Idrossido di sodio (NaOH) 1M

Pastiglie contenenti 5-15% di percarbonato di sodio.

Procedimento
- Preparare 3 provette:
Provetta 1: 1M NaOH (1ml) + H2O2 (1 ml)
Provetta 2: acqua (1 ml) + una punta di spatola di perborato di sodio
Provetta 3: acqua (1ml) + una punta di spatula di pastiglie all’ossigeno attivo
- Riscaldare delicatamente il tubo 2.
- Aggiungere 5 gocce di iodioprovidone in ogni provetta.
- Annotare ciò che succede in ogni provetta.
Discussione
Discutere le seguente domande con gli studenti per esplorare concetti chiave:
- Spiegare gli effetti dell’aggiunta del perborate di sodio nel secondo tubo
- Spiegare gli effetti dell’aggiunta della pastiglia di ossigeno attivo (con percarbonato di sodio) nel terzo tubo
- I “detersivi ecologici” contengono percarbonato di sodio. Fornire una ragione del perchè questi prodotti sono considerati migliori per l’ambiente rispetto a quelli con perborato di sodio. Suggerimento: Prendere in considerazione la temperatura.
Spiegazione
Lo iodioprovidone è un composto chimico idrosolubile formato da polivinilpirrolidone con lo iodio.

Modificato da Vaccinationist/Wikimedia, Public Domain
Le molecole di iodio, che conferiscono il colore marrone alla soluzione di iodioprovidone, reagiscono con H2O2 formando acido iodidrico, incolore.
In ogni tubo, si vede la formazione di bolle gassose. Questo gas è l’ossigeno generato dalla decomposizione del H2O2 a seguitodella reazione con lo iodio.

Provetta 2: perborato di sodio
Provetta 3: pastiglia di candeggina contenente percarbonato di sodio
Immagine cortesemente concessa dagli autori

Immagine cortesemente concessa dagli autori
Provetta 1
Ossidazione: H2O2 (aq) + 2 OH− (aq) → O2 (g) + 2 H2O (l) + 2 e−
Riduzione: 2 e− + I2 (aq) → 2 I− (aq)
Reazione Completa: H2O2 (aq) + I2 (aq) + 2 OH− (aq) → O2 (g) + 2I− (aq) + 2H2O (l)
Aggiungiamo alcune gocce di idrossido di sodio per rendere il mezzo alcalino. Altrimenti la reazione non avviene.
Provetta 2
Inizialmente, avviene una reazione di decomposizione dello ione perborato che si dissolve in acqua e poi il perossido di idrogeno formato reagisce con il complesso dello iodioprovidone. Il perborate di sodio può agire come candeggina e produrre, dalle molecole di perborate, ossigeno in soluzione, solo quando reagisce ad una temperatura maggiore o uguale a 60 °C.
NaBO3 (aq) + H2O (l) → NaBO2 (aq) + H2O2 (aq)
Quando il perossido di idrogeno reagisce con lo iodio, come prima:
Ossidazione: H2O2 (aq) + 2 OH− (aq) → O2 (g) + 2 H2O (l) + 2e−
Riduzione: 2e− + I2 (aq) → 2I− (aq)
Reazione Completa: H2O2 (aq) + I2 (aq) + 2 OH− (aq) → O2 (g) + 2 I−(aq) + 2 H2O (l)
Provetta 3
Quando il sodio percarbonato si dissolve in acqua, si decompone in due sostanze: il carbonato di sodio (un surfattante che migliora la sua efficacia come detergente) e il perossido di idrogeno.
Neutrex è un detergente fortemente basico che contiene percarbonato di sodio, i risulati dunque sono gli stessi di quelli visti nella seconda provetta. La natura alcalina di queste sostanze non richiede l’aggiunta di idrossido di sodio nella provetta affinchè la reazione possa avvenire.
I detersivi ecologici contengono percarbonato di sodio, che funziona in acqua fredda. Non è quindi richiesto il calore, rendendo il processo di lavaggio più sostenibile.
Na2CO4 (aq) + H2O (l) → Na2CO3 (aq) + H2O2 (aq)
Il perossido di idrogeno reagisce con lo iodio come prima.
Ringraziamenti
Gli esperimenti di questo articolo sono stati sviluppati dagli autori e modificati da procedimenti riportati da altri autori[1–3] concambi nei prodotti e nel contesto in cui gli esperimenti sono stati effettuati.
Tutti gli esperimenti sono stati effettuati in classe da studenti di una scuola superiore e presentati come workshop al congresso della French Union of Physics and Chemistry Teachers (UdPPC) a Bordeaux nel 2018 e al congresso della Belgian Association of Physics and Chemistry Teachers (ABPPC), a Louvain la Neuve (2017).
References
[1] Schwedt G (2003) Experimente mit Supermarktprodukten: Eine chemische Warenkunde. Wiley-VCH, Weinheim. ISBN: 3-52732-450-X
[2] Andersen E, Brown A (2012) The effect of heat: simple experiments with solids, liquids and gases. Science in School 24: 23–28.
[3] Segura M, Corominas J (2020) POP chimie. Le Bup physique chimie 114: 271–285.
Resources
- Video sugli ingredienti dello smalto per unghie.
- Informarsi sulla scienza della tintura per capelli: Guenard R (2015) Colour to dye for. Science in School 32: 10–13.
- Provare alcuni esperimenti divertenti con detersive per il bucato: Soler ML (2019) Which laundry enzymes work best? Science in School 46: 34–39.
- Apprendere la chimica usando il té: Prolongo M, Pinto G (2021) Tea-time chemistry. Science in School 52.





