Cos’è la chemiluminescenza? Understand article
Tradotto da Teresa Celestino. Meduse che risplendono, lucciole brillanti, curiosi tubi lucenti; Emma Welsh ci introduce al bello e misterioso mondo della chemiluminescenza.

Immagine gentilmente
concessa da Erik Solheim;
fonte: Wikimedia Commons
Lucciole, meduse, glow stick: le prime volano, le seconde vivono nelle profondità degli oceani, gli ultimi adornano locali di intrattenimento come i night club. Cos’hanno in comune? La risposta si trova in un intrigante fenomeno chimico che produce luce.
La chemiluminescenza è la produzione di luce a partire da una reazione chimica. Due specie chimiche reagiscono per formare un intermedio eccitato (ad alta energia), che rilascia parte della sua energia sotto forma di fotoni di luce (consultare il glossario per i termini in grassetto) per poi ritornare al cosiddetto “stato fondamentale” (si veda la Figura 1, in basso).
A + B -> AB* -> Prodotti + Luce
Intermedio
eccitato
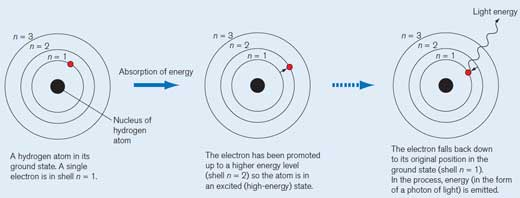
Un atomo di idrogeno nel suo stato fondamentale. Un singolo elettrone è nel livello corrispondente a n = 1. Ad ogni livello corrisponde una determinata energia.
Quando l’atomo di idrogeno assorbe un quanto (una quantità definita) di energia, è promosso ad un livello energetico più alto (n = 2) corrispondente allo stato eccitato (ad alta energia), per indicare il quale si disegna un asterisco vicino alla formula della molecola.
L’elettrone ricade nella sua posizione originaria nello stato fondamentale (n = 1). Durante questo processo, un pacchetto di energia (fotone) è rilasciato sotto forma di radiazione elettromagnetica, la cui lunghezza d’onda dipende dalla quantità di energia in gioco. Se la lunghezza d’onda risultante è compresa nell’intervallo della luce visibile, la transizione elettronica sarà percepibile come luce colorata. La lunghezza d’onda determina il particolare colore (si veda la Figura 2, in basso).
Immagine gentilmente concessa da Chemistry Review
Immagine gentilmente concessa da NASA
Solitamente le reazioni chemiluminescenti non rilasciano molto calore, poiché gran parte dell’energia è rilasciata sotto forma di luce. Il luminolo emette luce quando reagisce con un agente ossidante; la chimica di questa reazione è spiegata nel Riquadro 1.
Riquadro 1: Luminolo, una sostanza che luccica nel buio
Il rilascio di un fotone di luce da parte di una molecola di luminolo è il risultato di un processo a più stadi abbastanza complicato. In una soluzione alcalina, il luminolo esiste in equilibrio con il suo anione di carica -2. L’anione può esistere in più forme (o tautomeri), con le due cariche negative delocalizzate sugli atomi di ossigeno (forma enolica) o sugli atomi di azoto (forma chetonica; si veda la Figura 3, in basso).
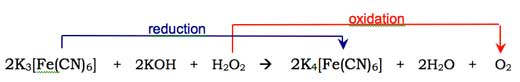
La molecola di ossigeno (O2) reagisce con la forma enolica dell’anione del luminolo, ossidandolo a perossido ciclico. L’ossigeno richiesto è prodotto tramite una reazione redox (nella quale si verificano ossidazione e riduzione) che coinvolge il perossido di idrogeno (H2O2), l’idrossido di potassio e (per esempio) l’esacianoferrato (III) di potassio (K3[Fe(CN)6], noto anche come ferricianuro di potassio. Lo ione esacianoferrato (III), ([Fe(CN)6]3-) è ridotto allo ione esacianoferrato (II) ([Fe(CN)6]4-, che origina il ferrocianuro di potassio K4[Fe(CN)6]), mentre i due atomi di ossigeno che provengono dal perossido di idrogeno si ossidano, passando dallo stato di ossidazione –1 a 0:
Quindi il perossido ciclico si decompone per dare il 3-amminoftalato (acido 3-ammino-1,2-benzendicarbossilico) allo stato eccitato, assieme a una molecola di azoto (N2) – si veda la Figura 3, in basso. Questa reazione di decomposizione è favorita poiché essa fa sì che si rompano alcuni legami deboli della molecola del perossido ciclico, molto instabile. È inoltre favorita dall’aumento di entropia (grado di disordine del sistema) dovuto alla liberazione di una molecola allo stato gassoso. Quando la molecola eccitata di 3-amminoftalato abbassa la sua energia fino a quella dello stato fondamentale, viene rilasciato un fotone di luce blu.
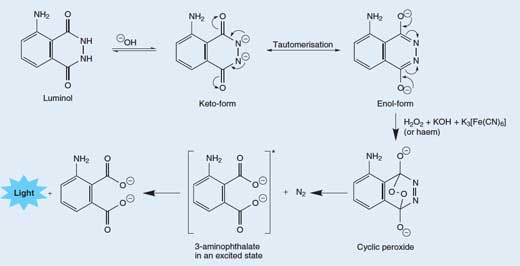
I tautomeri sono molecole con la stessa formula bruta, ma differente disposizione di atomi o legami. I due tautomeri possono interconvertirsi l’uno nell’altro; le frecce curve mostrano il movimento degli elettroni che realizza il passaggio da una forma all’altra. Cliccare sull’immagine per ingrandirla
Immagine gentilmente concessa da Chemistry Review
La chemiluminescenza nelle scienze forensi
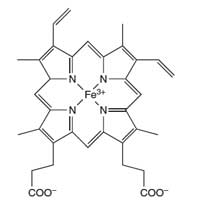
haemoglobin
L’atomo di ferro (Fe) al centro
dell’anello porfirinico
catalizza la reazione del
luminolo
Immagine gentilmente
concessa da Chemistry Review
Gli scienziati forensi usano la reazione del luminolo per rilevare la presenza di sangue sul luogo del delitto. Una miscela di luminolo in una soluzione diluita di perossido di idrogeno è spruzzata sulle superfici sulle quali gli scienziati sospettano la presenza di sangue. Il ferro presente nel gruppo eme dell’emoglobina (si veda la Figura 4) del sangue agisce da catalizzatore della reazione descritta nel Riquadro 1. Se la stanza è buia ed è presente del sangue, si vedrà risplendere un colore blu per circa 30 secondi. Gli investigatori possono conservare traccia di questa luce blu tramite una registrazione video, che può essere usata in tribunale per provare la presenza di sangue (per una attività didattica sulle scienze forensi, si veda Wallace-Müller, 2011.
Poiché il ferro funge da catalizzatore, la sua presenza è richiesta solo in tracce, quindi è necessaria una presenza esigua di sangue per ottenere un risultato positivo. Questo significa che la presenza di sangue può essere rilevata anche quando non è visibile a occhio nudo.

di un crimine
Immagine gentilmente
concessa da How Stuff Works
Uno degli inconvenienti dell’uso del luminolo è che la reazione può essere catalizzata da altre sostanze chimiche eventualmente presenti sulla scena del crimine, per esempio leghe contenenti rame, detergenti come la candeggina, e persino il rafano. Un assassino previdente potrebbe pulire il sangue con la candeggina per distruggerne ogni traccia, ma un eventuale tappeto scolorito non farebbe altro che rafforzare i sospetti di un crimine. Anche l’urina contiene piccole quantità di sangue, abbastanza per catalizzare la reazione del luminolo. Inoltre, una volta che il luminolo è stato applicato può essere d’intralcio per eseguire altri tipi di test sulla stessa superficie. Ad ogni modo, a dispetto di questi inconvenienti, il luminolo è ancora usato nelle scienze forensi come strumento per risalire all’autore di un crimine.
Nel nightclub
glow stick. Cliccare
sull’immagine per ingrandirla
Immagine gentilmente
concessa da Chemistry Review
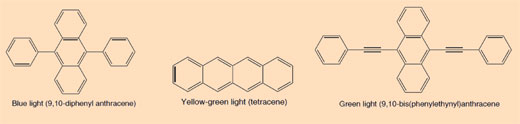
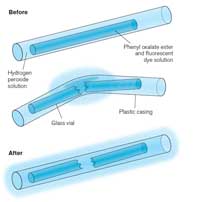
Quando un glow stick si rompe e comincia a luccicare, la luce prodotta è un esempio di chemiluminescenza (si veda la Figura 5). I glow stick sono costituiti da un tubo di plastica contenente una miscela con difenilossalato e un colorante (che conferisce al glow stick un particolare colore). All’interno del tubo di plastica c’è un ulteriore tubo di vetro con all’interno del perossido di idrogeno. Quando il tubo di plastica esterno viene piegato, il tubo interno si rompe rilasciando il perossido di idrogeno e dando luogo a una reazione chimica con emissione di luce (si veda il Riquadro 2). Il colore della luce che il glow stick produce è determinato dal colorante usato (si veda il Riquadro 3).
Le reazioni chemiluminescenti come quelle che avvengono nei glow stick dipendono dalla temperatura. La velocità di reazione aumenta infatti con la temperatura: rompendo il glow stick in acqua calda si produce una meravigliosa luminescenza, che però avrebbe una durata maggiore a temperatura ambiente. Viceversa, la reazione procede più lentamente a basse temperature; questo spiega perché conservare il glow stick nel freezer per parecchie ore permette di vederne ancora il luccichio una volta rimosso e scaldato, per un tempo che sarebbe meno lungo in altre condizioni. Nel freezer la reazione non è completamente arrestata, ma la sua velocità è così bassa che la luce è appena rilevabile.
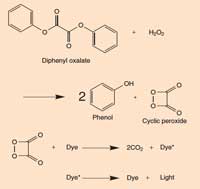
Riquadro 2: La chimica del glow stick
ingrandirla
Immagine gentilmente
concessa da Chemistry Review
Quando il difenilossalato reagisce con il perossido di idrogeno (H2O2), si ossida per dare un fenolo e un perossido ciclico. Il perossido reagisce con una molecola di colorante per dare due molecole di diossido di carbonio (CO2) e nel processo un elettrone nella molecola di colorante è promossa allo stato eccitato. Quando la molecola di colorante eccitata (ad alta energia) ritorna al suo stato fondamentale è rilasciato un fotone di luce. La reazione è dipendente dal pH. Quando la soluzione è leggermente alcalina la reazione produce una luce più intensa.
Consigli per la sicurezza
il fenolo è tossico, quindi se il glow stick cola si deve stare attenti nell’evitare il contatto del liquido con le mani; se ciò accade si devono immediatamente lavare le mani con acqua saponata. Consultare inoltre le norme generali di sicurezza di Science in School.
Riquadro 3: Cosa produce i differenti colori dei glow stick?
I coloranti usati nei glow stick sono composti aromatici coniugati (areni). Il grado di coniugazione produce i diversi colori della luce emessa quando l’elettrone abbassa la sua energia dallo stato eccitato allo stato fondamentale.
Glow stick viventi

luce
Immagine gentilmente
concessa da Terry Priest; fonte:
Flickr
Avete mai passeggiato di notte lungo la riva del mare vedendo sprazzi di luce attorno ai vostri piedi? Siete mai stati in una campagna notturna tra le lucciole che vi svolazzano intorno? Si tratta di alcuni esempi di bioluminescenza, fenomeno esibito da circa il 90% delle forme di vita degli abissi marini. Questi organismi si sono evoluti per produrre luce in modo da esplicare molte utili funzioni. La luminosità può essere usata come esca per catturare le prede, per mimetizzarsi o per attirare l’attenzione in vista di un possibile accoppiamento.
Il termine inglese “glow-worm” indica le larve di molte specie di insetti, incluse le lucciole; alcune specie luccicano per scacciare i predatori, mentre altre usano la luce per attrarre le prede. Ci sono specie di calamari e crostacei capaci di rilasciare chiazze di liquido bioluminescente in modo da confondere i predatori mentre cercano di fuggire. Le creature che vivono nelle profondità degli oceani si sono evolute per produrre principalmente luce verde o blu poiché questa si propaga bene attraverso l’acqua marina. Ciò accade perché la luce blu è caratterizzata da una lunghezza d’onda più corta di quella della luce rossa, di conseguenza è assorbita meno facilmente dalle particelle presenti nell’acqua.
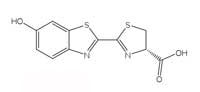
luciferina della lucciola.
Cliccare sull’immagine per
ingrandirla
Immagine gentilmente
concessa da Chemistry Review
(structure)
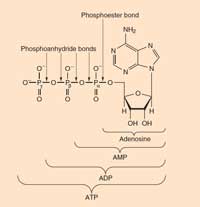
Le reazioni bioluminescenti usano l’ATP (adenosina trifosfato) come sorgente di energia. La struttura delle molecole che producono la luce varia da specie a specie, ma tutte sono indicate con il nome generico di luciferine. La struttura delle luciferine delle lucciole è mostrata nella Figura 6, a sinistra. Quando le lucciole emettono luce, la luciferina è ossidata per dare un complesso eccitato, che successivamente abbassa la sua energia fino allo stato fondamentale rilasciando un fotone di luce, proprio come nella reazione chemiluminescente del luminolo descritta nel Riquadro 1. Ad ogni modo, le lucciole non usano il perossido di idrogeno e l’esacianoferrato (III) di potassio per ossidare la luciferina; usano invece la molecola di ossigeno congiutamente ad un enzima chiamato luciferasi (anche questo è un nome generico – le luciferasi variano da speciea specie).

per la prima volta nella
medusa Aequorea victoria
Immagine gentilmente
concessa da Typoform / the
Royal Swedish Academy of
Sciences (RSAS)
Luciferasi
Luciferina + O2 → Ossiluciferina + Luce
Sono stati effettuati alcuni esperimenti per studiare l’aequorina, una proteina trovata in alcune meduse che produce luce blu in presenza di calcio (si veda Shaw, 2002, e Furtado, 2009) che può quindi essere usata in biologia molecolare per misurare la concentrazione di calcio cellulare. Qualche scienziato ha ideato altri modi per utilizzare la bioluminescenza in futuro, ad esempio gli alberi di Natale auto-illuminanti. Vi vengono in mente altri interessanti usi potenziali di questo meraviglioso fenomeno naturale?
Glossario
Anion: un atomo (o gruppo di atomi) dotato di carica negativa
ingrandirla
Immagine gentilmente
concessa da Chemistry Review
ATP: l’adenosina trifosfato è presente in tutte le forme di vita conosciute. Si tratta della principale moneta energetica delle cellule. L’ATP si forma dall’ADP (adenosina difosfato) e dal fosfato nel corso di una reazione che produce energia (come l’ossidazione del glucosio), e si scinde (in ADP e fosfato) per rilasciare questa energia a favore delle reazioni non favorite dal punto di vista energetico.
Bioluminescenza: La produzione di luce da parte di organismi viventi. La bioluminescenza può risultare da un assorbimento di luce (fluorescenza o fosforescenza, ad esempio in molti pesci che vivono nelle profondità) o da una reazione chimica (chemiluminescenza, ad esempio nelle lucciole).
Catalizzatore: Una sostanza che aumenta la velocità di reazione ma non è soggetta a una trasformazione chimica permanente durante la reazione stessa (non è consumata nella reazione). I catalizzatori consentono di realizzare la reazione attraverso un cammino alternativo a più bassa energia.
Chemiluminescenza: Un tipo di luminescenza nella quale gli elettroni sono eccitati da una reazione chimica, per esempio la reazione del luminolo descritta nel Riquadro 1.
Coniugato: In chimica i sistemi coniugati che ricorrono più frequentemente sono rappresentati da una sequenza di doppi legami. Nei sistemi coniugati gli atomi sono legati da legami covalenti singoli e multipli alternati (i legami multipli sono principalmente doppi, sebbene sia possibile trovare in coniugazione anche tripli legami). Gli alcheni sono planari; i sistemi coniugati devono sempre essere planari per consentire la delocalizzazione degli elettroni nel sistema. Tutte le molecole di coloranti nel Riquadro 3 costituiscono esempi di composti coniugati.
Legami covalenti: Sono rappresentati dai legami tra due atomi che condividono una coppia di elettroni.

sono delocalizzati in un
sistema coniugato
Immagine gentilmente
concessa da Chemistry Review
Delocalizzazione: Quando le molecole presentano legami coniugati, gli elettroni sono liberi di muoversi attraverso l’intero sistema coniugato. Si dice che questi elettroni sono delocalizzati. Il fenomeno della delocalizzazione è presente negli elettroni dell’anello benzenico, ragione per cui tutti i legami carbonio-carbonio hanno la stessa lunghezza.
Fluorescenza: Un tipo di luminescenza nella quale gli elettroni sono eccitati dalla luce, ad esempio nei marchi di sicurezza sulle banconote.
Luminescenza: La produzione di luce, solitamente a basse temperature, per esempio tramite reazioni chimiche o energia elettrica. L’incandescenza, al contrario, è la luce generata ad alte temperature.
Fosforescenza: come la fluorescenza, a luce dura per un tempo maggiore (secondo alcune definizioni, sopra i 10 nanosecondi), per esempio negli adesivi fosforescenti.
Ringraziamenti
La versione originale di questo articolo è stata pubblicata su Chemistry Review ed è stata riprodotta per gentile concessione dell’editore, Philip Allan. Per abbonarsi a Chemistry Review, giornale rivolto a studenti di chimica dai 16 ai 19 anni, visitare: www.philipallan.co.uk/chemistryreview
References
- Furtado S (2009) GFP: la vita dipinta di verde. Science in School 12: 19-23.
- Shaw A (2002) Genetic chess by the light of a jellyfish. Chemistry Review 12(1): 2-5
- Wallace-Müller K (2011) The DNA detective game. Science in School 19: 30-35.
Resources
- La pagina web del sito di Declan Fleming – interamente dedicato alla chemiluminescenza del luminolo, per studenti di grado avanzato- riporta alcuni esperimenti con questa sostanza: www.chm.bris.ac.uk/webprojects2002/fleming/experimental.htm
- Per una panoramica sugli altri tipi di luce in chimica, leggere:
-
Douglas P, Garley M (2010) Chimica e luce. Science in School 14.
-
Review
Questo articolo offre un modo per motivare gli studenti nella comprensione delle reazioni chimiche. Anche se non sono particolarmente interessati nel sapere perché i glow stick luccicano al buio, saranno sicuramente più entusiasti nel comprendere perché le lucciole o le meduse producono luminescenza, o nello scoprire come il sangue è rilevato sulle scene del crimine. Questo articolo serve anche come introduzione alle reazioni chimiche o per fornire esempi attraenti di reazioni redox, oltre ad illustrare i livelli di energia nel guscio atomico.
L’articolo può essere adattato a differenti fasce di età e per differenti temi e argomenti. Per gli studenti di 14-15 anni potrebbe essere usato per insegnare la chimica di base (struttura atomica e movimenti elettronici nei gusci atomici, introduzione alle reazioni) o la biologia (bioluminescenza). Per questa fascia di età l’insegnante dovrebbe semplificare le nozioni contenute nell’articolo omettendo i dettagli delle reazioni. Per gli studenti di 16-18 anni l’articolo può essere utilizzato per insegnare chimica a un livello più avanzato (reazioni redox, catalizzatori, influenza della temperatura sulla velocità di reazione, effetto del pH sulle reazioni, legami covalenti), fisica (spettro elettromagnetico e fotoni) o genetica (ingegneria genetica). Di seguito alcune domande di comprensione adatte:
- Cos’è la chemiluminescenza?
- Per quale scopo gli scienziati forensi usano la chemiluminescenza?
- Spiega alcune funzioni biologiche della chemiluminescenza.
- Perché dovresti conservare il tuo glow stick nel freezer quando non lo usi?
- Come potresti costruire un albero di Natale che si illumina da sé?
Ana Gil, Spagna