Brže, jednostavnije CRISPR: nova revolucija u genskoj tehnologiji Understand article
Prevela Jadranka Vraneković. Nova sporna tehnologija uređivanje gena (engl. gene editing) čini jeftinijim i jednostavnijim – možda čak i prejednostavnim?

Tipkajući rečenicu uvidiš da si pogrešno utipkao jedno slovo. Obzirom da pogreška može promjeniti smisao rečenice, ti ćeš usmjeriti pokazivač ili kursor na pogrešno slovo, pritisnuti tipku “backspace” i utipkati ispravno slovo. Vrlo jednostavna radnja. Nejvjerojatno, ali takav jednostavan pristup sada je uveden i u laboratorije, sa znanstvenicima u ulozi autora poruka s DNA može biti izmjenjena.
Takvu realnost omogućuje nova tehnologija CRISPR-Cas9, koja je potpuno i vrlo brzo okupuirala znanstvenu zajednicu tijekom posljednjih godina. Kao i kod svakog važnog obećavajućeg biomedicinskog napredka, tako se i ovdje pojavljuju određeni problemi. Naime, velik je broj medijskih članaka o navedenoj tehnologiji, tako da je vrlo moguće da se nastavnici suoče s pitanjima svojih učenika o CRISPR-Cas9. Ovim člankom želimo ukratko pokazati što je CRISPR-Cas9 i njenu važnost.
Što je CRISPR-Cas9?
CRISPR-Cas9 je sistem kojeg rabe bakterije kako bi se obranile od napada virusa, a od nedavno se koristi kao metoda za precizno izrezivanje genoma na određenim točkama. Sistem se sastoji od dvije komponente: CRISPR i Cas9. CRISPR (engl. clustered regularly interspaced short palindromic repeats) predstavlja grupirane pravilno razmaknute kratke ponavljajuće palindromske sekvence koje se nalaze u genomu unutar ponavljajućih DNA slijedova. U blizini tih ponavljanja nalaze se Cas geni, koji kodiraju važne enzime ovog sistema. Jedan od njih je i Cas9, to je nukleaza – enzim koji kida nukleinske kiseline (DNA i RNA).
Kada virus napadne bakteriju, ubacuje svoju nukleinsku kiselinu u bakterijsku stanicu, što potakne proizvodnju Cas enzima koji režu nukleinsku kiselinu virusa na komadiće, kako bi ih ugradili u vlastiti genom na mjesta gdje se nalaze CRISPR sekvence (slika 1). Na taj način bakterijska stanica stječe imunitet: naime u idućem napadu iste vrste virusa, CRISPR sekvenca, zajedno s virusnom nukleinskom kiselinom, kopira se u kratke RNA molekule. Te kratke RNA molekule najprije se povezuju s Cas enzimom što rezultira kompleksom koji prepoznaje virusnu nukleinsku kiselinu, identificiranu na temelju podudarnosti s već ugrađenom sekvencom. Tada Cas9 reže ciljnu virusnu nukleinsku kiselinu, onemogućavajući da virus iskoristi bakteriju za vlastitu replikaciju.
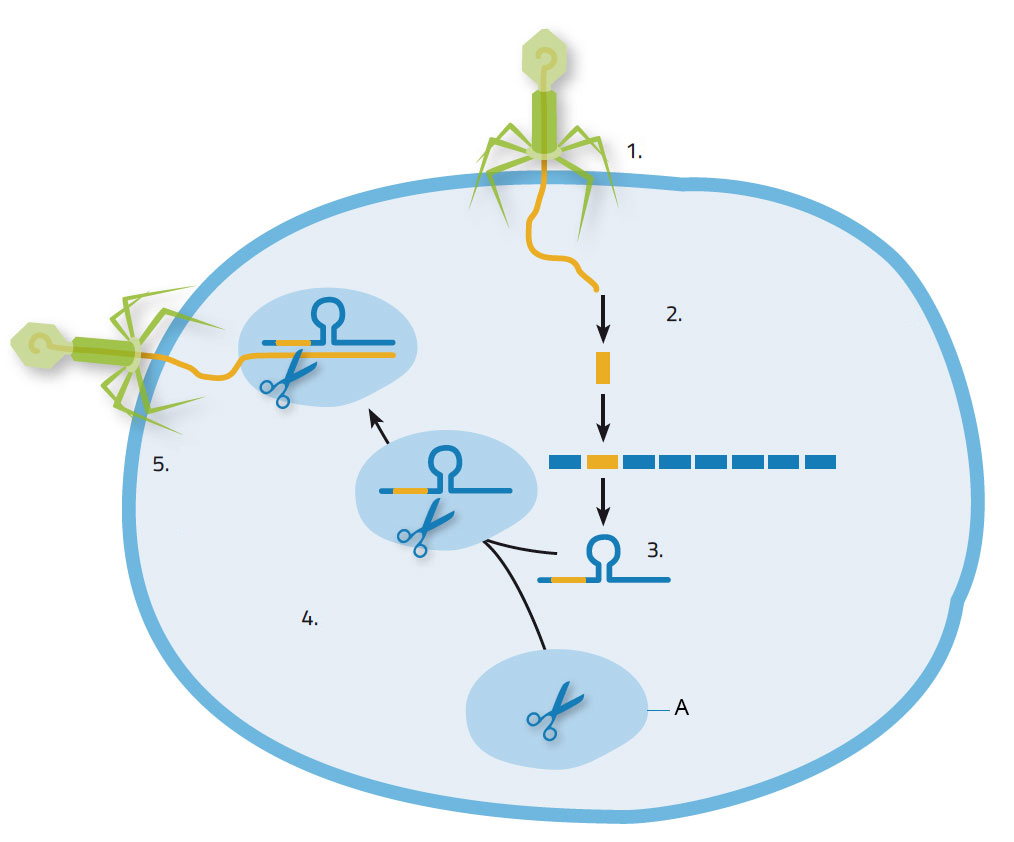
1. Virus napada bakterijsku stanicu; 2. Nukleinska kiselina virusa ugrađuje se u bakterijsku nukleinsku kiselinu na mjestu CRISPR; 3. CRISPR RNA kompleks je formiran; 4. CRISPR RNA vezuje se sa Cas9 enzimom; 5. CRISPR RNA vodi Cas9 enzim do virusa. On reže i uništava viralni genom.
Slika dobivena od Nicola Graf
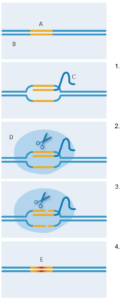
(engl. gene editing) koristeći
CRISPR-Cas9.
A: Ciljna sekvenca; B:DNA; C:
Vodeća RNA; D:Cas9; E:Nova
DNA sekvenca
1. Vodeća RNA veže se sa
ciljnom DNA sekvencom;
2. Cas9 enzim povezuje se sa
vodećom RNA;
3. Cas9 enzim kida oba lanca
DNA;
4. Bakterijski mehanizam
popravka uvodi novu DNA na
mjesto prekida lanca,
zamjenjujući originalnu DNA
sekvencu.
Slika dobivena od Nicola Graf
Kako je taj bakterijski sistem prilagođen za razvoj nove genske tehnologije? Godine 2012, tim Jennifer Doudna sa Sveučilišta California Berkeley, SAD; i Emmanuelle Charpentier, tada sa švedskog Sveučilišta Umea, modificirali su i spojili zajedeno kratke RNA molekule u jednu vodeću RNA (slika 2). To je omogućilo da se jedan kraj vodeće RNA poveže sa Cas9 enzimom, dok sekvenca na drugom kraju lanca može stvarati vezu s bilo kojom ciljnom DNA. Takva prilagodljivost, omogućila je da CRISPR-Cas9 specifično reže izabrani DNA sljed. Nedugo nakon toga, laboratorij Feng Zhang-a Instituta za tehnologiju Massachusetts, SAD, koristili su CRISPR-Cas9 tehnologiju pokazavši njezin učinak u potaknutom preciznom genskom rezanju stanica čovjeka i miša (Cong et al, 2013). Dodatno, podesili su Cas9 enzim kako bi mogao rezati DNA na malo drugčiji način, simulirajući specifičan mehanizam popravka DNA u stanicama. To znači da su znanstvenici uspješno ugradili novu DNA sekvencu u izrezano mjesto, zamjenivši pritom originalnu sekvencu (slika 2).
Taj pionirski podhvat, omogućio je da se CRISPR-Cas9 iz mikrobiološkog okruženja transformira u zanimljivo oruđe znanosti koje omogućuje znanstvenicima da preuređuju gene za različite potrebe s velikom preciznošću i lakoćom.
Za što se koristi?
U proučavanju funkcije gena, znanstvenici često nastoje proizvesti stanične linije ili model organizme kod kojih je gen od interesa mutiran ili inaktiviran (tehnika znana kao sistemska inaktivacija gena). CRISPR-Cas9 tehnologija omogućuje upravo to ali na brži i precizniji način. Cas9 enzim može biti modificiran tako da izgubi mogućnost rezanja DNA, ali još uvijek može zadržati sposobnost vezanja za specifičnu DNA sekvencu, zahvaljujući vodećoj RNA molekuli. To ima isti efekt kao i fizičko blokiranje vezivanja RNA polimeraze, a na taj način znanstvenici kontroliraju traskripciju gena –polaznu točku u genskoj aktivnosti.
Naime, to je važna tehnika u biomedicinskim istraživanjima, CRISPR-Cas9 ima obećavajuću primjenu u zdravstvu. Znanstevnici su već koristili CRISPR-Cas9 metodu za izrezivanje HIV sekvence kako bi prevenirali replikaciju virusa u humanim stanicama. Korištena je i za uklanjanje mutirane sekvence u miša s Duchennovom mišićnom distrofijom, koja uzrokuje mišićnu slabost, stoga ova tehnologija pruža nadu za terapiju kod pacijenata i obitelji s tom bolešću i njoj sličnima. Nedavno je, koristeći CRISPR-Cas9 tehnologiju, provedeno intenzivno uređivanje gena na embrijima svinje u nadi za dobivanjem što sigurnijih organa za transplataciju kod čovjeka.
Dakle, ako je uređivanje gena (engl. gene editing) provedeno na embrijima svinje da li bi ono moglo biti napravljeno i na humanim embrijima? Upravo je to ono što su napravili kineski istraživači 2015 godine, kada su koristili CRISPR-Cas9 kako bi modificirali gen za β-talasemiju u 86 humanih embrija (Cyranoski & Reardon, 2015). Tehnika se nije pokazala dovoljno učinkovitom jer je DNA sekvenca uspješno promjenjena tek u manje od četvrtine embrija. Ipak, objava ovog otkrića dovodi do mnogih nesuglasica zbog mogućih etičkih posljedica.
Etička pitanja – i budućnost
Etička zabrinutost ne odnosi se samo na eksperimente s humanim embrijima već i na istraživanja inženjeringa spolnih stanica. Sa CRISPR-Cas9 teoretski je moguće genetički promjeniti spolne stanice (spermije ili jaje), što bi se moglo prenjeti i na buduće generacije. Stoga takva ideja ima veliki potencijal da iskorjeni genetske bolesti, ali isto tako mora odgovoriti na pitanje; koja modifikacija može biti dopuštena kao medicinski tretman u budućnosti. Da li su svojstva kao što su inteligencija ili boja očiju prikladna za medicinska poboljšanja? Takvi strahovi su pretjerani, ali postoji druga opravdana zabrinutost: a to je da li inženjering spolnih stanica može neočekivano i nepovratno imati efekt na buduće generacije. To je posebno važno obzirom na nedavna istraživanja u kojima su znanstvenici pronašli da je povezanost između gena i drugih nasljednih mehanizama mnogo kompleksnija nego što se to prije očekivalo.
Ti učinci i dalje pljene pažnju znanstvenika. Neki se slažu da inženjering spolnih stanica obiluje etičkim nedoumicama i vjeruju da bilo koje CRISPR-Cas9 istraživanje na humanim embrijima mora biti prekinuto i zaustavljeno. S druge strane su oni koji misle da potpuni prekid neće biti moguć, te da bi se mogao spriječiti napredak daljnjih istraživanja. Bez obzira na različita stajališta, znanstvena zajednica čini sve kako bi se dijalogom i otvorenošću stvorio put za naprijed, što je pokazano na mnogim kongresima i sastancima s ovom tematikom diljem svijeta.
U međuvremenu, razvoj CRISPR-Cas9 metode se nastavlja. Farmaceutske kompanije ulažu u ovu tehnologiju s ciljem napredka u istraživanju razvoja ljekova kako bi se poboljšali postojeći tehnički nedostaci – i to sve dok se vodi spor oko patenta među pionirima ove tehnike (Doudna/Charpentier i Zhang). Bez obzira što će se tu dogoditi, meteorski uspon CRISPR–Cas9 tehnologije tek počinje.
References
- Cong L et al. (2013) Multiplex genome engineering using CRISPR/Cas systems. Science 339: 819–23. doi: 10.1126/science.123
- Cyranoski D, Reardon S (2015) Chinese scientists genetically modify human embryos. Nature 22 April, doi:10.1038/nature.2015.17378
Resources
- Pročitaj više o potencijalnoj upotrebi CRISPR u uređivanju RNA.
- Pročitaj više vezano za sudski spor o patentu CRISPR-Cas9.
- Nauči kako se CRISPR-Cas9 tehnologija može koristiti za lječenje Duchennove mišićne distrofije.
- Pročitaj više kako se CRISPR-Cas9 koristi u proizvodnji organa za humanu transplataciju.
- Pročitaj dostupne članke o etičkim pitanjima vezanim za uređivanje gena u spolnim stanicama.
- Pogledaj jedan članak s komentarima znanstvenika vezanim za etička pitanja o uređivanju gena u spolnim stanicama:
- Bosley K et al. (2015) CRISPR germline engineering – the community speaks. Nature Biotechnology 33: 478–86
- Pročitaj više o Emmanuelle Charpentier i njezinoj revolucionarnoj tehnici za uređivanje gena, te poslušaj diskusiju o njenom radu.
Review
CRISPR-Cas9 je moćno oruđe za uređivanje gena poput “GPS” (navigacijski sustav). Ima potencijal za primjenu u različitim znanstvenim, medicinskim i agrikulturnim sferama. Jednostavnost i mala cijena ove tehnike otvaraju mnoga etička pitanja. Podignuta je i tužba između znanstvenika zbog prava na patent.
Članak jasno opisuje identifikaciju palindromskih ponavljajućih sekvenci, bazu obrambenog sistema bakterija, u primjeni programirane CRISPR-Cas9 tehnologije uređivanja gena. Članak se može koristiti, zajedno s animacijama, za pojašnjenje same tehnike molekularne biologije kao i pojašnjenja zašto je CRISPR-Cas9 zamjenio postojeće metode uređivanja gena (engl. gene editing). Isto tako može poslužiti i kao baza za diskusiju o etičkim pitanjima vezanim za preuređenje spolnih stanica i intelektualno vlasništvo. Pitanja vezana za razumjevanje članka:
- Zašto se koristi CRISPR?
- Kako funkcionira CRISPR-Cas9?
- Koje bolesti bi se mogle liječiti primjenom CRISPR-Cas9?
- Koji su potencijalni rizici korištenja CRISPR-Cas9?
- Koji su etički problemi vazani za korištenje CRISPR-Cas9?
- Tko bi trebao dobiti Nobelovu nagradu za otkriće CRISPR-Cas9?
Mary Brenan, Concord College, UK





