Dans leur élément : les femmes de la table périodique Understand article
Découvrez les femmes qui ont contribué à la découverte des éléments chimiques. Et ce que cela nous dit sur la nature du travail scientifique, hier et aujourd’hui
En mars 1869, le chimiste russe Dmitri Mendeleev présenta son tableau périodique à l’Académie russe des sciences (Gordin, 2004). Ce tableau reposait sur l’idée d’une loi de la nature reliant entre eux les différents éléments et leurs propriétés. Ce système s’est montré suffisamment solide pour résister aux développements ultérieurs de la science, comme la découverte des gaz nobles et des éléments radioactifs, et l’avènement de la physique quantique. Il fête cette année son 150ème anniversaire.
L’histoire du tableau périodique, et l’implication des femmes dans ce projet, a commencé bien avant l’année 1869. Le développement historique d’un domaine scientifique, est souvent décrit au niveau des concepts théoriques, en ignorant les aspects expérimentaux et les observations inattendues qui mènent à ces théories. C’est dans ce domaine relativement négligé que bien des femmes se sont illustrées. Aussi en cette année commémorativew1 et comme pour prendre le contrepied de cette tendance, nous allons nous pencher sur le cas de plusieurs femmes scientifiques dont le travail a contribué de manière significative à nous faire mieux connaître les éléments du tableau périodique.
18ème siècle
Marie-Anne Lavoisier et la notion nouvelle de l’élément chimique

Antoine Lavoisier (1788)
(Cliquer pour agrandir)
Jacques-Louis David, public
domain
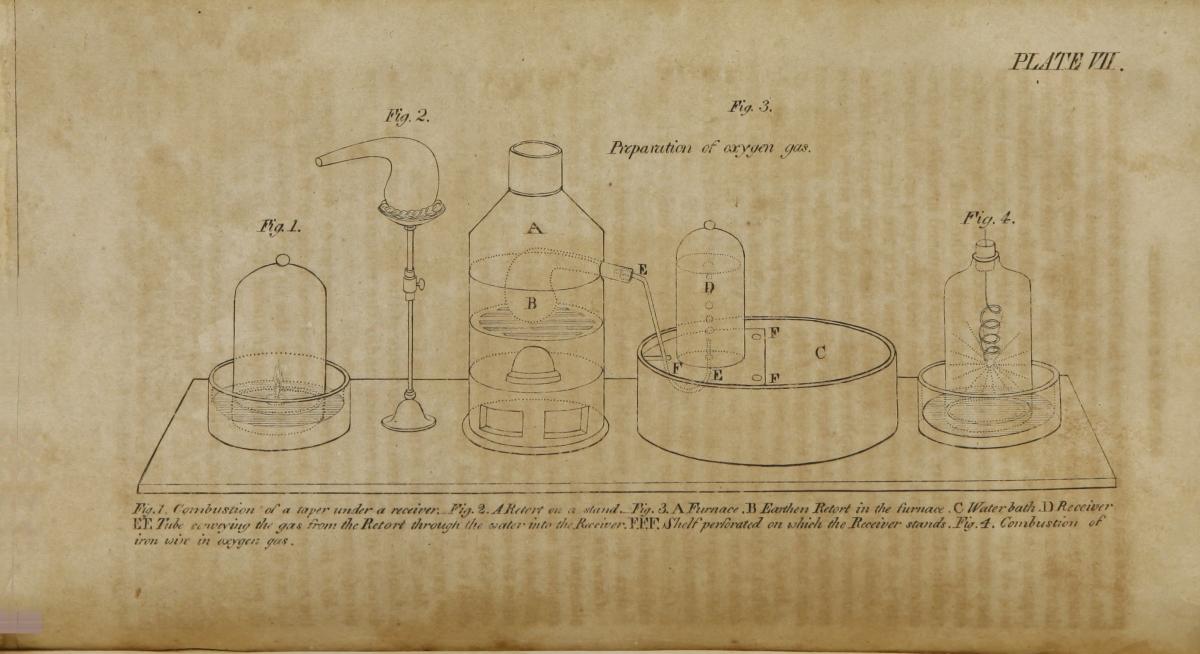
Les années 1780 en France ont été le théâtre d’une véritable révolution pour la chimie, grâce à l’action de l’aristocrate français Antoine Lavoisier. Dans sa Méthode de nomenclature chimique (1787), Lavoisier et ses collaborateurs ont attribué des noms systématiques aux éléments connus, et ont créé une série de règles pour nommer les composés, qui sont toujours valables aujourd’hui. Lavoisier a défini l’élément chimique comme une substance qui ne peut pas être décomposée pendant l’analyse chimique. Il présente une liste de 33 éléments. Cela mettait un point final à l’époque où on considérait que le monde est fait de quatre éléments, la terre, l’eau, l’air et le feu
Il existe une peinture très célèbre de Lavoisier, où il pose avec sa femme. Il est au travail et sa femme semble l’inspirer. Mais dans la réalité, elle a fait beaucoup plus que cela. Elle l’a assisté dans son travail et sa correspondance. Elle a invité des scientifiques venus de l’étranger pour exposer leurs connaissances. Elle les a logés. Elle a traduit en français leurs écrits, en les illustrant de sa main. Elle a même joué un rôle important pour propager la nouvelle chimie, et en particulier le nom de l’élément oxygène, en traduisant et annotant d’un ton critique les opinions du chimiste irlandais Richard Kirwan qui défendait la théorie rivale du phlogistique.
19ème siècle
Jane Marcet vulgarise les éléments
En 1806, près de vingt ans après la révolution de Lavoisier, une Suissesse établie à Londres, du nom de Jane Marcet, a publié un livre de vulgarisation de chimie, qui a connu un tel succès qu’il a été réédité 16 fois en Angleterre, 23 fois aux USA, et qu’il a été traduit en français, allemand et italien (Dreifuss & Sigrist, 2012).
Ecrit sous forme de dialogue destiné à un public féminin, cet ouvrage a fait de la chimie un thème élégant, noble et digne d’intérêt pour le grand public, femmes comprises. L’ouvrage de Jane Marcet était à jour, car il contenait, en plus des éléments décrits par Lavoisier, ceux qui venaient d’être découverts, comme les métaux alcalins et alcalino-terreux (Na, K, Mg, Ca, Sr, Ba) isolés par Humphry Davy. Elle a aussi mentionné les éléments récemment isolés par Jöns Jacob Berzélius et ses élèves (Ce, Er, La, Li, Se, Si, Tb, Th, V, Zr), aussi bien que ceux découvert par William Hyde Wollaston (Pd, Rh), par Smithson Tennant (Ir, Os) et par Charles Hatchett (colombium, plus tard rebaptisé Nb). En sa qualité de femme du monde, elle a réussi à présenter une liste d’éléments bien plus longue que celle de Lavoisier. Mais, même ainsi, elle a dû publier sa première édition de manière anonyme.
US National Library of Medicine/archive.org, public domain
Julia Lermontova et les éléments du platine

A Karvain/Institut Mittag-
Leffler
Le cas de Julia Lermontova est très différent. Elle fut la première femme à obtenir un doctorat en chimie en Allemagne, en 1874. Contemporaine de Dmitri Mendeleiev, elle s’est formée en chimie à Heidelberg, avec Robert Bunsen, et elle a travaillé avec Wilhelm von Hoffman à Berlin. Elle a effectué son travail de doctorat à Göttingen. Il s’agissait de trouver la bonne place où mettre les six éléments du groupe du platine dans le tableau périodique : Ru, Rh, Pd, Os, Ir, Pt. Ces éléments ont presque les mêmes propriétés et presque les mêmes masses atomiques. Il est donc difficile de les obtenir à l’état pur. Et c’est pourtant la condition requise pour calculer leur poids atomique. Cette tâche implique une répétition infinie de recristallisations en série, et cette tâche obscure était souvent confiée à des « soldats de l’ombre » comme Lermontova. Les contributions de cette armée de l’ombre, dont beaucoup étaient des femmes, sont souvent tombées dans l’oubli, et pourtant c’est grâce à elles que ces éléments ont pu avoir une masse atomique précise, et qu’on a pu leur attribuer une place raisonnable dans le tableau périodique de Mendeleiev. Le travail acharné de Lermontova n’a pas été publié de son temps. On l’a redécouvert dans les archives de Mendeleiev presque cent ans plus tard.
20ème siècle
Marie Curie et les éléments radioactifs

leur atelier, vers 1900
Wellcome Collection, CC BY 4.0
Quand bien même le travail de Marie Curie est bien connu, sa performance est stupéfiante. Déjà avant de découvrir le polonium et le radium avec son mari, Pierre Curie, et leur collaborateur Gustave Bémont, Marie Curie a dû créer sa propre méthode de travail, pour extraire 0.1 g de chlorure de radium en 1902 à partir de plusieurs tonnes de minéral pechblende (Quinn, 1995). Ici, la femme de l’équipe, Marie, était mariée à un scientifique, Pierre. Mais ils menaient des projets de recherche indépendants, jusqu’à ce que Pierre réalise le potentiel du travail de Marie sur la radioactivié et qu’il la rejoigne au laboratoire. Dans cet exemple précis, la figure oubliée n’est pas celle d’une assistante, mais d’un chimiste : Bémont
Ida Noddack-Tacke et le rhénium

un spectromètre à rayons X
au laboratoire, 1944
Universiteitsarchief Katholieke
Universiteit te Leuven
La chimiste allemande Ida Noddaclk-Tacke a dû éprouver le même épuisement que Marie Curie, lorsqu’elle a isolé l’un des métaux les plus rares sur Terre, le rhénium (Van Tiggelen, 2001). Ida Tacke et son futur mari Walter Noddack ont annoncé en 1925 la découverte du rhénium. Mais il leur a fallu encore 3 ans pour qu’ils puissent (avec l’aide de Otto Berg, une autre figure masculine oubliée) obtenir assez de rhénium pur (120 mg) pour mesurer sa masse atomique avec précision. Dans l’intervalle, le couple avait parcouru le monde entier à la recherche, presque toujours infructueuse, de minerai d’où extraire le rhénium. Les pages de leurs cahiers de laboratoire témoignent des milliers d’analyses répétitives et fastidieuses qu’ils ont dû effectuer, la plupart du temps en vain. Comme les Curie, les Noddack formaient un couple collaboratif, même si la carrière d’Ida est restée financièrement et académiquement dans l’ombre de celle de son mari.
Stefanie Horovitz et la preuve de l’existence des radioisotopes.
du Radium, Vienne, 1915
Austrian Central Library for
Physics, Vienna
Le travail de la chimiste polonaise et juive Stefanie Horovits a fourni la première preuve de l’existence des isotopes. Cette idée, que le même élément peut avoir des masses atomiques différentes, avait été suggéré par le chimiste anglais Frederick Soddy en 1913, en utilisant un terme fabriqué par une doctoresse anglaise, Margaret Todd. A cette époque on avait découvert environ 35 éléments radioactifs différents, qu’il était impossible de placer tous dans la table périodique. L’introduction du concept d’isotopes a résolu ce problème, puisque, peu à peu, on s’est aperçu que ces nouveaux éléments étaient des isotopes d’éléments connus. Mais au début, ce concept a été accueilli avec scepticisme.
Pour renforcer la cause des isotopes, Soddy avait suggéré qu’il y avait peut-être deux sortes de plomb, et qu’il serait utile de savoir si le plomb issu de la série de l’uranium avait la même masse atomique que le plomb naturel. En 1914, Stefanie Horowitz reçut la mission de mener à bien cette recherche, de la part de son supérieur, Otto Hönigschmid, à l’Institut du Radium, de Vienne. Après avoir passé des jours à extraire et à purifier le peu de plomb qui se trouve dans les mines d’uranium, elle parvint à montrer que le plomb naturel est plus lourd que le plomb issu de l’uranium. La différence était bien supérieure à l’erreur expérimentale, ce qui confirme l’existence des isotopes.
La même Stefanie a ensuite montré l’inexistence de l’élément ionium, récemment découvert, en montrant, toujours avec Hönigschmid, que cet élément avait les mêmes propriétés chimiques et spectroscopiques que le thorium, dont il ne différait que par son poids atomique. L’ionium était donc un isotope du thorium, à savoir Th-230.
Ellen Gleditsch et les isotopes des atomes non radioactifs

1927
Chris Koch
Quoique née et élevée en Norvège, Ellen Gleditsch a appris à mesurer la radioactivité dans le laboratoire de Marie Curie à Paris (Lykknes, 2005). Puis elle s’est rendue à l’Université de Yale, aux USA, où elle a réussi à déterminer la demi-vie du radium naturel, qui est l’isotope Ra-226. Publiée en 1915, cette valeur (1620 ans) a servi de référence et d’étalon pour tous les calculs subséquents relatifs à la radioactivité.
Plus tard, à l’Université Harvard, USA, elle s’est lancée dans l’étude des isotopes. Il était bien connu que la masse atomique des éléments radioactifs, et de ceux qui dérivent de leur décroissance radioactive, variaient en fonction de leur origine géologique. Par exemple, les minerais de thorium naturel contiennent du plomb-208, ce qui augmente la masse atomique du plomb qu’ils contiennent, tandis que dans les minerais d’uranium, la forte teneur en plomb-206 abaisse la masse atomique du plomb qu’on y trouve. On pensait que cette variabilité était propre à la radioactivité, et qu’on ne devait pas la trouver dans les autres éléments.
Mais en 1919, Francis Aston inventa le spectromètre de masse, qui permettait de séparer les atomes selon leur masse et leur charge. Quand il annonça que le chlore était constitué de deux isotopes, à savoir Cl-35 et Cl-37, avec une masse atomique moyenne de 35.46, cette nouvelle fut accueillie avec scepticisme. Et on se demanda si cette composition isotopique variait avec l’origine géologique de l’échantillon. C’est tout le concept des poids atomiques constants, sur lequel reposait la table périodique, qui était mis en doute.
Quand Ellen Gleditsch et son équipe étudièrent ainsi du chlore de différentes origines, ils trouvèrent que la composition isotopique du chlore ne varie jamais. Irène Curie, fille de Pierre et Marie Curie, avait bien trouvé un résultat différent, mais Ellen conclut que l’échantillon des Curie devait avoir été contaminé. En conséquence la masse atomique du chlore restait une constante malgré tout, et ainsi disparut la menace de devoir reconsidérer la stabilité des masses atomiques des éléments stables.
Complexité et collaboration
Si on parcourt l’histoire du tableau périodique, on se rend compte que les femmes y ont joué un rôle important, en tenant les salons du 18ème siècle, en traduisant, disséminant et parfois rédigeant des traités de chimie, en qualité d’épouse, de sœur ou de filles de chimistes, en tant qu’assistantes ou professeurs, tant dans des écoles, des laboratoires que dans l’industrie (Watts, 2007). L’histoire de ces femmes de sciences montre que la recherche scientifique est un problème complexe, et qu’il repose sur la collaboration de tous et toutes. De telles histoires illustrent non seulement les contributions des femmes à la connaissance des éléments, mais aussi la nature profonde du travail scientifique.
Remerciements
Les auteurs aimeraient remercier tous ceux et celles qui leur ont fourni des informations, ce qui leur a aussi permis d’écrire Women in their Element: Selected Women’s Contributions to the Periodic System (publié chez World Scientific, Août 2019). Des remerciements tout particuliers vont aux auteurs suivants : Patrice Bret et Keiko Kawashima, Gisela Boeck, Peter Childs, John Hudson, Marelene and Geoffrey Rayner-Canham, et Xavier Roqué.
References
- Dreifuss JJ, Sigrist NT (2012) The making of a bestseller: Alexander and Jane Marcet’s Conversations on Chemistry. In Lykknes A, Opitz DL, Van Tiggelen B (eds) For Better or For Worse? Collaborative Couples in the Sciences pp 19–32. Basel, Switzerland: Birkhäuser/Springer. ISBN: 3034802854
- Gordin MD (2004) A Well-Ordered Thing: Dmitrii Mendeleev and the Shadow of the Periodic Table. New York, USA: Basic Books. ISBN: 046502775X
- Lykknes A (2005) Ellen Gleditsch: Professor, Radiochemist, and Mentor. PhD thesis, Department of Chemistry, Norwegian University of Science and Technology, Trondheim, Norway.
- Quinn S (1995) Marie Curie: A Life. Cambridge, USA: Perseus Books. ISBN: 0201887940
- Van Tiggelen B (2001) The discovery of new elements and the boundary between physics and chemistry in the 1920s and 1930s. The case of elements 43 and 75. In Reinhardt C (ed) Chemical Sciences in the 20th Century: Bridging Boundaries pp 131–145. Weinheim, Germany: Wiley-VCH. ISBN: 3527302719
- Watts R (2007) Women in Science: A Social and Cultural History. London, UK: Routledge. ISBN: 0415253071
Web References
- w1 – Les Nations Unies ont proclamé 2019 Année Internationale du Tableau Périodique des Eléments Chimiques. Voir l’annonce sur le site Web des Nations Unies.
Resources
- Pour plus de détails sur l’Année internationale du tableau périodique, voir le site Web de l’AIPT2019.
- L’importance du travail de Jane Marcet est plus détaillée dans cet article issu de Chemistry World..
- On lira avec intérêt les articles sur Marie Curie, Antoine Lavoisier et Jane Marcet sur le site du Science History Institute.
- Explorez l’historique du tableau périodique en lisant sur d’autres façons proposées d’organiser les éléments. Voir :
- Lorch M (2019) Arranging the elements: the evolving design of the periodic table. Science in School 47: 26-29.
Review
Si on demandait au citoyen moyen de nommer des femmes qui ont contribué au développement du tableau périodique, il aurait de la peine à en nommer une. Cet article jette un bref mais fascinant regard sur ce problème, et il met en évidence le rôle de bien des femmes (et des hommes) qui ont joué un rôle éminent, sans qu’il soit reconnu.
L’article peut servir à des discussions utiles reliées à de nombreux domaines de la chimie. On pourrait aussi établir des liaisons transversales avec d’autres domaines de la science où le rôle des femmes a été sous-estimé, comme en IT, en mathématiques et dans l’exploration de l’espace. Il conviendrait fort bien pour une activité d’apprentissage ou un exercice de compréhension. Voici quelques questions qu’on peut poser :
- Décrire le rôle qu’a joué Marie-Anne Lavoisier dans l’établissement du concept actuel de l’élément chimique.
- Expliquer pourquoi le livre de Jane Marcet a réussi à faire accepter la notion d’élément chimique dans le public.
- Pourquoi a-t-on eu tellement de peine pour déterminer l’emplacement de certains éléments dans la table?
Caryn Howard, responsible de la chimie, St Mary’s School, Calne, UK





