Chimie et Lumière Understand article
Traduit par Maurice A Casimir. Peter Douglas et Mike Garley recherchent de quelle manière la chimie et la lumière interagissent dans de nombreux aspects d enotre vie quotidienne.

l’aimable authorisation de
BlackJack3D / iStockphoto
Nous utilisons depuis des temps immémoriaux les rayons du Soleil pour nous réchauffer pendant la journée et allumer une flamme pour éclairer notre monde nocturne. Nous contrôlons aujourd’hui la conversion de l’énergie en lumière à partir de l’électricité, de la chaleur et des réactions chimiques; nous utilisons la chimie et la lumière dans notre vie quotidienne pour la communication, la médecine et les loisirs; et les photochimistes sont en train de travailler à un avenir plus propre et plus lumineux en étudiant et concevant de nouvelles méthodes de conversion de la lumière solaire en énergie utilisable et d’élimination photochimique des polluants.
L’émission de lumière: ampoules, lasers, LED et «Liquid Light»
Le composant essential du processus d’émission de lumière réside dans la conversion de l’énergie. Différents types d’ampoules et de systèmes d’éclairage convertissent l’énergie de différentes façons et avec des rendements différents.
Dans l’ampoule à tungstène, l’énergie électrique chauffe un filament à blanc ; l’énergie thermique est donc convertie en énergie lumineuse. L’énergie lumineuse du filament solide se dégage en continu dans le spectre visible, tout à fait comme dans un arc-en-ciel. Malheureusement, l’énergie électrique n’est convertie en lumière visible qu’avec un rendement d’environ 5 à 10%.

Illustration reproduite avec
l’aimable autorisation de
mipokcik / iStockphoto
Dans le tube fluorescent, l’énergie électrique est convertie en énergie d’excitation d’atomes de mercure sous forme vapeur à l’intérieur d’un tube. Le rendement de conversion de l’énergie est dans ce cas environ le double de celui d’une ampoule à tungstène, soit autour de 20%. Toutefois, le spectre lumineux émis par ces tubes (lorsque les électrons retournent à un état non excité) n’est pas continu; au lieu de cela, la lumière est émise à des longueurs d’onde et pour des couleurs spécifiques correspondant aux niveaux d’énergie des atomes de mercure. Les tubes fluorescents pour la maison sont donc revêtus de phosphore blanc pour donner à cette émission de lumière un spectre plus continu. Le remplacement de la vapeur de mercure par d’autres gaz tels que le néon (qui donne une lumière orangée) ou autres gaz inertes permet la production de tubes fluorescents émettant des lumières sous de nombreuses couleurs différentes, utilisés pour des écrans et des signaux lumineux (voir illustration). Différents revêtements de phosphore changent également la couleur de la lumière émise par le tube.

de CD
Illustration reproduite avec
l’aimable autorisation de
Petrovich9 / iStockphoto
On peut convertir encore plus efficacement l’énergie électrique en lumière à l’aide de diodes électroluminescentes (LED) : l’électricité excite des électrons dans des structures en couches de semiconducteurs (voir glossaire pour les termes en italique) spécialement conçues pour émettre une lumière visible, avec un rendement de conversion pouvant aller jusqu’à 35%.Le panneau électroluminescent utilise le même principe. De nombreux lasers utilisent également l’énergie électrique pour générer une lumière laser de haute intensité que l’on peut concentrer en un rayon intense très étroit. Les lasers haute puissance peuvent couper le métal ou peuvent même être utilisés comme scalpels lumineux en chirurgie.

émettant en
chimioluminescence
Illustration dans le domaine
public; source: Wikimedia
Commons
Les lasers servent également dans les communications et les technologies digitales des lecteurs de codes barres et à disque optique.
La “Liquid Light” est basée sur un type différent de conversion de l’énergie – la chimioluminescence – pour produire de la lumière froide par le biais de réactions chimiques plutôt qu’à l’aide d’énergie thermique. C’est ainsi que fonctionnent les tubes de lumière en chimioluminescence. Dans la nature, les vers luisants et les créatures vivant dans l’obscurité des grottes ou des abysses utilisent la chimioluminescence pour leurs communications inter ou intra espèces.
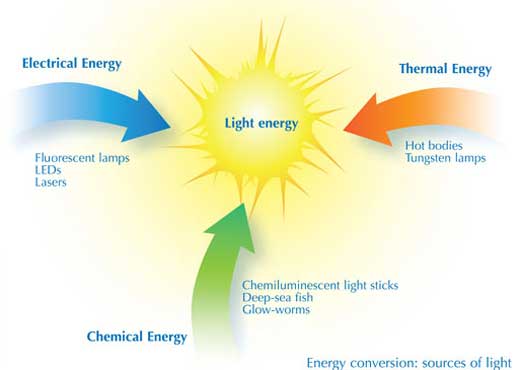
Illustration reproduite avec l’aimable autoriosation de Nicola Graf
Photochimie: fluorescence, matières plastiques, photographie et médecine
On utilise un type d’émission lumineuse – la fluorescence – dans les azurants optiques des poudres à laver. Ils absorbent la petite quantité de lumière UV invisible du spectre solaire et la réémettent sous forme de lumière bleue, rendant les vêtements «plus blancs que blancs». La fluorescence sert également au marquage pour la sécurisation des billets de banque, alors que la phosphorescence (une fluorescence à plus longue durée de vie) est utilisée dans les panneaux de sécurité. La fluorescence, la phosphorescence et la chimioluminescence ont aussi leur utilisation en articles de mode comme des fonds de teint lumineux, des gels de coiffure, des bâtons de rouge à lèvres et de la joaillerie.
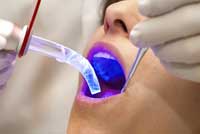
utilisée en dentisterie
Illustration reproduite avec
l’aimable autorisation de
dem10 / iStockphoto
La lumière peut server à fabriquer des matières plastiques. Celles-ci sont obtenues par polymérisation – l’agglomération d’un ensemble de petites molécules (les monomères) pour l’obtention d’une longue molécule (le polymère). Ce procédé nécessite souvent l’action d’une quantité d’énergie suffisante pour faire démarrer le processus, qui une fois lancé, dégage suffisamment d’énergie lors de l’étape d’agrégation pour entretenir le processus. Lorsque la lumière est absorbée par une molécule, cette molécule acquiert de l’énergie provenant du photon absorbé; on dit que la molécule a été excitée. Ces molécules à l’état excité sont d’excellents intitiateurs de la polymérisation du fait de cette énergie supplémentaire – on peut ainsi utiliser la lumière pour convertir des liquides monomères en une matière plastique solide. Ce procédé donne des composés photopolyméres pour ciment dentaire durcissant sous l’action de lumière UV (voir illustration ci-dessous), ainsi que des peintures utilisées pour imprimer des images sur divers substrats – des canettes de boissons non alcoolisées par exemple. Au contraire des peintures conventionnelles, une peinture photopolymère est fixée par la lumière plutôt que par la chaleur et/ou l’oxydation à l’air.

bébé ‘Bili Rubin’, qui montre
comment la lumière est
utilisée dans le traitement de
la jaunisse
Illustration reproduite avec
l’aimable autorisation de Peter
Douglas
Le film photographique repose sur les proprieties photochimiques des sels d’argent halogénés. Lorsqu’un grain de sel d’argent halogéné absorbe un photon de lumière, il émet un atome d’argent. Le film est alors traité chimiquement, et les grains d’argent métalliques forment la partie noire d’un négatif blanc et noir.
L’utilisation la plus connue de la photochimie en medecine concerne le traitement de la jaunisse, due à une substance neurotoxique jaune, soluble dans les corps gras générée dans le corps, appelée bilirubine.
La bilirubine est générée en permanence comme sous produit de l’hémolyse (la dégradation des cellules rouges du sang), mais elle est normalement métabolisée dans le foie sous une forme soluble dans l’eau qui est ultérieurement excrétée. Cependant, si le foie est endommagé ou pas encore formé, la génération non contrôlée de bilirubine peut être fatale. L’exposition à la lumière bleue guérit de la jaunisse grâce à une réaction photochimique qui convertit la bilirubine en sa forme soluble, permettant son excrétion. Dans les hôpitaux, les salles pour bébés prématurés – qui sont particulièrement sensibles à la jaunisse – ont des lits avec éclairage spécial pour le traitement de la jaunisse.
Une autre application médicale de la photochimie concerne l’utilisation de la thérapie photodynamique pour lutter contre le cancer. Un composé de couleur intense à la photochimie particulière est injecté directement dans la tumeur. Ce composé absorbe les cellules cancéreuses de manière préférentielle par rapport aux cellules normales, et lorsqu’il est irradié avec la lumière d’un rayon laser ou d’une autre source, il forme des molécules à l’état excité qui réagissent avec l’oxygène pour générer des composés chimiques mortels pour les cellules cancéreuses.

Illustration reproduite avec l’aimable autorisation de Nicola Graf
Energies propres, planète propre

Illustration reproduite avec
l’aimable autorisation de
narvikk / iStockphoto
La demande mondiale d’énergie augmente alors que les sources d’énergie non renouvelable sont limitées. Une façon d’approcher le problème est de consommer moins d’énergie (par exemple en utilisant des ampoules basse consommation). On peut aussi exploiter des sources d’énergie renouvelable comme les panneaux solaires au silicium qui convertissent l’énergie lumineuse en électricité. Les cellules monocristaux développées à l’origine dans les années 1950 pour faire fonctionner les satellites étaient très onéreuses. Aujourd’hui, des cellules en silicium poly cristallin et en silicium amorphe bien meilleur marché sont communément utilisées dans des systèmes de fourniture d’énergie comme les calculatrices et les chargeurs de batterie, ainsi que dans des installations de production d’énergie à plus grande échelle domestiques, industrielles et même d’importance nationale.
On peut observer en classe la conversion de la lumière solaire en électricité grâce à une cellule de Grätzel, qui emploie la photosynthèse artificielle en utilisant des teintures naturelles trouvées, par exemple, dans les cerises (voir Shallcross et al., 2009).
A l’avenir, un autre vrai probleme résidera dans la nécessité d’avoir un combustible transportable propre. On peut générer indirectement de l’hydrogène à partir de l’énergie solaire par le biais de l’électrolyse de l’eau, mais cette réaction est gourmande en énergie. Aussi consacre-t-on actuellement une recherche approfondie à la décomposition de l’eau en hydrogène et oxygène directement à partir de la lumière solaire.
Comment la chimie et la lumière peuvent elles contribuer par ailleurs à rendre notre planète propre? Le dioxyde de titane (TiO2) est un semi conducteur disposant de certaines propriétés photochimiques intéressantes. On l’utilise comme pigment blanc car il diffuse efficacement la lumière visible. Lorsqu’on l’utilise comme pigment ou absorbeur de rayons UV dans des écrans solaires, chaque particule est revêtue de silice pour empêcher la surface libre du TiO2 de venir au contact de l’environnement. Cela est indispensable, car lorsqu’il est irradié par des rayons UV, les particules de TiO2 génèrent des composés chimiques très réactifs qui détruisent toutes les molécules complexes proches. Ce désavantage apparent du TiO2 en surface libre est aujourd’hui très utile pour la destruction de polluants, car, lorsqu’un tel produit est irradié par des rayons UV, il détruit complètement tous les composés organiques proches. Il en résulte que tous les composés organiques présents sont totalement minéralisés en dioxyde de carbone, eau et ions ammonium et chlorure.
Ces exemples montrent que la chimie et la lumière nous entourent – ells forment une part importante de notre univers technologique et jouent un rôle important pour un avenir plus propre, plus brillant!
Glossaire
Chimioluminescence: La generation de lumière directement à partir d’une réaction chimique, comme pour la lumière émise par les vers luisants et les bâtons lumineux par chimioluminescence.
Electroluminescence: la génération directe de lumière à partir d’électricité, comme dans les écrans des téléphones mobiles.
Fluorescence: l’émission de lumière associée à la transition d’un électron d’un état excité à un état d’énergie moindre durant laquelle l’électron ne modifie pas son spin. De ce fait, l’émission de lumière intervient très rapidement après l’excitation, habituellement en quelques nano secondes. Et donc, si la source d’excitation est supprimée, la fluorescence s’arrête en quelques nano secondes.
Luminescence: un terme général pour definir l’émission de lumière.
Phosphorescence: l’émission de lumière associée à la transition d’un état excité à un état d’énergie moindre durant laquelle l’électron modifie effectivement son spin. Ceci permet à l’émission de lumière de se produire plus lentement, parfois sur une échelle de temps de quelques secondes dans les molécules et souvent encore plus longue pour le phosphore à l’état solide. Et donc, si la source d’excitation est supprimée, on peut continuer à percevoir la phosphorescence, comme dans les autocollants «brillant dans le noir» ou dans la lumière rémanente du phosphore que l’on peut percevoir dans un tube fluorescent après qu’il ait été débranché (c’est-à-dire une fois que la luminescence a disparu).
Thérapie photodynamique: une thérapeutique médicale dans laquelle la lumière est utilisée pour détruire des tumeurs dans le traitement du cancer.
Synthèse de photopolymère: le procédé dans lequel la lumière est utilisée pour créer un polymère à partir de molécules monomères. Le procédé est utilisé pour fixer les peintures, les encres et les colles sensibles à la lumière. Les colles servent communément en dentisterie.
Semi conducteur: Pour les besoins du présent article, la caractéristique importante d’un semi conducteur consiste en l’arrangement des niveaux énergétiques de ses électrons sur deux’bandes’: une ‘bande de valence’ complète à basse énergie et une ‘bande de conduction’ vide à haute énergie. L’excitation fait passer un électron de la bande de valence vers la bande de conduction, laissant derrière lui un ‘trou’. Le trou et l’électron sont tous deux mobiles et peuvent migrer vers la surface du semi conducteur où ils peuvent agir respectivement comme oxydant et réducteur pour la destruction des polluants.
Le Forum Scientifique International de la Jeunesse à Londres
Le present article est basé sur une conférence avec expériences du Dr Peter Douglas et du Dr Mike Garley sur les applications de la chimie et de la lumière dans notre vie quotidienne. La conférence entrait dans le cadre du Forum Scientifique International de la Jeunesse de Londres 2009 et a été suivie par 250 élèves de 40 pays.
Lors du Forum Scientifique International de la Jeunesse de Londres 2010, le Dr Douglas explorer les développements à venir de la science avec des scientifiques éminents, des décideurs et des industriels novateurs. L’opportunité de visiter des sites industriels, des centres de recherche, des institutions et organismes scientifiques, dont certains de niveau mondial, constituera un élément clé du programme. Pour plus de détails sur la manière dont des élèves peuvent participer, voir: www.liysf.org.uk
References
- Shallcross D et al. (2009) Regarder vers le ciel: expériences sur le changement climatique. Science in School 12. http://scienceinschool.org/2009/issue12/climate/french
Resources
- Pour une comparaison du spectre de différentes sources de lumière – et des instructions sur la manière de construire votre propre spectromètre, voir:
- Westra MT (2007) Un oeil neuf sur la lumière : fabriquez votre spectromètre. Science in School 4. www.scienceinschool.org/2007/issue4/spectrometer/frenc
Review
La lumière va bien au delà de la lumière visible. On trouve la lumière utilisée dans tous les domaines de la science, de l’éclairage dans le noir à la dégradation des matières plastiques. Le présent article donne une vue d’ensemble des utilisations pratiques de la lumière et constitue une lecture de base intéressante pour des élèves faisant une recherche sur la lumière comme forme d’énergie.
Andrew Galea, Malte





