Que savons-nous du climat? Sur la piste des facteurs anthropiques dans le réchauffement global Understand article
Traduction Pierre Stouff. Dans cet article, le second de deux, le climatologue Rasmus Benestad de l'Institut Météorologique de Norvège examine les preuves indiquant que ce sont les hommes qui sont à l'origine du changement climatique.
Il est bien établi que notre planète Terre est rendue habitable par un réchauffement du à un effet de serre naturel. Alors pourquoi s’inquiéter d’un réchauffement global du à l’homme (Anthropogenic Global Warming: AGW) ? Après tout, il y a toujours eu des variations naturelles bien avant que l’homme n’arrive; il suffit de regarder les glaciations.
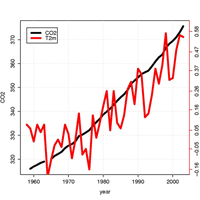
atmosphériques en CO2 (en noir
; de Mauna Loa, Hawaii) et de la
température terrestre moyenne
(T(2m) en orange, sans échelle;
données de la NASA GISS) Cliquez
sur l’image pour l’agrandir
Image reproduite avec l’aimable
autorisation de Rasmus Benestad
Pour des raisons théoriques, on s’attend à ce que la température croisse lorsque la perte de chaleur est diminuée, à apport énergétique constant. Des concentrations croissantes de gaz à effet de serre (GreenHouse Gases: GHGs) ont le même effet qu’une diminution des pertes de chaleur, étant donné qu’ils laissent passer le rayonnement solaire visible mais absorbent la lumière infra-rouge qui constitue le mode de perte de chaleur par la Terre en direction de l’espace. Ainsi, une augmentation de l’effet de serre déséquilibre la balance énergétique radiative.
La première preuve empirique d’un changement climatique en cours fût l’accroissement systématique d’environ 30% du CO2 atmosphérique depuis la concentration de 280 ppm (la courbe noire du graph à droite montre les teneurs en CO2 depuis 1958), à l’époque pré-industrielle. Personne ne met en doute que ce CO2 a une origine fossile, étant donné que les rapports isotopiques montrent que ce carbone a été moins exposé aux rayons cosmiques galactiques (GCRs = Galactic Cosmic Rays).
Lorsque les protons des GCRs entrent en collision avec de l’azote-14 (7 protons plus 7 neutrons dans le noyau) de l’atmosphère, du carbone-14 est créé (en plus d’autres isotopes comme le beryllium-10) lors d’une réaction nucléaire:
14N + p → 14C + n
Cela signifie que le carbone avec une faible teneur en 14C doit avoir une origine profonde, à l’abri des rayons cosmiques.
De plus, le rapport O2 sur N2 a diminué, ce que l’on pense être du à l’augmentation de la combustion de carburants fossiles au cours de laquelle l’ O2 se combine avec le C pour former du CO2. Les océans sont ainsi devenus plus acides, ce qui signifie que l’absorption du CO2 a augmenté à la fois dans l’atmosphère et les océans.
Après tout, le carbone ne peut pas tout simplement disparaître de la surface de la Terre, mais il est – dans des circonstances terrestres habituelles – au contraire conservé. Et donc, la combustion de carburants fossiles doitnormalement produire un surplus de CO2 quelque part dans l’atmosphère, dans les océans et/ou dans la biosphère. Extraire du carbone fossile du sous-sol profond conduit à enlever le carbone des réservoirs profonds pour le relâcher à la surface de la Terre, ou il resta.

autorisation de iStockphoto /
Rob Friedman
Selon l’AR4 (Fourth Assessment Report) de l’IPCC (Intergovernmental Panel on Climate Change), la température moyenne terrestre, estimée à partir de milliers de thermomètres répartis à la surface du globe, a augmenté de 0.74±0.18ºC ces derniers 100 ans, et semble continuer à augmenter. Des études réalisées par satellite ont aussi rapporté des changements dans les caractéristiques spectrales de la chaleur rayonnée par la Terre, corrélés avec l’augmentation de l’effet de serre. Les mesures de temperature par sondage en dessous de la surface peuvent aussi être très utile pour mesurer les changements de température, et ceux-ci aussi indiquent qu’il y a eu un réchauffement.
Le niveau moyen des mers s’élève, ceci étant du d’une part au fait qu’une eau plus chaude occupe un volume plus grand et d’autre part au retrait de nombreux glaciers partout dans le monde depuis la fin du 19ème siècle. La calotte polaire de l’Arctique a nettement diminué depuis que les mesures satellites ont démarré, tout comme la limite des neiges qui a régressé.
Il y a aussi des preuves au niveau du cycle de l’eau, comme des indices de pluies plus fréquentes et abondantes, mais on observe aussi des changements dans le module des rivières et au niveau des statistiques pluviométriques.
Les articles concernant les réponses biologiques cadrent encore davantage avec l’image d’un réchauffement global. Des changements dans la limite de répartition des arbres en altitude, dans la largeur et la densité de leurs cernes de croissance, au niveau des coraux, des sédiments sous-marins et des stalagmites, sont les témoins des variations du climat dans le passé. En comparant les données actuelles avec ces indicateurs, le réchauffement actuel semble être exceptionnel pour au moins les derniers 1000 ans.
Des doutes ?
Certains opposants à la notion d’un réchauffement global anthropique, appelés familièrement climato-sceptiques, ont avancé l’idée que le réchauffement global est une conséquence des variations solaires. Mais les mesures récentes des rayonnements cosmiques, éruptions solaires et autres événements utilisés pour décrire l’état du Soleil, suggèrent que le Soleil n’a pas eu de pic d’activité depuis les années 1950 (voir le graph).
De plus, quoiqu’il puisse advenir au niveau du Soleil, cela n’empêche en rien l’effet des GHGs. Si notre climat se trouvait être sensible à de légers changements au niveau du Soleil, cela signifierait qu’il pourrait être aisément affecté par des changements dans la balance énergétique – et ce serait donc une excellente raison pour penser que les modifications dans le GHGs sont la cause des changement climatiques globaux.
Il y a aussi d’autres facteurs, en plus des GHGs, qui peuvent affecter la balance radiative, comme les changements dans l’orbite terrestre autour du Soleil ou l’activité solaire. Les volcans aussi sont susceptibles d’injecter des particules dans la haute atmosphère qui diminuent le rayonnement solaire, et les aérosols naturels ou produits par l’homme peuvent aussi avoir un « effet de rhéostat » en réduisant la quantité de l’énergie solaire qui atteint la surface terrestre. Les aérosols peuvent aussi affecter le rayonnement terrestre ré-émis, le bilan dépendant du type de particule, de leur taille, de l’altitude et de leur concentration.
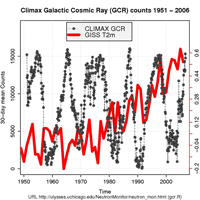
galactiques cosmiques (GCR; en gris)
et la température moyenne terrestre
(T(2m); en rouge). La T(2m) a crû alors
qu’on ne voit pas de tendance générale
pour les GCR. Cliquez sur
l’image pour l’agrandir
Image reproduite avec l’aimable autorisation
de Rasmus Benestad
Des changements dans la nature des sols peuvent aussi jouer un rôle en modifiant la manière dont la planète réfléchit la lumière solaire ainsi que les échanges d’humidité et d’énergie entre la surface de la Terre et l’atmosphère.
Il y a aussi ceux qui ont affirmé que le réchauffement climatique était une illusion, étant un effet de l’urbanisation, mais ceci n’explique pas comment la plupart des océans mondiaux se sont réchauffé dans la partie proche de la surface et en profondeur – là où il n’y a pas de villes. Cela n’explique pas non plus que le réchauffement le plus important a été observé en Arctique, en Alaska et en Sibérie. D’autre part, l’influence des villes sur la température enregistrée a été prise en compte dans l’estimation de la température moyenne globale.
Un autre argument utilisé par les climato-sceptiques a été fourni par les mesures de la température atmosphérique par satellite, qui ne montrent pas le même réchauffement qu’au sol. Mais il y a eu des erreurs dans l’analyse des données satellite, et les variations de la température dans l’atmosphère libre sont maintenant en accord avec les données de la surface.
D’autres ont avancé que notre atmosphère est presque opaque au rayonnement infra-rouge et, comme elle serait déjà saturée, un peu de CO2 en plus n’aurait pas grand effet. Mais il suffit de regarder Vénus pour voir que l’atmosphère ne se sature pas aussi facilement. Cela peut aussi se prouver théoriquement. Parallèlement, ce n’est pas uniquement l’effet CO2 qui compte, car il existe un important processus de feed-back qui peut amplifier (par exemple dans le recul des glaces au niveau de la mer, ou dans l’humidité de l’air), ou atténuer (par exemple pour les nuages de basse altitude) la réponse à un effet de serre changeant.
Mais, le climat n’a-t-il pas toujours été changeant ? Il y a des savants qui soutiennent que notre climat a un comportement cyclique, avec des cycles naturels. Comment alors savoir si le réchauffement actuel n’est pas seulement une étape du cycle naturel ? Par exemple un « rebond » compensateur au petit âge glaciaire ?
Un réchauffement global anthropique aura pour conséquence un réchauffement général, avec une réponse plus nette en Arctique et sur les continents. Dans les zones sub-tropicales, il devrait y avoir davantage de sécheresses, mais les hautes latitudes devraient recevoir plus de précipitations. L’AR4 de l’IPCC suggère que davantage d’inondations et de famines devraient survenir. Les glaciers devraient fondre ce qui implique que les ressources en eau devraient diminuer pour une grande partie de la population mondiale. Une montée du niveau des mers affecterait les zones côtières en dessous du niveau de la mer et, dans certaines régions, des populations seraient amenées à être déplacées.
La saison des ouragans en 2005 a fourni un nombre impressionnant – au moins pour les temps modernes – de cyclones tropicaux dans la zone mer des Caraïbes/Atlantique Nord, dont certains on causé des victimes et provoqué de dégâts importants. Y aura-t-il davantage d’ouragans et de typhons et seront-ils plus meurtriers lorsque le monde sera plus chaud ? Sommes-nous actuellement les témoins d’une évolution de l’activité cyclonique ? Actuellement nous ne pouvons en être sûrs, même si nous possédons quelques indices sur la plus forte probabilité d’une activité cyclonique en progression, ainsi que d’une activité atmosphérique associée aux cyclones tropicaux les plus intenses au-dessus de certains bassins océaniques.
Prévisions pour le futur
Donc, à quoi pouvons-nous nous attendre avec le réchauffement global anthropique ? Les données scientifiques publiées dans les revues à comité de lecture ont été rassemblées et évaluées dans le document AR4 de l’IPCC, qui nous présente actuellement la principale vision du futur.
Un réchauffement global anthropique aura pour conséquence un réchauffement général, avec une réponse plus nette en Arctique et sur les continents. Dans les zones sub-tropicales, il devrait y avoir davantage de sécheresses, mais les hautes latitudes devraient recevoir plus de précipitations. L’AR4 de l’IPCC suggère que davantage d’inondations et de famines devraient survenir. Les glaciers devraient fondre ce qui implique que les ressources en eau devraient diminuer pour une grande partie de la population mondiale. Une montée du niveau des mers affecterait les zones côtières en dessous du niveau de la mer et, dans certaines régions, des populations seraient amenées à être déplacées.
La saison des ouragans en 2005 a fourni un nombre impressionnant – au moins pour les temps modernes – de cyclones tropicaux dans la zone mer des Caraïbes/Atlantique Nord, dont certains on causé des victimes et provoqué de dégâts importants. Y aura-t-il davantage d’ouragans et de typhons et seront-ils plus meurtriers lorsque le monde sera plus chaud ? Sommes-nous actuellement les témoins d’une évolution de l’activité cyclonique ? Actuellement nous ne pouvons en être sûrs, même si nous possédons quelques indices sur la plus forte probabilité d’une activité cyclonique en progression, ainsi que d’une activité atmosphérique associée aux cyclones tropicaux les plus intenses au-dessus de certains bassins océaniques.
Traînées de condensation

Cette MERIS (spectrometer d’images à moyenne résolution = MEdium Resolution Imaging Spectrometer) montre une grande partie de l’Europe du nord-est, avec l’Allemagne, la Suède, la Pologne et le Danemark.
Les caractéristiques intéressantes de cette photo sont les nuages allongés autour et à l’est du Danemark, particulièrement bien visibles au-dessus de la mer. Ce sont en fait des traînées de condensation de la vapeur d’eau échappée des avions. Dans cette partie du monde le trafic aérien étant très actif, comme on peut le voir au nombre des trainees.
On pense que ces ensembles de traînées peuvent former des cirrus de haute altitude, qui peuvent contribuer au réchauffement climatique global.
Un programme au sein de l’ESA’s Data User Element (DUE) surveille continuellement les traînées de condensation et les éventuels effets qu’elles pourraient avoir dans le changement climatique.
Aspects sociaux
En plus des problèmes scientifiques, il y a aussi des aspects éthiques évidents, comme ceux qui sont associés au fait que ce sont les pays riches qui sont les premiers responsables de l’augmentation des GHGs, mais qui sont aussi moins affectés par les changements climatiques que les pays pauvres qui, eux, ne sont pas responsables des émissionsw1. Il y a aussi des considérations énergétiques et la question de savoir si les énergies ‘renouvelables’ peuvent remplacer les énergies fossiles. Tout cela en sachant que des considérations économiques et les choix politiques pour ce qui concerne le changement climatique sont clairement liés aux options énergétiques et à l’émission des gaz à effet de serre.
Ainsi, le débat sur le climat risque de devenir vraiment un des problèmes les plus fondamentaux des années à venir. Cela serait en effet une honte si le grand public ne pouvait participer à ce débat par manque de compréhension. C’est pourquoi il est important que les établissements scolaires fassent porter leur enseignement sur le climat et le changement climatique et que cet enseignement soit soigneux et à-jour.
Web References
- w1 – Pour une discussion de la politique du changement climatique voir www.OpenDemocracy.net
Review
Tout le monde a entendu parler du changement climatique; effectivement, le sujet est fréquemment abordé par les médias, mais l’information qui est donnée est souvent incomplète ou biaisé par des opinions politiques. En tant que professeurs de science nous devons fournir à nos étudiants une information exacte et des instruments pour développer leur sens critique à partir de faits dans le but d’une citoyenneté active.
L’article de Rasmus Benestad, en deux parties, est fort utile pour cela, car il présente le sujet du climat dans un langage clair et avec une approche objective, en s’appuyant sur son histoire, sur les preuves accessibles, la contribution anthropique et les problèmes en discussion.
Je recommande d’abord cet article aux professeurs de science qui désirent mettre à jour leurs connaissances et ensuite aux élèves du secondaire intéressés par les faits et par les preuves scientifiques qui sous-tendent un problème de société. Cet article est aussi particulièrement adapté à des discussions en classe ainsi que pour une approche pluridisciplinaire dans le cadre d’une éducation à l’environnement dans l’enseignement secondaire.
Giulia Realdon, Italie





