Lo pequeño es hermoso: química en microescala en el aula Teach article
Traducción de Elisa López Schiaffino. Aprende a llevar a cabo experimentos en microescala en clases de química donde se cuida el medio ambiente (y además no hace falta lavar tantas cosas).

en la plaza de los Héroes, en
Budapest (Hungría).
Imagen cortesía de Gerwin
Filius; fuente de la imagen:
Flickr
El año pasado, trabajé con mis estudiantes en un proyecto internacional de Scientixw1, que utilizaba química para analizar objetos de metal hallados en los sitios de patrimonio cultural de la UNESCO, como por ejemplo las estatuas de cobre y bronce de la plaza de los Héroes en Budapest (Hungría). Realizamos experimentos en los que utilizamos compuestos de hierro, cobre, níquel, plata, plomo, mercurio y otros metales pesados, materiales que son peligrosos, tóxicos y contaminantes. Aunque solo habíamos usado uno o dos mililitros de solución en cada tubo de ensayo, cuando toda la clase había terminado cada experimento, se había producido una gran cantidad de residuos tóxicos. Estamos muy interesados en proteger el medio ambiente, así que comenzamos a pensar cómo podíamos reducir la cantidad de productos químicos que usamos durante los experimentos.
El desarrollo de experimentos con pequeños volúmenes
Nuestra primera idea fue reemplazar los tubos de ensayo por bandejas con cavidades hechas con cajas plásticas vacías de píldoras o chicle, y utilizar las cavidades de las bandejas como recipientes para las reacciones (figura 1). Este método, que encontramos descripto en un artículo anterior de Science in School (Kalogirou & Nicas, 2010), redujo drásticamente la cantidad de productos químicos que utilizamos. Pero queríamos mejorar aún más.
Nuestra siguiente idea fue usar papel de filtro como recipiente para las reacciones de precipitación, y colocamos en un mismo lugar gotas de los productos químicos que reaccionaban entre sí. En estos experimentos, usamos solo una o dos gotas de cada reactivo, alrededor de una centésima parte de la cantidad usada en los experimentos con tubos de ensayo. Como usamos compuestos coloreados, las reacciones fueron visibles de inmediato y pudimos identificar los productos por su color.
Descubrimos que era buena idea empapar el papel de filtro con uno de los reactivos no tóxicos, secarlo y luego colocar gotas de los otros reactivos sobre el papel. Se pueden llevar a cabo varias reacciones en el mismo papel de filtro si se deja un espacio entre los lugares donde se producen las reacciones.
La figura 2 muestra las reacciones de cloruro de hierro (III): primero, con hidróxido de sodio sobre papel de filtro, lo que produce un precipitado de hidróxido de hierro (III); y luego, con hexacianoferrato de potasio sobre papel de filtro, lo que produce el característico precipitado de azul de Prusia. (Si deseas leer las ecuaciones de estas reacciones, consulta la Actividad 1).
La idea para realizar el método siguiente surgió por pura casualidad, cuando encontramos una caja usada de desodorante ambiental que tenía pequeñas esferas secas de hidrogel en su interior. Los hidrogeles son polímeros superabsorbentes que se encogen cuando se secan y se vuelven a hinchar cuando se los coloca en agua. Estas esferas son fáciles de adquirir, y con frecuencia se las utiliza en adornos florales y desodorantes de ambiente. Al hincharse, conservan su forma esférica y forman una perla acuosa donde pueden producirse reacciones.

Imagen cortesía de Éva Dobóné Tarai
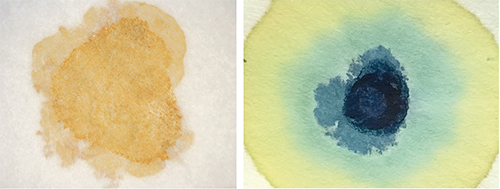
Imagen cortesía de Éva Dobóné Tarai
Las reacciones en las esferas de hidrogel
Con las esferas de hidrogel, primero realizamos reacciones de precipitación (al igual que con los experimentos con papel de filtro). Los resultados que obtuvimos con este método fueron interesantes y convincentes. Usamos una cantidad mínima de reactivos y además, debido a la forma esférica de los hidrogeles, eran como lentes de aumento y hacían que las reacciones fueran más visibles.

joannawnuk / shutterstock
Por ello, probamos otras reacciones químicas estándares usando las esferas de hidrogel, con resultados diversos. Las reacciones ácido-base no funcionaron bien, porque los colores de los indicadores (universal, tornasol, fenolftaleína y otros) no eran lo suficientemente fuertes y el procedimiento era algo complicado.
Pero las reacciones electroquímicas sí fueron un éxito: por ejemplo, la electrólisis de la solución de nitrato de plata, la de yoduro de cinc, la del agua y otras soluciones funcionaron bien (véase la Actividad 2). Normalmente, en este tipo de experimentos se deposita una capa delgada de metal en la superficie de un electrodo, y a menudo esta capa es poco visible. Sin embargo, en las esferas de hidrogel el metal reducido aparece dentro del gel como una mancha, por lo que es más visible y puede estudiarse con mayor facilidad.
Actividad 1: las reacciones de precipitación
Para introducir los reactivos en las esferas de hidrogel, usamos jeringas y agujas hipodérmicas. Por esta razón, estos experimentos solo son apropiados para estudiantes mayores de 16 años, y se necesita tener mucho cuidado y un buen comportamiento por parte de los alumnos. Para estudiantes más jóvenes (o de peor comportamiento), el experimento puede llevarse a cabo como una demostración del docente a través de una cámara web.
En esta actividad, se necesitan aproximadamente 10 minutos para cada experimento de precipitación, aunque las esferas de hidrogel deben remojarse con anticipación. Dado que se usa tan poco reactivo en cada esfera de hidrogel, las jeringas hipodérmicas pueden volver a usarse en la siguiente clase de química.
Nota de seguridad
Este experimento es apropiado solo para estudiantes mayores de 16 años, que deberán estar bajo supervisión docente en todo momento. El docente debe contar las agujas hipodérmicas al repartirlas y cuando se las devuelven, para asegurarse de que no falte ninguna. Se deben doblar las agujas hipodérmicas usadas y luego desecharlas en un recipiente para objetos punzocortantes. Es necesario usar anteojos de seguridad y guantes descartables durante toda la actividad.
Se deben tomar precauciones adicionales si se usa algún reactivo tóxico (por ejemplo, compuestos de mercurio o plomo), y se deben colocar las esferas de hidrogel que contienen estos compuestos en un recipiente para residuos peligrosos.
Consulta también la nota de seguridad general página web de Science in School.
Materiales
Necesitarás los siguientes materiales para cada estudiante o grupo:
- Una esfera de hidrogel para cada experimento
- Un azulejo cerámico esmaltado blanco, un plato de vidrio o una placa de Petri
- Dos jeringas con agujas hipodérmicas (armadas de antemano por el docente o técnico)
- Agua destilada
- Un par de guantes descartables
- Un par de anteojos de seguridad
Reagents:
- Solución 1,0 M de hidróxido de sodio (NaOH)
- Solución 1,0 M de cloruro de hierro (III) (FeCl3)
- Solución 1,0 M de cloruro de níquel (II) (NiCl2), o solución 1,0 M de sulfato de níquel (II) (NiSO4)
- Solución 1,0 M de sulfuro de sodio (Na2S)
- Solución 1,0 M de hexacianoferrato de potasio (K4[Fe(CN)6])
El método también puede usarse para otras reacciones de precipitación, por lo que la lista de materiales aquí detallada se puede ampliar o adaptar.
Procedimiento
Primero, lava las esferas de hidrogel varias veces en agua destilada, luego déjalas que se hinchen en más agua destilada durante al menos 2 horas. Se necesitan alrededor de 500 ml de agua destilada para remojar 30 esferas de hidrogel.
Para cada reacción:
- Coloca una esfera de hidrogel hinchada en un azulejo blanco.
- Llena una jeringa con una de las soluciones que contienen el compuesto de un metal pesado, como la solución de cloruro de hierro (III), e inyecta una pequeña cantidad del reactivo en el centro de la esfera.
- Llena la jeringa siguiente con la solución de hidróxido de sodio e inyecta una cantidad similar en la esfera de hidrogel a través del mismo agujero.
- A medida que ocurre la reacción, observa el cambio de color y anota lo que ves. Deberías observar que se forma dentro de la esfera un precipitado sólido y coloreado (figura 3).
- Toma otra esfera de hidrogel y repite el experimento con el siguiente compuesto de metal pesado, como la solución de cloruro de níquel (II), y vuelve a realizar la reacción con la solución de hidróxido de sodio.
- Sigue repitiendo el experimento con los otros reactivos:
- cloruro de níquel (II) con sulfuro de sodio
- cloruro de hierro (III) con hexacioanoferrato de potasio
- Por último, compara los resultados de las diferentes reacciones de precipitación.

Cloruro de níquel (II) con sulfuro de amonio (centro)
Cloruro de hierro (II) con ferrocianuro de potasio (derecha)
Imagen cortesía de Éva Dobóné Tarai
Discusión
Las ecuaciones y los cambios de color para estas reacciones son:
- Hidróxido de sodio con iones de hierro (III): Fe3+(aq) + 3 OH–(aq) → Fe(OH)3(s) (precipitado marrón rojizo)
- Hidróxido de sodio con iones de níquel (II): Ni2+(aq) + 2 OH–(aq) → Ni(OH)2(s) (precipitado verde)
- Sulfuro de sodio con iones de níquel (II): Ni2+(aq) + S2-(aq) → NiS(s) (precipitado negro)
- Reacción de solución de hexacioanoferrato de potasio con iones de hierro (III) (o iones férricos): 4 Fe3+(aq) + 3 Fe(CN)4-6(aq) → Fe4[Fe(CN)6]3(s) (precipitado azul de Prusia)
Para llevar a cabo una discusión con toda la clase, se pueden plantear preguntas como las siguientes:
- ¿Cuáles son las ventajas del método de reacción con las esferas de hidrogel? (Se utilizan pequeñas cantidades, por lo que es más seguro y ecológico).
- ¿Cuál podría ser una desventaja de este método? (Es menos apropiado para la química cuantitativa que los métodos estándares).
- ¿Qué otros reactivos podrían funcionar para producir reacciones muy visibles? (Ejemplos: sulfato de cobre e hidróxido de sodio, o cloruro de hierro (III) y sulfocianuro de potasio).
- ¿Qué reactivos tal vez no funcionen tan bien, y por qué? (Ejemplos: reacciones que producen soluciones de sales de sodio y sales de potasio, porque son incoloras y solubles).
Actividad 2: las reacciones electroquímicas en las esferas de hidrogel
En estos experimentos, en lugar de introducir las soluciones electrolíticas en las esferas de hidrogel hinchadas, colocamos las esferas sobre papel de filtro remojado con el electrolito y luego insertamos electrodos en las esferas (figura 4). Los iones de electrolitos migran del papel de filtro a las esferas, donde se forma el depósito. Para los electrodos en miniatura, usamos minas de grafito de un lápiz mecánico. En el experimento de la electrólisis del agua, el desprendimiento de las burbujas de gas (hidrógeno en el cátodo y oxígeno en el ánodo) era muy visibles (figura 5).
A diferencia de las reacciones de precipitación, este experimento no emplea agujas hipodérmicas, por lo que es apropiado para estudiantes mayores de 14 años. El tiempo que se necesita para la actividad es alrededor de 10 minutos para cada una de las reacciones, si se usan esferas de hidrogel que ya están hinchadas; si no, se necesitan 2 horas más para remojarlas.
Materiales
Necesitarás lo siguiente para cada estudiante o grupo:
- Dos esferas de hidrogel remojadas e hinchadas, preparadas de la misma manera que en la Actividad 1.
- Un azulejo cerámico esmaltado blanco, un plato de vidrio o una placa de Petri
- Una pipeta Pasteur
- Un papel de filtro (2 cm x 4 cm)
- Una batería (4,5 a 9 V)
- Dos cables (para conectar cada terminal de la batería a un electrodo)
- Dos pinzas cocodrilo
- Dos minas de grafito de un lápiz mecánico (para los electrodos)
- Agua destilada
Soluciones electrolíticas:
- Solución 2,0 M de cloruro de sodio (NaCl)
- Solución 1,0 M de nitrato de plata (AgNO3)
- Solución 1,0 M de yoduro de cinc (ZnI2)
- Agua destilada a la que se le ha agregado unas pocas gotas de ácido sulfúrico diluido
Procedimiento
- Prepara las esferas de hidrogel de la misma manera que en la Actividad 1 (esto debe realizarse de antemano).
- Coloca un papel de filtro sobre el azulejo o la placa de Petri. Colocar unas gotas de la solución de cloruro de sodio sobre el papel de filtro, a modo de electrolito.
- Coloca dos esferas de hidrogel sobre el papel de filtro e inserta un electrodo en cada esfera de hidrogel.
- Con una pipeta Pasteur, introduce un poco de la solución de nitrato de plata dentro del agujero en cada esfera de hidrogel, por donde entran los electrodos.
- Coloca una pinza que sujete los cables a los electrodos y la batería. Cierra el circuito eléctrico.
- Observa los cambios y anótalos.
- Repite los pasos para los otros electrolitos.

Imagen cortesía de Éva Dobóné Tarai

Imagen cortesía de Éva Dobóné Tarai
Discusión
Las ecuaciones de las reacciones de electrólisis son:
- Electrólisis de la solución de nitrato de plata:
Cátodo (electrodo negativo):2Ag+(aq) + 2e– → 2Ag(s)
Ánodo (electrodo positivo): H2O(l) → ½ O2(g) + 2H+(aq) + 2e–
- Electrólisis de la solución de yoduro de cinc:
Cátodo (electrodo negativo): Zn2+(aq) + 2e– → Zn(s)
Ánodo (electrodo positivo):: 2I–(aq) → I2(s) + 2e–
- Electrólisis del agua:
Cátodo (electrodo negativo): 4H2O(l) + 4e– → 2H2(g) + 4OH–(aq)
Ánodo (electrodo positivo): 2H2O(l) → O2(g) + 4 H+(aq) + 4e–
Todos estos experimentos pueden realizarse de forma económica y ayudan a que los estudiantes tengan en cuenta el cuidado del medio ambiente. Además, encontramos una ventaja más de no usar tubos de ensayo y otros materiales de laboratorio de vidrio: evitamos tener que lavarlos al finalizar los experimentos, lo que ahorra tiempo, agua y esfuerzo.
La química de las esferas de hidrogel
Los hidrogeles son polímeros superabsorbentes; usualmente están hechos con polímeros de polimetacrilato. Estos polímeros son xerogeles, lo que significa que cuando se los coloca en agua, se hinchan y aumentan de tamaño en forma significativa. Se emplean en la agroquímica para que las plantas crezcan mediante la hidrocultura, y se utilizan en pañales descartables, popurrís, desodorantes de ambientes, etc.
Químicamente, los xerogeles son compuestos iónicos. Cuando se los coloca en agua o en una solución de sal diluida, los iones se hidratan cuando atraen a las moléculas polares de agua, lo que hace que las esferas de hidrogel aumenten de tamaño. En agua destilada, un hidrogel puede absorber 300 veces su peso, pero en solución de cloruro de sodio (a una concentración isotónica con la sangre humana), la absorción es de 50 veces su peso. El hidrogel conserva su forma original gracias a los enlaces cruzados de los polímeros.
Agradecimientos
La autora agradece al Doctoral School of Humanities de la Universidad de Debrecen (Hungría) por el apoyo a su trabajo.
References
- Kalogirou E, Nicas E (2010) Química a microescala: experimentos para el colegio. Science in School 16.
Web References
- w1 – Scientix es una comunidad para la enseñanza de las ciencias en Europa. Si deseas consultar ideas, proyectos, métodos, noticias y otros recursos, visita el sitio web Scientix.
Resources
- El sitio web de la Royal Society of Chemistry del Reino Unido describe algunos experimentos con hidrogeles que se encuentran en geles para el cabello y pañales descartables..
- La Royal Society of Chemistry brinda otras ideas y métodos para lasr reacciones de precipitación en microescala.
Review
Este artículo muestra una manera novedosa de realizar reacciones de precipitación con la menor cantidad de reactivos posible, de manera segura y casi sin originar residuos tóxicos. Esta notable idea es sencilla, económica y de impacto visual, y se puede llevar a cabo en el aula incluso si no se dispone de un laboratorio.
Este artículo está relacionado con la química de las precipitaciones y la electrólisis, y también puede utilizarse para discutir la solubilidad, la estequiometría, las reacciones redox, y la neutralidad y la migración de iones.
Maurice Cosandey, École Polytechnique Fédérale de Lausanne, Suiza





