Supporting materials
Download
Download this article as a PDF

Traducido por: Marisa Prolongo y Gabriel Pinto El té es una bebida refrescante y también puede ayudar a los estudiantes a aprender sobre reacciones químicas importantes, como se demuestra con estos sencillos experimentos hechos con infusiones.
Los tés, incluidos los conocidos como negro, de hierbas y de frutas, son bebidas populares que se ofrecen en una amplia gama de variedades, asociadas con una impresionante variedad de colores una vez elaborados. Como muchas personas habrán notado, agregar sustancias al té puede hacer que cambie su color, lo que suele deberse a un cambio químico.
En este artículo, examinamos de cerca algunas reacciones químicas (ácido-base, oxidación-reducción o redox, y de formación de complejos) que pueden investigarse mediante experimentos sencillos y seguros con distintos tipos de té.

El té se elabora por infusión: un método físico de extracción en el que algunos compuestos químicos, como aceites y compuestos orgánicos volátiles, se disuelven en el líquido de infusión. En el caso de las bolsitas de té, la materia vegetal que forma el producto para la infusión no puede pasar a través de la bolsita, pero las partículas más pequeñas y los compuestos causantes del color y del sabor sí pueden hacerlo. Por tanto, la bolsita actúa como una membrana parcialmente permeable.
Tradicionalmente, el término ‘té’ se refería a un producto elaborado mediante la cosecha de hojas de la planta del té (Camellia sinensis) que luego se procesaban. Este producto ahora se conoce a menudo como ‘té negro’, debido a su apariencia antes de la infusión. (Esto es distinto del té que se sirve sin leche, que también se denomina a veces como té negro). Actualmente, sin embargo, muchos productos derivados de otras plantas también se comercializan como tés – en español se suelen denominar tés de hierbas o tisanas –. En este artículo usamos el término ‘té’ para incluir todos estos productos, y el término ‘té negro’ para referirnos específicamente al té tradicional.
Diseñamos las siguientes actividades, basadas en distintos tipos de té, para estudiantes de 14 a 19 años. También son adecuadas para edades de 11 a 14 años si se hace menos énfasis en la teoría que está detrás de las reacciones químicas. Las actividades se pueden completar en una clase (aproximadamente 60 minutos), y recomendamos que los estudiantes trabajen en grupos de 3 o 4. Opcionalmente, pueden usar la función de vídeo de sus teléfonos móviles para grabar y revisar los cambios que ven.
Las infusiones deben prepararse al comienzo de la clase, dejando que se enfríen a temperatura ambiente antes de realizar las actividades. Mientras se enfrían, puede aprovecharse para introducir los experimentos. Deben prepararse las siguientes infusiones:
En esta actividad, investigamos los cambios de color que ocurren cuando se agregan un ácido y una base a una infusión de color azul llamativo preparada con té de flor de guisante de mariposa.
En esta actividad, investigamos los cambios de color que ocurren cuando se agregan un ácido y una base a una infusión de color azul llamativo preparada con té de flor de guisante de mariposa.
Para preparar esta actividad, cada grupo requiere:
Los estudiantes deben seguir, trabajando en equipo, los siguientes pasos:
Puedes discutir las siguientes cuestiones con tus alumnos:
En la actividad, los estudiantes deberían apreciar los siguientes cambios de color (ver figura 1):
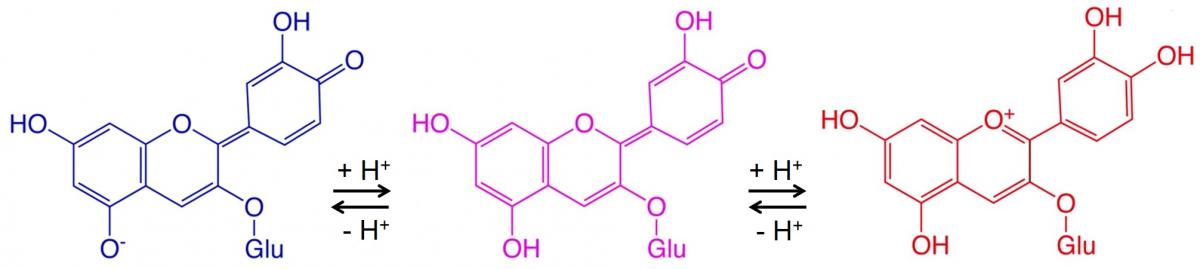
Estos cambios de color ocurren porque el té de flor de guisante de mariposa contiene moléculas llamadas antocianinas (ver cuadro de texto). Estas moléculas alteran la longitud de onda de la luz que absorben y, por lo tanto, su color, dependiendo del pH de la disolución en la que se encuentran. El zumo de limón contiene ácido cítrico y otros ácidos, por lo que añadirlo al té produce una disolución más ácida (pH más bajo) y un cambio de color visible. Añadir una base débil como hidróxido amónico o hidrogenocarbonato de sodio disminuye el número de iones hidrógeno, lo que produce una menor acidez (valor de pH más alto) y otro cambio de color.

Las antocianinas son un grupo de pigmentos solubles en agua responsables de la coloración roja, azul o púrpura de muchas flores, frutas (incluidos arándanos y frambuesas) y hortalizas (como la lombarda).[1] Estos pigmentos también son los responsables, al menos en parte, de los colores característicos de las hojas de árboles en otoño.
La parte de estas moléculas de pigmento que produce el color se llama cromóforo. En el cromóforo, la diferencia de energía entre dos orbitales moleculares se encuentra en el intervalo del espectro de luz visible. Agregar un ion hidrógeno a un cromóforo puede cambiar su longitud de onda de absorbancia y, por lo tanto, su color. Debido a que la acidez de una disolución (o valor de pH) depende de la concentración de iones hidrógeno, los cromóforos – y el material vegetal que los contiene –, actúan potencialmente como indicadores ácido-base naturales.
Hay muchos ejemplos de cambios de color que involucran antocianinas sensibles al pH y otros colorantes vegetales. La figura 2 muestra un ejemplo.
Aquí, dos reacciones reversibles, cada una de las cuales implica la adición de un ion hidrógeno a la molécula, que causa un cambio de color en cada paso. Las condiciones ácidas (pH bajo) favorecen las reacciones reversibles hacia la derecha (azul a rojo), mientras que las condiciones básicas (pH alto) favorecen las reacciones reversibles hacia la izquierda (rojo a azul).
Este experimento utiliza una disolución que contiene iones de hierro(III) para producir un cambio de color que indica la presencia de polifenoles, como los taninos, en el té. La disolución debe ser preparada por el profesor antes de la clase, disolviendo una cucharadita de cloruro de hierro(III) hexahidrato en 50 mL de agua. Alternativamente, se puede usar un estropajo de acero o lana de acero, aunque en estos casos el cambio de color será más lento. Cuando se usa la disolución de hierro(III), el cambio es instantáneo.
Cada grupo de estudiantes necesitará los siguientes materiales:
Los estudiantes deben seguir los siguientes pasos:
Puedes analizar las siguientes cuestiones con tus alumnos para explorar los conceptos clave:
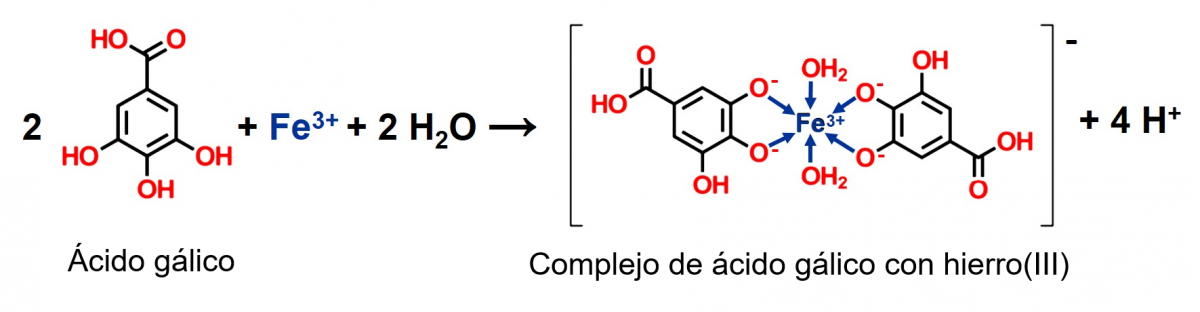
En la actividad, el té se oscurece cuando hay presentes iones de hierro(III), cambiando de color marrón pálido a negro, con apariencia de tinta china (ver figura 3). Los compuestos responsables de este cambio son los polifenoles, que reaccionan con los iones de hierro. El té contiene una serie de polifenoles, como los taninos que le confieren amargor y astringencia. Un ejemplo de estos polifenoles es el ácido gálico y sus derivados, que forman parte de la estructura de varios taninos. La química involucrada en el proceso es bastante compleja pero, en resumen, el ácido gálico reacciona con los iones de hierro(III) para formar pirogalato férrico, un ion complejo insoluble de color negro.

Esta actividad puede usarse como punto de partida para discutir cómo se forman los complejos de metales de transición (tipo de enlace involucrado, qué son los ligandos, y cómo afectan en su formación los cambios de pH).
La figura 4 muestra un ejemplo de un complejo de ácido gálico con hierro(III), con dos moléculas de agua actuando como co-ligandos para completar la esfera de coordinación octaédrica.[2]
También puedes probar otras infusiones para detectar la presencia de polifenoles; por ejemplo, las basadas en rooibos. Pueden obtenerse diferentes colores, desde marrón oscuro a azul oscuro, dependiendo de los complejos de hierro(III) formados.
En un artículo anterior publicado en Science in School ,[3] introdujimos la idea de cambios de color producidos por agentes oxidantes y reductores (en ese caso causados por reacciones químicas entre chupachups de glucosa y sales de permanganato).
En esta actividad, nos fijamos en los cambios de color debidos a la acción de agentes oxidantes y reductores sobre el té de hibisco. Aquí, el percarbonato de sodio actúa como agente oxidante y el ditionito de sodio como agente reductor.
Cada grupo de estudiantes necesitará los siguientes materiales:
Los estudiantes deben seguir los siguientes pasos:
Puedes discutir con tus alumnos las siguientes cuestiones:
También se les puede pedir a los alumnos que hagan su propia investigación para indagar cómo esta actividad se relaciona con los productos blanqueadores. Por ejemplo:
El té de hibisco se decolora (blanquea) casi por completo con ditionito de sodio, pero no con percarbonato de sodio (figura 5).

Los blanqueadores químicos son productos que se utilizan para quitar el color de tejidos y limpiar manchas. Reaccionan con muchos compuestos orgánicos coloreados, incluidos los pigmentos naturales. Los agentes oxidantes son los más utilizados, pero también se utilizan algunos agentes reductores.
El percarbonato de sodio es un típico blanqueador oxidante. El grupo peróxido da lugar a especies de oxígeno muy reactivas, que son los agentes blanqueadores (y oxidantes) activos. Rompen enlaces químicos en la zona cromófora de las moléculas de pigmento (ver cuadro de texto), cambiando su color.
Un blanqueador reductor, como el ditionito de sodio, actúa convirtiendo los dobles enlaces carbono-carbono del grupo cromóforo en enlaces sencillos, lo que reduce el estado de oxidación del carbono.
Aunque la mayoría de los reactivos son productos químicos domésticos comunes, algunos, como la disolución de amoníaco, el percarbonato de sodio y el ditionito de sodio, pueden ser irritantes o corrosivos. Los profesores deben seguir las normas de seguridad y de prevención de riesgos adecuadas a su entorno, así como los consejos mostrados en la etiqueta de cada producto. Los estudiantes deben usar bata de laboratorio, guantes y gafas de seguridad para evitar el contacto de los productos químicos con la piel y los ojos. Se debe tener especial cuidado con el cloruro de hierro(III). Consultar también la nota de seguridad general en la web de Science in School. Los residuos se pueden eliminar de forma segura por el desagüe.
Este artículo está basado en la presentación realizada en la feria científica ‘Ciencia en Acción’ (sección española de Science on Stage) en 2020 por Marisa Prolongo, ayudada por su sobrino Guillermo y su sobrina Ana. Los autores agradecen el apoyo prestado por la Universidad Politécnica de Madrid (UPM), a través del proyecto ‘Fomento del aprendizaje STEAM basado en la indagación’; la Obra Social ‘la Caixa’, por el proyecto ‘La ciencia y la tecnología al alcance de tod@s’; y las Reales Sociedades Españolas de Física (RSEF) y de Química (RSEQ).
[1] Rusishvili M et al. (2019) Unraveling the molecular mechanisms of color expression in anthocyanins, Physical Chemistry Chemical Physics 21: 8757-8766. doi: 10.1039/C9CP00747D
[2] Rattanakit P, Maungchang R (2019) Determining Iron(III) Concentration in a Green Chemistry Experiment Using Phyllanthus emblica (Indian Gooseberry) Extract and Spectrophotometry, Journal of Chemical Education 96:756-760. doi: 10.1021/acs.jchemed.8b00817
[3] Prolongo M, Pinto G (2018) Colourful chemistry: redox reactions with lollipops. Science in School 43: 41-45.
En Wellington College hemos utilizado personalmente el artículo educativo ‘Colourful Chemistry: Redox Reactions with Lollipops’, escrito por los mismos autores. Hemos constatado que los estudiantes disfrutan realmente del aspecto visual y aprenden más sobre química con esa demostración. Por ello, me emociona intentar la realización de los experimentos propuestos en este nuevo artículo educativo, donde se trabaja con varios tipos de té y de infusiones. Actualmente, nuestros estudiantes, en el Reino Unido, aprenden de forma no presencial: pueden realizar la Actividad 1 en su casa, antes de la clase, y luego, darles la oportunidad de compartir sus resultados.
Caroline Evans, Head of Chemistry, Wellington College, UK
Download this article as a PDF