Selección natural a nivel molecular Understand article
Traducido por Amalia Bonilla Díaz. Ya sabemos que secuencias genéticas concretas pueden ayudarnos a sobrevivir en nuestro entorno –lo que es la base de la evolución. Pero no es fácil demostrar qué secuencias son beneficiosas y cómo nos ayudan a sobrevivir, sobre todo en poblaciones…

iStockphoto
Cuando los humanos abandonaron África hace unos 150 000 años, asentándose en los valles de Tigres y Eufrates, navegando entre las islas de Indonesia y atravesando el Estrecho de Bering hasta llegar a América, fueron muchos los desafíos que encontraron por el camino. Al provenir de las calurosas y secas sabanas, la población tuvo que adaptarse a las condiciones locales y durante generaciones su fisiología y apariencia fueron adaptándose (Harris & Meyer, 2008). Su piel se volvió más clara al vivir en regiones con menor exposición solar (Lamason et al., 2005). Aquellos que bebían leche animal mantuvieron la capacidad de digerir lactosa aún cuando llegaron a la madurez, una característica que pronto desapareció entre aquellos que no la ingerían (Tishkoff et al., 2007). La población que se alimentaba a base de almidón producía más amilasa salival (enzima que ayuda a digerirlo) (Perry et al., 2007).
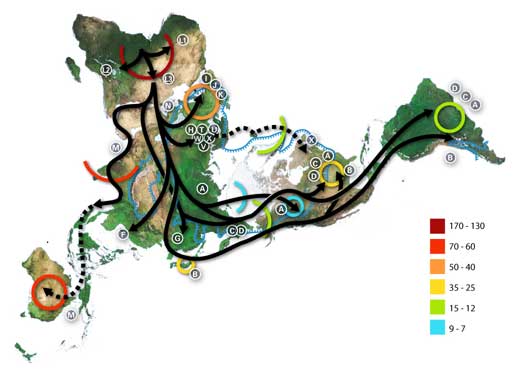
Los números representan miles de años.
La línea azul representa el área cubierta de hielo o tundra durante la última gran era glaciar. Las letras son los haplogrupos de ADN mitocondrial (líneas maternas puras). Los haplogrupos pueden utilizarse para definir poblaciones genéticas y se orientan a menudo geográficamente.
Por ejemplo, estas son las divisiones comunes para haplogrupos de ADN mitocondrial:
Africana: L, L1, L2, L3, L3
Oriente Próximo: J, N
Sur europeo: J, K
Europeo general: H, V
Norte europeon: T, U, X
Asiático: A, B, C, D, E, F, G ((nota: M se compone de C, D, E, y G)
Americano nativo: A, B, C, D, y a veces X.
Haga clic sobre la imagen para ampliarla
Se cree que algunos de estos cambios han sido una consecuencia de la selección positiva (véase el glosario para los términos en cursiva). Esto implica que en un entorno concreto (la presión selectiva) en el pasado, los individuos que por casualidad tenían una secuencia de ADN favorable sobrevivían y dejaban más descendencia que aquellos con una secuencia diferente y menos favorable. En la actualidad, mediante las secuencias genómicas de multitud de especies, incluidos los humanos y sus parientes más próximos, los científicos pueden comparar los rasgos y las secuencias de ADN de varias poblaciones y especies con estilos de vida distintos y de diferentes entornos con el objetivo de identificar qué secuencias pueden haber jugado un papel importante en las adaptaciones. Esto, a su vez, permite a los investigadores estudiar la función de una secuencia de ADN y su valor adaptativo potencial.

iStockphoto
Algunos de los genes que se sabe que afectan al color de la piel en los humanos muestran un patrón geográfico específico de variación secuencial; en concreto, las comparaciones secuenciales entre poblaciones europeas y africanas indican que la variación en el color de la piel se debe a la selección positiva. La piel clara se correlaciona de forma positiva con un aumento de latitud, y son varias las hipótesis propuestas que explican sus efectos potencialmente beneficiosos.
Una de las hipótesis, que plantea que la piel clara favorece la producción de vitamina D, se apoya en las observaciones que demuestran que las personas con piel oscura que viven en latitudes altas sufren una deficiencia de vitamina D. Además la piel clara es más sensible a los efectos perjudiciales del sol: una mayor exposición se relaciona con un aumento en la incidencia de cáncer de piel en personas de piel clara. Por consiguiente, la piel clara en poblaciones que viven en latitudes más altas puede ser un equilibro evolutivo entre la protección contra los efectos carcinogénicos del sol y la producción suficiente de una vitamina esencial.
electrónico de una célula
falciforme y de glóbulos
rojos
Imagen cortesía de EM Unit,
UCL Medical School, Royal
Free Campus / Wellcome
Images
Aunque esta es una hipótesis sólida, las pruebas que la sustentan son indirectas. Una demostración directa del valor adaptativo de este rasgo requeriría evaluar si los individuos con piel más clara muestran una mejora en la supervivencia y la reproducción. Sin embargo, estas demostraciones son difíciles de llevar a cabo en nuestra especie: los experimentos de supervivencia –en los que personas con distintos rasgos son expuestos a un entorno para observar quiénes sobreviven– no pueden ser realizados en humanos y nuestro largo periodo de generación hace muy complicado investigar las diferencias en las tasas de reproducción. Las circunstancias en las que sí es posible observar el valor adaptativo de los rasgos en humanos son por tanto muy limitadas, pero existen.
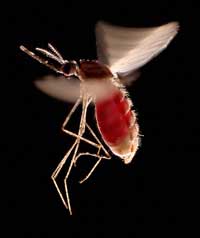
lleno de sangre. Esta especie,
Anopheles stephensi,
representa al insecto vector
que transmite la malaria en
la India y Pakistán
Imagen cortesía de Hugh
Sturrock / Wellcome Images
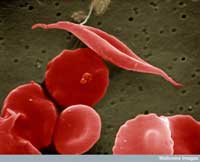
Un ejemplo de ello comprende dos enfermedades: la anemia falciforme y la malaria. El gen implicado en la anemia falciforme posee dos variantes o alelos: un alelo “normal” y un alelo falciforme. Las personas con dos alelos falciformes sufren una anemia falciforme grave, mientras que aquellas personas con un alelo normal y otro falciforme no muestran esos síntomas graves. Los datos de mortalidad indican que el alelo falciforme puede ser, no obstante, beneficioso: en poblaciones expuestas al parásito de la malaria, los individuos con un alelo normal y otro falciforme tienen más probabilidades de sobrevivir, comparados con aquellos con dos alelos normales, porque el parásito (Plasmodium falciparum) necesita glóbulos rojos sanos para multiplicarse. Por tanto, la frecuencia del alelo que causa anemia falciforme aumenta en grupos expuestos a la malaria –el alelo se adapta a este ambiente.
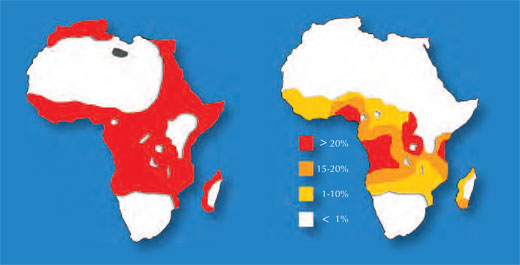
Imagen cortesía de Anthony Allison; fuente de imagen: Wikimedia Commons
Otro ejemplo que demuestra el valor adaptativo de un rasgo humano afecta a un fragmento del cromosoma 17, invertido en nuestros antepasados hace más de tres millones de años (Stefansson et al., 2005). El hecho de que esta variante se haya extendido por las poblaciones europeas indica que se ha producido una selección positiva –confiere un elemento beneficiosos a los que lo llevan. Al realizar un genotipado de casi 30 000 islandeses, los científicos, que estudiaban esta hipótesis, fueron capaces de determinar que durante los últimos 80 años los individuos que portaban la variante secuencial tenían una media de 3,2% más de descendientes por generación que aquellos con una secuencia normal –una explicación convincente de cómo esa variante se extendió tan rápidamente.
Aunque los dos ejemplos demuestran claramente la acción reciente de la selección positiva en los humanos, no se comprenden del todo los mecanismos moleculares por los que las variaciones secuenciales confieren sus ventajas, por lo que debe estudiarse caso por caso. Para aclarar las relaciones causales entre las secuencias de ADN adaptativas de manera putativa y la aptitud biológica individual, los científicos recurren a organismos con los que es más fácil experimentar.
Por ejemplo, el color del pelaje del ratón de playa, Peromyscus polionotus, combina con la tierra del entorno, proporcionándole un perfecto camuflaje. Los ratones que viven en la blanca arena de las playas de Florida son mucho más claros que los ratones de la misma especie que viven en el interior. El valor adaptativo de este rasgo fue demostrado con experimentos hace más de 30 años: los ratones con un pelaje del color de la tierra fueron devorados con menor frecuencia por las lechuzas que los otros con menor camuflaje. Sin embargo, los científicos acaban de identificar los locis genéticos de este rasgo adaptativo (Hoekstra et al., 2006): la variación en el color del pelaje depende en gran medida de los distintos alelos del gen McR1. La proteína codificada por este gen actúa como un interruptor bioquímico que administra la producción de eumelanina, un pigmento oscuro de la piel, o la feomelanina, un pigmento claro. Los diferentes alelos del gen McR1 activan la vía de producción pigmentaria en distinto grado, lo que favorece la producción de un pigmento u otro.
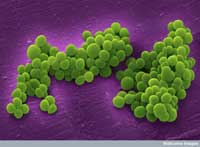
electrónica de cúmulos de la
bacteria Staphylococcus
aureus resistente a la
meticilina
Imagen cortesía de Annie
Cavanagh / Wellcome Images
Otro ejemplo de relación causal demostrada afecta al Staphylococcus aureus, una bacteria que puede causar varias enfermedades, incluidas la neumonía y la inflamación de la válvula cardiaca. En un experimento natural poco común, un paciente con infecciones recurrentes por S. aureus fue tratado durante tres meses con vancomicina, uno de los pocos antibióticos que aún son efectivos contra el S. aureus. Antes y durante el tratamiento, los científicos recogieron muestras (aisladas) del patógeno y secuenciaron el genoma completo de la primera y última muestra. Cuando compararon los tres millones de bases de pares (las “letras” del código genético) que constituyen el ADN de esta bacteria, descubrieron solo 35 diferencias entre la primera y la última muestra.
Al secuenciar de manera parcial las muestras aisladas intermedias, los científicos entendieron el orden en el que se habían producido estos cambios. Al probar la resistencia bacteriana a la vancomicina in vitro en distintas muestras, fueron capaces de relacionar los cambios genéticos específicos con los efectos sobre el crecimiento de la bacteria y la respuesta a este medicamento. Por ejemplo, la primera y la segunda muestra de la bacteria se diferenciaban por seis sustituciones nucleotídicas (cambios en las “letras”) en dos genes. Estas únicas seis mutaciones eran claramente beneficiosas: aumentaban por cuatro la tolerancia de la bacteria a la vancomicina, lo que le permitía a la bacteria portar esas mutaciones para sobrevivir y reproducirse mejor, de tal forma que fuese más común en el cuerpo del paciente. Las veinte y seis mutaciones posteriores durante las siguientes semanas de tratamiento doblaban la tolerancia, produciendo de forma efectiva un rasgo del S. aureus de tolerancia a la vancomicina (Mwangi et al., 2007).
En resumen, investigar la base molecular de la evolución adaptativa en poblaciones salvajes no es fácil. Los desafíos incluyen definir las presiones selectivas, identificar las secuencias de ADN en las que se apoyan los rasgos asociados, medir la aptitud biológica individual y hallar explicaciones mecanicistas de cómo los cambios secuenciales influyen en los rasgos adaptativos. Sin embargo, con el uso de organismos modelo y desarrollos tecnológicos recientes, estas investigaciones son cada vez más factibles, lo que aumenta nuestra comprensión de cómo los cambios específicos a nivel genético permiten a los organismos adaptarse al entorno.
Glosario
Valor adaptativo: un rasgo tiene un valor adaptativo si permite a un individuo sobrevivir y reproducirse mejor en un ambiente concreto que aquellos que no poseen este rasgo. De manera más formal, un rasgo se considera adaptativo si aumenta la aptitud biológica.
Alelo: una variante de un gen.
Aptitud biológica (fitness): un término difícil de definir perteneciente a la biología evolutiva y la genética de las poblaciones: describe el promedio de descendientes durante una generación asociados con un genotipo comparado con otro dentro de una población. Por tanto, los genotipos que producen más descendencia poseen una mejor aptitud biológica. Para más información sobre la aptitud biológica (fitness) y los genotipos, véase Wikipediaw1.
Genoma: el ADN completo de un organismo. Por lo general, se considera el ADN nuclear, en contraposición con al ADN mitocondrial o plastidial. Para más información, consulte “What is a genome” en la página web de la US Nacional Library of Medicinew2.
Selección positiva: la selección natural es uno de los mecanismos de la evolución; describe la supervivencia y reproducción diferentes de los individuos en un entorno. La selección natural se denomina “positiva” cuando promueve rasgos particulares que ayudan a los individuos que los poseen a sobrevivir y a reproducirse mejor que otros.
Presión selectiva: una característica del entorno (p. ej. Temperatura; presencia de parásitos; depredación o agresión de otros miembros de la misma especie) que impone diferencias en la supervivencia y reproducción de los individuos.
Rasgo: una característica o un conjunto de características de un organismo (p. ej. peso; resistencia a los antibióticos; capacidad para ver colores o para enrollar la propia lengua).
Agradecimientos
El autor agradece a David Hughes, Mehmet Somel y Ania Lorenc sus comentarios tan útiles en el artículo.
References
- Harris EE, Meyer D (2006) The molecular signature of selection underlying human adaptations. American Journal of Physical Anthropology 131(S43): 89-130. doi: 10.1002/ajpa.20518
- Este artículo ofrece un buen resumen de la investigación sobre evolución molecular en los humanos.
- Hoekstra H et al. (2006) A single amino acid mutation contributes to adaptive beach mouse color pattern. Science 313: 101-104. doi: 10.1126/science.1126121
- Este y otros artículos sobre la coloración del pelaje del ratón del grupo de investigación de Hopi Hoekstra están disponibles en la página web de la Universidad de Harvard. Véase: www.oeb.harvard.edu/faculty/hoekstra/Links/PublicationsPage.html
- También puede consultar los siguientes artículos donde se describen el descubrimiento de Agouti, un regulador negativo del McR1 que contribuye a la adaptación del color del pelaje en los Peromyscus:
- Steiner CC, Weber JN, Hoekstra HE (2007) Adaptive variation in beach mice produced by two interacting pigmentation genes. PLoS Biology 5: e219. doi: 0.1371/journal.pbio.0050219
- Este y todos los artículos de PLoS Biology están disponibles de forma gratuita en línea.
- Los siguientes artículos resumen la pigmentación adaptativa de los vertebrados:
- Hoekstra HE (2006) Genetics, development and evolution of adaptive pigmentation in vertebrates. Heredity 97: 222-234. doi: 10.1038/sj.hdy.6800861
- Este artículo puede descargarse de forma gratuita en la página web de Heredity: www.nature.com/hdy
- En el blog de John Hawks está disponible un resumen de la última investigación de Hopi Hoekstra: http://johnhawks.net/weblog/topics/evolution/selection/hoekstra-2009-adaptive-pigmentation.html
- Lamason RL et al. (2005) SLC24A5, a putative cation exchanger, affects pigmentation in zebrafish and humans. Science 310: 1782-1786. doi: 10.1126/science.1116238
- Mwangi MM et al. (2007) Tracking the in vivo evolution of multidrug resistance in Staphylococcus aureus by whole-genome sequencing. Proceedings of the National Academy of Sciences of the United States of America 104: 9451-9456. doi: 10.1073/pnas.0609839104
- Perry GH et al. (2007) Diet and the evolution of human amylase gene copy number variation. Nature Genetics 39: 1256-1260. doi: 10.1038/ng2123
- También puede consultar el resumen de esta investigación en la web Panda’s Thumb: http://pandasthumb.org/archives/2008/12/amylase-and-hum.html
- Stefansson H et al. (2005) A common inversion under selection in Europeans. Nature Genetics 37: 129-137. doi: 10.1038/ng1508
- También puede consultar un resumen del artículo en Evolgen: http://evolgen.blogspot.com/2005/02/human-inversion-under-selection.html
- Tishkoff SA et al. (2006) Convergent adaptation of human lactase persistence in Africa and Europe. Nature Genetics 39: 31-40. doi: 10.1038/ng1946
- También puede consultar un resumen de esta investigación en The New York Times: www.nytimes.com/2006/12/10/science/10cnd-evolve.html?_r=1a
Web References
- w1 – Para más referencias sobre los términos “adaptación biológica (fitness)” y “genotipo” consulte Wikipedia: http://en.wikipedia.org/wiki/Fitness_(biology) y http://en.wikipedia.org/wiki/Genotype
- w2 – Para más información sobre los genomas y el Proyecto del Genoma Humano, consulte “What is a genome” en la página web de la US National Library of Medicine: http://ghr.nlm.nih.gov/handbook/hgp/genome
Resources
- Si este artículo te ha parecido interesante, te gustará otros artículos sobre evolución de Science in School:
- Haubold B (2010) Review of Why Evolution is True. Science in School 14. www.scienceinschool.org/2010/issue14/evotrue
- Leigh V (2008). Interview with Steve Jones: the threat of creationism. Science in School 9: 9-17. www.scienceinschool.org/2008/issue9/stevejones
- Patterson L (2010) Avanzando en la evolución. Science in School 14. www.scienceinschool.org/2010/issue14/amphioxus/spanish
- Pongsophon P, Roadrangka V and Campbell A (2007) Counting Buttons: demonstrating the Hardy-Weinberg principle. Science in School 6: 30-35. www.scienceinschool.org/2007/issue6/hardyweinberg
- Para más información sobre la malaria, consulte:
- Hodge R (2006) Fighting malaria on a new front. Science in School 1: 72-75. www.scienceinschool.org/2006/issue1/malaria
- Para saber más sobre la estructura del almidón, a la que la amilasa salival ayuda a digerir, véase:
- Cornuéjols D (2010) Almidón: un misterio estructural. Science in School 14. www.scienceinschool.org/2010/issue14/starch/spanish
Review
Este artículo describe una serie de interesantes ejemplos de adaptaciones evolutivas a nivel molecular en los humanos. Se subraya la dificultad que entraña aclarar la relación causal entre secuencias de ADN adaptativo y la aptitud biológica (fitness) individual en humanos y la necesidad de usar otros organismos experimentales.
El artículo proporciona un excelente material para comprender cuestiones que se centran en el entendimiento de la selección natural y la aptitud biológica en los humanos y en organismos experimentales. Por ejemplo:
- Explica el proceso que interviene en la selección natural.
- ¿Qué entiendes por el término “fitness”?
- Explica cómo el alelo falciforme confiere una ventaja selectiva en algunas poblaciones humanas.
- ¿Cuáles son los problemas asociados como el establecimiento de las relaciones causales entre las secuencias de ADN adaptativo y la aptitud biológica (fitness) en los humanos?
- Crea un organigrama que explique el valor adaptativo del color del pelaje de los ratones de playa.
- ¿Cómo correlacionan los científicos los cambios genéticos en el Staphylococcus aureus con el crecimiento de bacterias y la capacidad de respuesta antibiótica?
Este artículo además permite a los estudiantes investigar los vínculos entre el ADN, la secuencia de aminoácidos, la estructura proteica y la función en la anemia falciforme. El texto es idóneo para dirigir el debate en clase hacia los métodos y problemas asociados con la investigación de la base molecular de las relaciones evolutivas y la ética de las pruebas genéticas en los humanos. Podrían organizarse estudios interdisciplinares en torno a la historia de la ciencia y la genética evolutiva de las poblaciones.
Mary Brenan, Reino Unido





