Υδράργυρος: η μεθυλίωση κάνει τη διαφορά Understand article
Μετάφραση της Θεοδώρας Τερζίδου (Theodora Terzidou). Η Sigrid Griet Eeckhout από το ESRF (European Synchrotron Radiation Facility) στη Grenoble της Γαλλίας ερευνά τα αίτια της τοξικότητας των ενώσεων…

/ iStockphoto
Τα μέταλλα αποτελούν περίπου 75% των γνωστών στοιχείων. Μπορούν να σχηματίσουν κράματα με άλλα μέταλλα αλλά και με αμέταλλα και χρησιμοποιούνται ευρέως σε πολλές εφαρμογές από αυτοκίνητα και ηλεκτρονικούς υπολογιστές ως αυτοκινητοδρόμους και γέφυρες. Μέταλλα όπως ο χρυσός, το ασήμι, ο χαλκός, ο υδράργυρος, ο ψευδάργυρος, ο σίδηρος και ο μόλυβδος αποτέλεσαν τη βάση των αρχαίων πολιτισμών. Ο χρυσός ανακαλύφθηκε γύρω στα 6000 π.Χ. ενώ υδράργυρος έχει βρεθεί σε τάφους που χρονολογούνται από το 1600 π.Χ. Οι αρχαίοι Έλληνες χρησιμοποιούσαν τον υδράργυρο για την παρασκευή αλοιφών· οι Ρωμαίοι ως συστατικό σε καλλυντικά. Από την αρχή της βιομηχανικής περιόδου, τα μέταλλα παρεισφρέουν στα οικοσυστήματα και συσσωρεύονται στο έδαφος, τα ιζήματα και τα επιφανειακά ύδατα.
Πολλά μεταλλικά ιχνοστοιχεία είναι σημαντικά από οικολογικής άποψης είτε γιατί είναι απαραίτητα διαθρεπτικά στοιχεία είτε λόγω της τοξικότητάς τους ως ρυπαντών. Μεταξύ των ιχνοστοιχείων που είναι απαραίτητα στον οργανισμό συγκαταλέγεται το μαγνήσιο, το μαγγάνιο, ο χαλκός και ο ψευδάργυρος. Ακόμη και αυτά όμως μπορούν να γίνουν τοξικά σε υψηλές συγκεντρώσεις. Άλλα πάλι, όπως τα λεγόμενα βαρέα μέταλλα (υδράργυρος, κάδμιο, αρσενικό και μόλυβδος) αποτελούν απειλή για το περιβάλλον λόγω της υψηλής τους τοξικότητας και της εκτεταμένης βιομηχανικής τους χρήσης. Ο υδράργυρος απαντάται στο περιβάλλον σε συγκεντρώσεις κάτω του 0,1%, είναι όμως εξαιρετικά τοξικός γιατί προσδένεται στις λειτουργικές ομάδες διαφόρων ενζύμων και πρωτεϊνών και έτσι αναστέλλει ή επηρεάζει δυσμενώς βασικές οργανικές λειτουργίες. Ο υδράργυρος χρησιμοποιείται για την εξόρυξη του χρυσού, σε θερμόμετρα, σφραγίσματα δοντιών, θερμοστάτες, ρελέ, διακόπτες, βαρόμετρα, μετρητές κενού και άλλες επιστημονικές συσκευές, αν και λόγω των φόβων για την τοξική του δράση τα θερμόμετρα υδραργύρου δεν χρησιμοποιούνται πλέον ευρέως.
Ο υδράργυρος είναι ιχνοστοιχείο που προέρχεται τόσο από φυσικές πηγές ως αυτοφυές μέταλλο (Hg) ή κιννάβαρι (θειούχος υδράργυρος, ΗgS) όσο και από ανθρωπογενείς. Στις ανθρωπογενείς πηγές υδραργύρου συγκαταλέγονται η γεωργία (μυκητοκτόνα) και η μεταλλουργία (εξόρυξη και πυρομεταλλουργία), η βιομηχανία των πλαστικών, η διάθεση απορριμμάτων και οι χωματερές. Οι μεγαλύτερες ποσότητες υδραργύρου στο έδαφος, στα ιζήματα και στα επιφανειακά ύδατα προέρχονται από την καύση ορυκτών καυσίμων. Ο υδράργυρος είναι ένα πτητικό μέταλλο που μπορεί να μεταφερθεί σε πολύ μεγάλες αποστάσεις ως αέριο ή προσκολλημένος σε μικρά σωματίδια σκόνης. Ο αέριος υδράργυρος μπορεί να παραμείνει στην ατμόσφαιρα έως και ένα χρόνο προτού εναποτεθεί στην επιφάνεια της Γης με το νερό της βροχής.
Μετά την εναπόθεσή τους στην επιφάνεια της Γης, τα μέταλλα και τα μεταλλοειδή (στοιχεία με ιδιότητες τόσο των μετάλλων όσο και των αμετάλλων) υφίστανται δυναμικές βιογεωχημικές διεργασίες στο μικροπεριβάλλον του άνω φλοιού της Γης, που αποτελείται από πετρώματα, χώμα, νερό, αέρα και ζωντανούς οργανισμούς.
Αυτές οι βιογεωχημικές διεργασίες επηρεάζουν την ατομική μορφή του μετάλλου (ειδοταυτοποίηση) και κατά συνέπεια τη διαλυτότητα, την κινητικότητα, τη βιοδιαθεσιμότητα και την τοξικότητά του. Κατά κανόνα, όσο λιγότερο διαλυτό είναι ένα χημικό είδος τόσο λιγότερο κινητικό και κατ’ επέκταση τοξικό είναι. Δηλαδή, μετατρέποντας ένα διαλυτό χημικό είδος στις λιγότερο διαλυτές χημικές μορφές του, είτε εκ των προτέρων είτε εκ των υστέρων στις χωματερές, μπορούμε να μετριάσουμε τον αντίκτυπο των επικίνδυνων βαρέων μετάλλων στους ζωντανούς οργανισμούς και στο περιβάλλον.

-van Kranen / iStockphoto
Υπάρχουν μικροοργανισμοί που μπορούν να μετατρέψουν τα μέταλλα μέσω οξειδοαναγωγικών ή άλλων χημικών αντιδράσεων. Ας πάρουμε το παράδειγμα ενός άλλου βαρέος μετάλλου, του εξασθενούς χρωμίου [Cr(VI)], που είναι μια πολύ επικίνδυνη υδατοδιαλυτή μορφή του χρωμίου. Η πρόσληψη μεγάλων ποσοτήτων Cr(VI) μπορεί να προκαλέσει στομαχικές διαταραχές και έλκη, σπασμούς, βλάβες στα νεφρά και στο ήπαρ, διάφορες μορφές καρκίνου ή ακόμη και τον θάνατο. Αντίθετα, το τρισθενές χρώμιο ή Cr(III) είναι ένα απαραίτητο για τον οργανισμό ιχνοστοιχείο που βοηθά το σώμα να απορροφήσει τα σάκχαρα, τις πρωτεΐνες και τα λιπαρά. Το Cr(III) είναι αδιάλυτο στο νερό. Η αναγωγή του Cr(VI) σε Cr(III) με τη χρήση μικροοργανισμών το καθιστά αδιάλυτο στο νερό και έτσι περιορίζει τη διαθεσιμότητα και την τοξικότητά τουw1.
Αυτή η μετατροπή μπορεί όμως να γίνει και προς την αντίστροφη κατεύθυνση. Οι μικροοργανισμοί του εδάφους μπορούν να μετατρέψουν την ανόργανη (χωρίς άνθρακα) σχετικά ακίνδυνη μορφή υδραργύρου στη δηλητηριώδη οργανική μορφή του. Η αντίδραση αυτή ονομάζεται μεθυλίωση: ένα άτομο, συνήθως υδρογόνου, αντικαθίσταται από τη μεθυλική ομάδα (-CH3). Ο μεθυλυδράργυρος (CH3Hg+) ως θετικά φορτισμένο ιόν ενώνεται εύκολα με ανιόντα όπως χλώριο (Cl–), υδροξύλιο (OH–) ή τη νιτρική ρίζα (NO3–).
Η μετατροπή του υδραργύρου σε μεθυλυδράργυρο δίνει ένα λιπόφιλο μέταλλο (δηλαδή ένα μέταλλο που μπορεί να διαλυθεί σε λιπαρές ουσίες) το οποίο μπορεί να περάσει από την κυτταρική μεμβράνη, τον αιματοεγκεφαλικό φραγμό και τον πλακούντα. Υπό αυτή την οργανική μορφή του μπαίνει στην τροφική αλυσίδα και συσσωρεύεται στα ψάρια, στα ζώα που τρέφονται με ψάρια και, φυσικά, στον ανθρώπινο οργανισμό. Με άλλα λόγια, η σχετικά ακίνδυνη ανόργανη μορφή του υδραργύρου που αποβάλλεται χωρίς πρόβλημα από τον οργανισμό μετατρέπεται στην οργανική μορφή του η οποία απορροφάται από τον οργανισμό δηλητηριάζοντάς τον.
Πώς λοιπόν φτάνουμε από τη μία μορφή στην άλλη; Ερευνητές από τη Σουηδία και τις ΗΠΑ χρησιμοποίησαν τη λεγόμενη «ακτινοβολία συγχρότρου» στις εγκαταστάσεις του ESRF (European Synchrotron Radiation Facility) για τη μελέτη της ειδοταυτοποίησης του υδραργύρου σε φυσική οργανική ύλη στις συνήθεις περιβαλλοντικές του συγκεντρώσεις, χρησιμοποιώντας φασματοσκοπία απορρόφησης ακτίνων Χ (βλ. πλαίσιο).
Ανακάλυψαν λοιπόν ότι ο υδράργυρος του εδάφους προσδένεται σε δύο ανηγμένες ομάδες οργανικού θείου, ιδίως θειόλες (-SH). Η θειόλη είναι το θειικό ισοδύναμο του υδροξυλίου (-ΟΗ) που απαντάται στις αλκοόλες. Τα πειράματα στο εργαστήριο δείχνουν ότι η παρουσία ουδέτερων, ανόργανων συμπλόκων υδραργύρου-θειόλης και υδραργύρου-θείου σε διάλυμα καθορίζει τον βαθμό μεθυλίωσης. Αυτό σημαίνει ότι η πρόσδεση του υδραργύρου στις θειόλες που υπάρχουν στην οργανική ύλη του εδάφους καθιστά τον υδράργυρο διαθέσιμο για τα μεθυλιωτικά βακτήρια του περιβάλλοντος. Επιπλέον, δεδομένου ότι τα σύμπλοκα υδραργύρου-θειόλης είναι διαλυτά, είναι πιο εύκολο να μεταφερθούν σε σημεία όπου υπάρχουν μεθυλιωτικά βακτήρια.
Το επόμενο βήμα είναι να προσδιοριστεί ο ρόλος που παίζουν τα διάφορα θειούχα μόρια που απαντώνται συχνά στην οργανική ύλη του εδάφους στη μετατροπή του υδραργύρου στη δηλητηριώδη του μορφή.
Η χρήση της φασματοσκοπίας απορρόφησης ακτίνων (ΧAS) για την ειδοταυτοποίηση του υδράργυρου είναι αρκετά πρόσφατη. Συνιστά σημαντική πρόοδο σε σύγκριση με τις προηγούμενες βιοχημικές μεθόδους «υγρής φάσης» και είναι η πρώτη φορά που καταφέρνουμε να μετρήσουμε τόσο μικρές συγκεντρώσεις υδραργύρου (0,1 g υδραργύρου ανά 1000 g εδάφους).
Η αποκωδικοποίηση της χημικής συμπεριφοράς των ιχνοστοιχείων και των μεταλλοειδών στο περιβάλλον είναι δύσκολη γιατί τα φυσικά υλικά είναι περίπλοκα στη σύνθεση και στη δομή. Με την έλευση των προηγμένων πηγών ακτινοβολίας συγχρότρου που μας παρέχουν τεχνικές εκπομπής έντονων ακτίνων Χ και αυξημένη χωρική ανάλυση, οι επιστήμονες είναι πλέον σε θέση να προσδιορίσουν τις μορφές και την κατανομή των μετάλλων σε ετερογενή συστήματα όπως το έδαφος, τα φυτά και οι συνδυασμοί ορυκτών-μετάλλων-μικροβίων. Για να επιτευχθεί αυτό, εφαρμόζονται ταυτόχρονα τρεις τεχνικές μικρο-ανάλυσης. Η τεχνική του μικροφθορισμού ακτίνων Χ επιτρέπει τη χαρτογράφηση των διαφόρων μετάλλων και τον προσδιορισμό των μεταξύ τους σχέσεων (σχήμα 3). Ακολουθεί ο προσδιορισμός των χημικών ειδών που φιλοξενούν το μέταλλο πάνω σε αυτούς τους χημικούς «χάρτες» (π.χ. άργιλος ή ορυκτό) στα σημεία που παρουσιάζουν ενδιαφέρον. Για τον σκοπό αυτό χρησιμοποιούνται οι τεχνικές της «μικροδιάθλασης ακτίνων Χ» και της «μικροφασματοσκοπίας απορρόφησης ακτίνων Χ». Οι διαθλάσεις αντικατοπτρίζουν την εσωτερική δομή του υλικού. Η ποσοστιαία αναλογία κάθε χημικού είδους στο υπό εξέταση υλικό προσδιορίζεται με ακόμη μεγαλύτερη ακρίβεια μέσω του γραμμικού συνδυασμού των επιμέρους ειδών (με άλλα λόγια με την πρόσθεση των ποσοτήτων που εμφανίζονται στα φάσματα).
Συμπερασματικά, οι τεχνικές ακτίνων Χ που βασίζονται στην ακτινοβολία συγχρότρου είναι πολύτιμες για τον προσδιορισμό των μορφών και των κατανομών των μετάλλων στο έδαφος, στα ιζήματα και στα επιφανειακά ύδατα. Μετά την ειδοταυτοποίηση του μετάλλου το επόμενο βήμα είναι να δούμε πώς μπορούμε να μειώσουμε τη διαλυτότητα και τη βιοδιαθεσιμότητά του. Καθώς ο πληθυσμός της Γης αυξάνεται και οι οικονομίες, ιδίως των αναπτυσσόμενων χωρών, μεγεθύνονται, η ανάγκη για μέταλλα θα αυξηθεί και ταυτόχρονα η αυξημένη χρήση τους θα πολλαπλασιάσει τον κίνδυνο επιμόλυνσης του εδάφους και του νερού. Δεδομένων των σοβαρών δυνητικών συνεπειών για την ανθρώπινη υγεία και τα οικοσυστήματα, η μελέτη της δράσης των μετάλλων στο περιβάλλον είναι ζωτικής σημασίας.
Τεχνικές ακτίνων Χ (για προχωρημένους αναγνώστες)
Για μια απλή επεξήγηση αυτών των δύο τεχνικών βλ. Capellas (2007).
Φασματοσκοπία απορρόφησης ακτίνων X (XAS)
Οι ακτίνες Χ είναι φωτεινή ακτινοβολία με ενέργεια που κυμαίνεται μεταξύ ~500 electron volts (eV) και 500 keV (1 keV = 1000 eV).
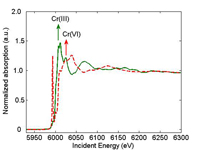
ακτίνων Χ ενός δείγματος Cr(III)
(πράσινο) και ενός δείγματος Cr(VI)
(κόκκινο). Το βέλος δείχνει τη θέση
της αιχμής απορρόφησης. au =
αυθαίρετη μονάδα
Χορηγία εικόνας από Sigrid
Griet Eeckhout
Κατά τη διενέργεια μετρήσεων με χρήση φασματοσκοπίας απορρόφησης ακτίνων (XAS), οι επιστήμονες διαφοροποιούν την ενέργεια των προσπιπτουσών ακτίνων Χ. Όταν η ενέργεια της προσπίπτουσας ακτίνας Χ γίνει ίση με την ενέργεια δέσμευσης ενός εσωτερικού ηλεκτρονίου (συνήθως ενός ηλεκτρονίου 1s) το ηλεκτρόνιο αποβάλλεται από το άτομο. Στο αντίστοιχο φάσμα απορρόφησης ακτίνων Χ θα δούμε μια απότομη αιχμή (σχήμα 1). Η θέση αυτής της «αιχμής απορρόφησης» εξαρτάται επίσης από τον αριθμό οξείδωσης. Για παράδειγμα, η αιχμή απορρόφησης του Cr(VI) παρατηρείται σε υψηλότερη ενέργεια από αυτή του Cr(III). Το αποβαλλόμενο ηλεκτρόνιο αντιδρά με τα γύρω άτομα, με αποτέλεσμα τις αυξομειώσεις που παρατηρούνται στο φάσμα μετά την αιχμή. Αυτές οι αυξομειώσεις μας δίνουν χρήσιμες πληροφορίες για τα γειτονικά άτομα.
Δεδομένου ότι κάθε άτομο διαθέτει εσωτερικά ηλεκτρόνια με γνωστές ενέργειες δέσμευσης, η τεχνική XAS εξειδικεύεται ανά στοιχείο. Αυτό σημαίνει ότι μπορείτε να μελετήσετε το στοιχείο που θέλετε (π.χ. υδράργυρο) στο εσωτερικό ανομοιογενούς μάζας όπως π.χ. δείγμα εδάφους που αποτελείται από οργανική ύλη, μικρόβια, ορυκτά, μέταλλα κλπ.
Το φάσμα XAS λαμβάνει υπόψη τον αριθμό οξείδωσης (δηλαδή τον αριθμό των ηλεκτρονίων που είναι διαθέσιμα για τον σχηματισμό ενώσεων με άλλα άτομα), τη στερεοχημεία (π.χ. οκταεδρική ή τετραεδρική διάταξη) καθώς και τις αποστάσεις, τη διάταξη και το χημικό είδος των ατόμων που βρίσκονται κοντά στο επιλεγμένο στοιχείο.
Φθορισμός ακτίνων Χ
Οι γνωστές ενέργειες δέσμευσης των διαφόρων στοιχείων χρησιμοποιούνται σαν ένα είδος δακτυλικού αποτυπώματος στην τεχνική φθορισμού ακτίνων Χ. Μεταβάλλοντας την ενέργεια και καταγράφοντας τις αιχμές που αντιστοιχούν σε συγκεκριμένες τιμές μπορούμε να διαπιστώσουμε ποια στοιχεία είναι παρόντα (Σχήμα 2).
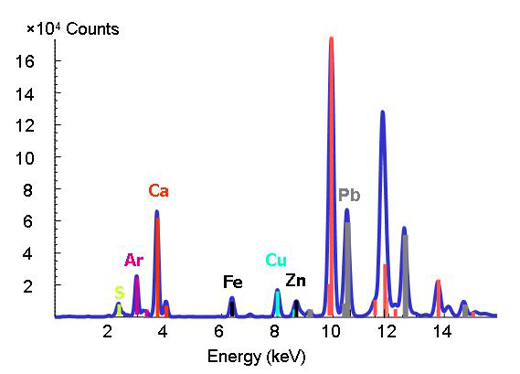
Χορηγία εικόνας από ESRF
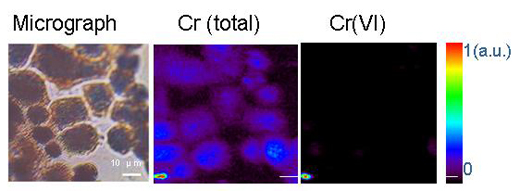
Ανατύπωση με άδεια του περιοδικού Chemical Research in Toxicology. Copyright (2005) American Chemical Society
References
- Capellas M (2007) Recovering Pompeii. Science in School 6: 14-19. www.scienceinschool.org/2007/issue6/pompeii
- Skyllberg U, Bloom PR, Qian J, Lin CM, Bleam WF (2006) Complexation of mercury(II) in soil organic matter: EXAFS evidence for linear two-coordination with reduced sulfur groups. Environmental Science & Technology 40: 4174-4180
- Αυτό το άρθρο επιλέχθηκε από περισσότερα από 1100 άρθρα του περιοδικού Environmental Science and Technology ως το καλύτερο κείμενο στο τομέα της περιβαλλοντικής επιστήμης για το 2006.
Web References
-
w1 – Για μια συζήτηση για το χρώμιο σε σχέση με την ταινία Erin Brockovich, βλ.:
Stevens J (2007) Erin Brockovich. Science in School 4: 67-69. www.scienceinschool.org/2007/issue4/erinbrockovich/
Resources
- Για μια σύντομη εξήγηση της χρήση της ακτινοβολίας συγχότρου στο ESRF βλ.: www.scienceinschool.org/2006/issue1/maryrose#esrf
- Για πληροφορίες σχετικά με το ESRF βλ.: www.esrf.eu





