Lebewesen grün einfärben: GFP Understand article
Übersetzt von Veronika Ebert, Höhere Bundeslehr- und versuchsanstalt für chemische Industrie, Wien. Von der Qualle, über einen Nobelpreis bis hin zu Arsendetektoren: Sonia Furtado berichtet über die Entdeckung und die Entwicklung des „green fluorescent proteins“ (grün fluoreszierendes…
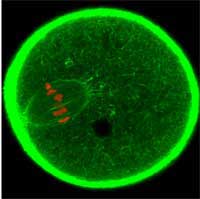
einem Ei heran zu reifen. GFP
wurde verwendet, um das
Actinskelett grün, und die
Chromosomen rot zu
markieren
Mit freundlicher Genehmigung
von Jan Ellenberg / EMBL
Begonnen hat alles mit einer Qualle: die transparente Aequorea victoria besitzt rund um ihren Tentakelring Areale, die grün leuchten, wenn sie bewegt wird. Dieses Phänomen wurde 1955 erstmals wissenschaftlich beschrieben. Das Studium dieses Kuriosums wurde als wissenschaftliche Revolution bejubelt, und brachte kürzlich drei Wissenschaftlern den Nobelpreisw1. Das alles nur wegen eines einzigen Proteins, des GFP, das die Fluoreszenz der Qualle verursacht.
In den frühen 1960er Jahren entdeckte der japanische Wissenschaftler Osamu Shimomura Aequorin, ein Quallenprotein, das in der Gegenwart von Kalziumionen leuchtet. Während Aquorin blaues Licht abstrahlt, leuchtet die Qualle grün – es muss also irgendetwas geben, das das blaue Licht des Aequorins in das grüne Leuchten der Qualle transformiert. Shimomura identifizierte dieses „Irgendetwas“ als weiteres Protein: GFP. Dieses Protein absorbiert das blaue Licht des Aequorins, sowie UV-Licht, und emittiert grünes Licht, das von der Qualle abstrahlt wird.
Der US Biologer Martin Chalfie hatte dann eine Idee, wie man diesen Effekt nutzen könnte: er schlussfolgerte, dass ein Modellorganismen genetisch so verändert werden könnten, dass das GFP-Gen mit dem zu untersuchenden Gen verschmolzen wird. Wenn das interessierende Gen exprimiert wird (in das Protein übersetzt wird, für das es kodiert), wäre es mit dem GFP verbunden. Dadurch wüsste man, wann ein bestimmtes Gen aktiviert wird: man muss den Organismus nur mit UV-Licht bestrahlen und nach einem grünen Leuchten Ausschau halten.
Zu dieser Zeit fehlten aber offensichtlich noch Zweierlei, bevor Chalfies Vision realisiert werden konnte: Die Identifikation des GFP-Gens und die Aufklärung des Mechanismus der GFP-Fluoreszenz. Bekannt war, dass drei bestimmte Aminosäuren eine Fluorophore (chemische Gruppe, die Licht absorbiert und emittiert) bilden, wodurch das GFP leuchtet. Man vermutete damals, dass andere, von A. victoria gebildete Proteine, nämlich Enzyme, erforderlich sind, um das GFP korrekt zu falten, wie das von verschiedenen fluoreszierenden Proteinen bekannt war.
Als der Biochemiker Douglas Prasher das GFP 1992 identifizierte, herrschte die übereinstimmende Annahme, dass der Transfer des Gens in einen anderen Organismus zur Bildung einer nicht-fluoreszierenden Form des GFP führen würde. Überraschenderweise leuchteten Bakterien, in deren DNS das GFP-Gen eingefügt worden war, dennoch grün!
Mit freundlicher Genehmigung von Typoform / the Royal Swedish Academy of Sciences (RSAS)

faltet sich in die Form eines
Zylinders, mit einer
Fluorophore in der Mitte
Mit freundlicher Genehmigung
von Typoform / the Royal
Swedish Academy of Sciences
(RSAS)
Es zeigte, sich, dass für das Leuchten des GFP keine Enzyme erforderlich waren. Stattdessen faltet es sich spontan in seine fluoreszierende Form. Der Biochemiker Roger Tsien fand heraus, dass zum Leuchten des GFP nur Sauerstoff benötigt wird, der in den meisten Zellen vorhanden ist.
Nach der genauen Aufklärung des Mechanismus der Fluorophorbildung war Tsien in der Lage, das Protein zu verändern. Er entwickelte durch den Austausch verschiedener Aminosäuren neue GFP-Varianten, die heller leuchteten und andere Wellenlängen absorbierten. Diese Varianten emittierten unterschiedliche Farben: blaugrün, blau und gelb. Und sobald ein rot fluoreszierendes Protein in Korallen entdeckt worden war, nutzen Tsien und seine Kollegen/innen ihre GFP-Expertise um auch dieses rot fluoreszierende Protein als biologischen Marker verwendbar zu machen.
Shimomura, Chalfie and Tsien wurden 2008 „ für die Entdeckung und Entwicklung des GFP“ mit dem Nobelpreis für Chemie ausgezeichnet. Andere Wissenschaftler/innen haben weitere Varianten des GFP in allen Spektralfarben entwickelt, die nun ebenfalls verfügbar sind.
GFP ist mittlerweile ein unentbehrliches Werkzeug für Wissenschaftler/innen auf der ganzen Welt. GFP schädigt Zellen weit weniger als andere Fluoreszenzfarbstoffe. Nach einer gewissen Bestrahlungszeit gibt die Fluorophore ein Elektron ab, und verliert ihre Fluoreszenzfähigkeit für immer, der Farbstoff ist ausgebleicht.
Das bei diesem Bleichprozess freigesetzte Elektron reagiert sehr rasch mit Sauerstoff und bildet dabei hochgiftige Sauerstoffradikale, die zelluläre Strukturen beschädigen, und Zellen manchmal sogar töten. Dagegen wirkt die Struktur des GFP wie eine Schutzschild für die Zelle. Bei der Freisetzung des Elektrons aus der Fluorophore werden Radikale gebildet, die mit dem GFP reagieren und die Zelle nicht mehr attackieren können.
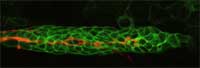
Gruppe von Zellen leitet
andere Zellen (grün),
während sie entlang des
Zebrafischembryos wandern
Mit freundlicher Genehmigung
von Darren Gilmour / EMBL
Während manche Wissenschaftler/innen das GFP als Marker verwenden, um einzelne Proteine zu markieren, nutzen andere GFP zum Studium vielfältiger Prozesse in anderen Größenordnungen, von der Markierung einer Zellgrupe bis zur Markierung individueller Moleküle.
“Das ist das Schöne am GFP”, meint Darren Gilmour, ein Wissenschaftler am EMBLw2: „Mit ihm kann man Objekte unterschiedlichster Größen untersuchen, sie können alle mit dem gleichen Farbstoff eingefärbt werden, ohne den Pinsel wechseln zu müssen.“
Bei ihrer Arbeit mit Zebrafischen verwendete Darren und seine Arbeitsgruppe das GFP, um Zellgruppen zu markieren, die dann in sich entwickelnden Embryonen verfolgt werden können. So kann beobachtet werden, wie sie sich verhalten, wohin sie wandern, und welche Gewebe und Organe aus ihnen hervorgehen. Da die von Darren untersuchten Zebrafische transparent sind, sollte man nicht annehmen, dass es schwierig sein könnte, die Prozesse im Inneren direkt zu beobachten. „Das Problem ist aber“, so Darren, „dass zu viel gleichzeitig passiert“. „Das überfordert. Man kann sich nicht konzentrieren, einen einzelnen Prozess herausfiltern“. „Aber mit GFP“, fügt er hinzu, „ kann man das Licht abdrehen und sich auf eine Gruppe von Zellen, oder sogar auf eine einzelne Zelle konzentrieren.“ (Weitere Details zu Darrens Arbeiten siehe Spinney, 2007).
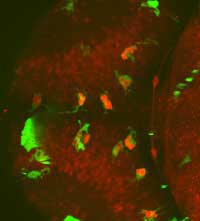
Wissenschaftler/innen das
ganze Gehirn eines
Zebrafischembryos sichtbar
machen, Interaktionen
zwischen Mikrogliazellen
(grün) und Nervenzellen (rot),
beobachten, und
Nervenzellen im Inneren von
Mikrogliazellen visualisieren
(hellrot)
Mit freundlicher Genehmigung
von Francesca Peri / EMB
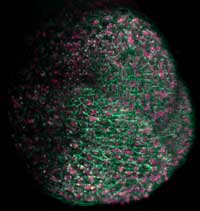
Apikalmeristems einer
Arabidopsis-Pflanze, das sich
zu dem über dem Boden
gelegenen Pflanzenteilen
entwickeln wird, wurden
fluoreszierende Proteine
verwendet, um
Zellmembranen grün, und
Zellkerne pink einzufärben
Mit freundlicher Genehmigung
von Ernst Stelzer / Marcus
Heisler / EMBL
Die Möglichkeit, einen dynamischen Prozess zu verfolgen ist auch für Francesca Peri von entscheidender Bedeutung. Sie kann die Entwicklung markierter Zebrafischembryonen unter dem Mikroskop tagelang verfolgen. Ohne diese Möglichkeit müsste man die Tiere töten, feine Schnitte herstellen und unbewegte Bilder aufzeichnen. „Das wäre vergleichbar mit dem Versuch, ein Fußballspiel durch die Beobachtung eines halben Duzend Fotos verstehen zu wollen.“, sagt Francesca. „Man würde nie ein Gesamtbild erhalten.“ Sie und ihre Arbeitsgruppe untersuchen Mikrogliazellen, die in der Lage sind, absterbende und beschädigte Nervenzellen aufzufressen. „Durch die Verwendung von GFP können wir verschiedene Zelltypen farblich kodieren: So können Mikrogliazellen z.B. grün markiert werden, und Nervenzellen rot. Wenn wir dann eine rote Zelle im Inneren einer grünen Zelle entdecken, wissen wir, dass die Nervenzelle aufgefressen worden ist. So können Gewebsschäden im Gehirn vermieden werden.“
Marcus Heisler und seine Arbeitsgruppe verwenden GFP zur Untersuchung von Pflanzen. Sie konzentrieren sich auf ein Pflanzenhormon mit dem Namen Auxin. Auxin wird durch ein in der Zellmembran liegendes Transportprotein aus der Zelle ausgeschleust. Dieses Transportprotein kann sich in der Zellmembran bewegen und dadurch die Richtung der Hormonabgabe ändern. „GFP ermöglicht es uns, diese sehr dynamischen Prozesse in lebenden Pflanzen zu untersuchen“, erklärt Marcus. „Außerdem bekommen wir eine sehr gute 3-dimensionale-Auflösung.“
“Die Zuverlässigkeit von GFP ist essentiell um solche 3-dimensionalen Aufnahmen zu bekommen”, erläutert Ernst Stelzer, dessen Arbeitsgruppe sich mit der Entwicklung von dynamischen 3-dimensionalen bildgebenden Verfahren beschäftigt. „Es ist immer schwierig, einen Farbstoffe in eine dicke Probe hinein zu bekommen“, meint er. Marker, die in die Probe injiziert werden, verteilen sich nicht gut, und die Markierung wird ungleichmäßig: äußere Schichten werden besser markiert, während in der Mitte liegende Zellen, wenn überhaupt, nur schwach markiert sind. „Mit GFP“, hebt Ernst hervor, „können wir uns sicher sein, dass die ganze Probe gefärbt wird, weil der Farbstoff im Inneren der Zellen gebildet wird.“
Ein anderer EMBL-Wissenschaftler, Rainer Pepperkok, erklärt: “Mit GFP können wir wirklich molekulare Prozesse in sich bewegenden Objekten untersuchen, anstatt in Teströhrchen arbeiten zu müssen.“ Er und andere Wissenschaftler/innen profitieren von der Tatsache, dass GFP in verschiedenen Farben verfügbar ist, und nützen ein physikalisches Phänomen mit dem Namen FRET (fluorescent resonance energy transfer).
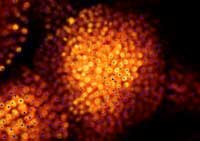
Computersimulationen und
GFP-Markierungen können
Wissenschaftler/innen ihre
Vorhersage (blau) mit der
realen Lage von Zellkernen
(orange) vergleichen
Mit freundlicher Genehmigung
von Marcus Heisler / EMBL
Dieses Phänomen tritt auf, wenn sich zwei fluoreszierende Moleküle mit unterschiedlicher Farbe – üblicherweise rot und grün – räumlich sehr nahe kommen. Wenn das grüne Molekül dann durch blaues Licht angeregt wird, absorbiert es dieses, und überträgt einen Teil der aufgenommen Energie auf das rote Molekül. Dieses sendet dann – ähnlich wie grün leuchtendes GFP, das vom blauen Licht des Aequorins angeregt wird – rotes Licht aus. „Wenn nun ein Protein, das mit grünem GFP markiert ist, und ein anderes, das mit rotem RFP (rot fluorszierendes Protein) markiert ist, miteinander in Kontakt treten, wird das rote hell aufleuchten und das grüne an Leuchtkraft verlieren“, so Rainer.
Trotz der vielfältigen Anwendungsmöglichkeiten von GFPs, oder vielleicht gerade deswegen, sind die Wissenschaftler/innen noch immer nicht zufrieden. Ein häufiger Wunsch wäre ein GFP, das durch rotes oder infrarotes Licht angeregt werden kann, weil diese Wellenlänge besser in biologisches Material eindringt. „Das würde auch das Spektrum unterschiedlicher Farben erweitern“, betont Jan Ellenberg. „Dadurch wäre es möglich, noch mehr Proteine zu markieren und gleichzeitig zu verfolgen.“ Jan vermutet, dass die bisher eingesetzten Methode, das GFP an längere Wellenlängen anzupassen – weitere Aminosäuren in die Fluorophore hinein zu packen – ziemlich ausgereizt ist. Es bedarf vermutlich einer weiteren Entdeckung, um diesen Wunsch wahr werden zu lassen.
Darren glaubt auch, dass zuerst die mikroskopischen Techniken weiter entwickelt werden müssen: “Im Augenblick können wir einen Zebrafisch mit fünf unterschiedlichen Farben markieren, aber mit den verfügbaren Mikroskopen können wir die unterschiedlichen Farben gar nicht voneinander trennen.“
Unabhängig davon gewinnt das GFP auch für Bereiche außerhalb der Wissenschaft an Bedeutung. GFP wird in manchen Spielzeugen, die in der Dunkelheit leuchten, verwendet. Auch für Leuchtfische, die als Haustiere angeboten werden, und sogar für Bakterien, die genetisch so modifiziert worden sind, dass sie Arsen, TNT und Schwermetalle detektieren können, wird GFP genutzt.
Trotz der genannten Vorteile, bleibt das ursprüngliche Rätsel unaufgeklärt: wir wissen immer noch nicht, WARUM die Quallen als Erste die Fähigkeit entwickelt haben, in der Dunkelheit zu leuchten.
References
- Spinney L (2007) Die große Wanderung. Science in School 7. www.scienceinschool.org/2007/issue7/migration/german
Web References
- w1 – Weitere Informationen zum Nobelpreis 2008 finden sich unter: http://nobelprize.org/nobel_prizes/chemistry/laureates/2008
- w2 – Weitere Informationen über das EMBL und seine Forschungsgebiete findet man unter: www.embl.org





