Les neutrons et l´antigel: étude sur les poissons de l´Arctique Understand article
Traduit par Juliette Savin. Matthew Blakeley de l´ILL et des collègues de l´ESRF et d´ailleurs ont découvert comment un antigel présent dans le sang de poisson de l´Arctique agit pour leur permettre de rester en vie à des températures négatives. Il explique, avec Eleanor Hayes.

courtes (Myoxocephalus
scorpius) possède aussi des
protéines antigel
Image du domaine publique;
source: Wikimedia Commons
Lorsque nous pensons à l´ Arctique, beaucoup pensent aux icebergs, aux ours polaires et aux phoques. Des températures glaciales, des vents gelés et des étendues enneigées désolées – un défi pour toute vie animale.

l´Arctique ont forcé les
animaux à faire preuve de
remarquables adaptations
Image reproduite avec
l’aimable autorisation de
ucumari; source: Flickr
Nous connaissons les mécanismes d´adaptation à leur environnement des animaux de l´Arctique: la fourrure épaisse des ours polaires, la couche de gras des phoques, les habitudes migratoires de beaucoup d´oiseaux. Ces animaux sont tous des endothermes et maintiennent une température corporelle constante, bien plus élevée que celle de leurs environs gelés.
Pour les poissons, la situation est tout autre – ils sont exothermes pour la plupart, ce qui signifie que leur température corporelle est la même que la température environnante. Et leur environnement est très froid : l´Océan Arctique atteint régulièrement des températures aussi basses que -1 °C, et tout ce qui l´empêche de geler est la haute teneur en sel de l´eau.
Le sang des poissons est beaucoup moins salé et devrait geler à -0,5 °C. Pour éviter ça, les poissons de l´Arctique ont développé des protéines biologiques antigel (PAG).

l’aimable autorisation de Rita
Willaert; source: Flickr
Les PAG n´ont pas la tâche facile. Pour empêcher aux poissons de mourir gelés, elles doivent se lier aux germes des cristaux de glace, dès qu´ils commencent à se former dans le corps des poissons, empêchant ainsi la croissance de ces cristaux. Mais comment distinguent-elles l´eau liquide de la glace ?
Les PAG ont été beaucoup étudiées avec différentes techniques, dont la diffraction de rayons X, qui a révélé l´existence d´une surface de liaison spéciale, qui ne se lie qu´à la glace.
La diffraction des rayons X dépend du degré de diffraction des rayons X par le nuage d´électrons de chaque atome. Plusieurs molécules ont des motifs de diffraction distincts. Cependant, les atomes d´hydrogène (et de deutérium), qui ont seulement un électron, ne diffractent pas bien les rayons X (Figure 1a, ci-dessous), et le motif de diffraction avec des rayons X pour l´eau (H2O) est presque le même que celui pour l´oxygène (O). C´est pour cela que, lorsque les chercheurs ont essayé d´examiner comment la surface de liaison interagissait avec la glace, ils n´ont pas pu identifier toutes les molécules d´eau à la surface.
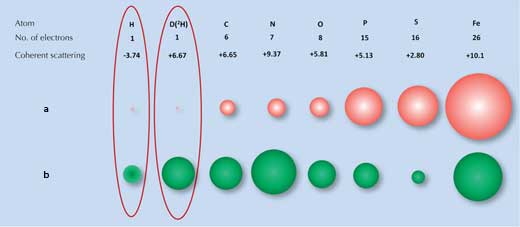
a) Les rayons X sont diffractés par les électrons, et la force de la diffraction (taille des boules rouges) est proportionnelle au nombre d´électrons.
b) Les neutrons sont diffusés par les noyaux, et la force de la diffusion (taille des boules vertes) dépend des forces nucléaires
Image reproduite avec l’aimable autorisation de Matthew Blakeley

les protéines antigel de la
Loquette d´Amérique,
Zoarces americanus
Image reproduite avec
l’aimable autorisation de Derek
Keats; source: Flickr
C´est ici qu´une seconde technique, la diffusion neutronique, est utile. Les neutrons sont diffusés par les noyaux atomiques et non les électrons, et la force de la diffusion dépend des forces nucléaires spécifiques. Ces forces ne dépendent pas uniquement des éléments, mais aussi des isotopes des éléments, qui diffèrent par le nombre de neutrons dans leur noyau. (Figure 1b, ci-dessus). Heureusement pour nous, les atomes d´hydrogène sont faciles à détecter avec la diffusion neutronique et l´isotope d´hydrogène, le deutérium (de l´hydrogène lourd, avec un neutron en plus) peut être détecté avec encore plus de certitude. Donc le motif pour l´eau est considérablement différent de celui pour l´oxygène.
Nous (Matthew Blakeley et ses collègues scientifiques) avons décidé d´étudier un type de PAG présent dans le sang des poissons de l´Arctique : les PAG de type III. Pour éviter les problèmes qu´avaient eu les autres chercheurs, nous avons utilisé une combinaison de rayons X et de diffusion neutronique, pour examiner la structure de la protéine et la façon dont elle interagit avec les molécules d´eau. Pour notre expérience, nous avons utilisé les installations de l´Institut Laue-Langevin (ILL)w1 et l´ESRF (Installation Européenne pour la Radiation Synchrotronw2; voir l´encadré ci-dessous). La recherche avec des neutrons sur de si petits volumes de cristaux a été possible grâce aux progrès en matière de préparation des échantillons et d´instrumentation, qui ont été réalisés à l´ILL ces dernières années.
Comme c´est courant pour des études de structure de protéines, nous avons introduit le gène de la PAG de type III dans Escherichia coli, où il a été surexprimé, pour nous permettre de récolter suffisamment de protéine. Les bactéries ont été alimentées avec de l´eau lourde (qui contient du deutérium au lieu d´atomes d´hydrogène normaux), de façon à ce que les protéines produites soient perdeutérés et que toutes les positions d´atomes de H soient occupées par du deutérium. Nous avons ensuite cristallisé la protéine, ce qui nous a permis de déterminer sa structure, tout en vérifiant que la forme perdeutérée avait la même structure que la forme normale. (cf Cornuéjols, 2009, et Blattmann & Sticher, 2009, pour en savoir plus sur la cristallographie de protéines et même essayer vous-mêmes.)
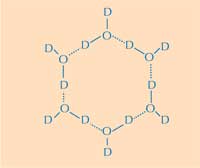
membres. D = deutérium; O
= oxygène. Cliquer sur
l’image pour l’agrandir
Image reproduite avec
l’aimable autorisation de Nicola
Graf
Les PAG de type III distingue la glace de l´eau liquide en partie de par leur structure, qui est différente de celle de protéines typiques. Ces dernières ont normalement des acides aminés hydrophobes dans leur partie centrale (loin des molécules d’eau environnantes) et des acides aminés hydrophiles à leur surface. Comme ça a déjà été démontré par d’autres chercheurs, les PAG sont particulières, parce qu’elles ont beaucoup d’ acides aminés hydrophobes à leur surface, ce qui les empêche de se lier avec l’ eau liquide à travers des liaisons hydrogènes. Ces acides aminés hydrophobes forment une partie de la surface liante, qui se lie aux noyaux de glace, mais non aux noyaux d’eau liquides. Comment cela fonctionne-t-il ?
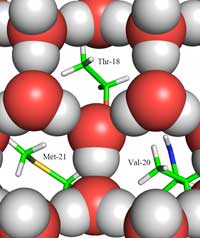
glace (représentée par les
boules rouges et vertes) et le
site de liaison avec la glace,
montrant les groups
méthyles des résidus
hydrophobes [hydrophobic
residues] Thr-18, Val-20 et
Met-21, qui font face aux
trous dans la structure de la
glace. Cliquer sur l’image
pour l’agrandir
Copyright © 2011 John Wiley &
Sons, Ltd; source:
Howard et al. (2011)
C’est la que se trouve la deuxième partie de la réponse : comment la structure de la glace diffère-t-elle des celle de l´eau liquide ? Grace à la diffusion neutronique, nous avons pu localiser les positions des molécules d’eau sue la surface liante. Nous avons identifié un groupe (cluster) de molécules d’eau, de forme tétraédrique qui se lie à la surface liante des protéines PAG. Ce cluster tétraédrique est présent dans l’eau liquide (comme l’a montré notre expérience) mais aussi dans la glace. Ceci nous a permis d’établir un modèle du reste du cristal d’eau et d’en déduire comment il se lie à PAG. Notre modèle se compose d´anneaux de molécules d’eau organisés en une configuration dite beateau: six molécules d’eau dans une configuration hexagonale laissant un trou au milieu (voir Figure 2, ci-dessus). C’est ce trou qui permet aux PAG de type III de distinguer la structure des noyau de cristaux de glace de celle de l’eau : les régions hydrophobes de la surface liante des PAG de type II s’insèrent dans les trous, s’y liant a travers des forces Van der Waal (Figure 3). A l’inverse, l’eau liquide ne possède pas de trous dans lesquels les régions hydrophobes comme les groupes méthyles pourraient s’insérer. Ceci empêche une grande surface de contact entre l’eau liquide et les sites de liaison avec la glace, qui serait nécessaire pour une forte interaction.

de l´Arctique sans les
protéines antigel?
Image reproduite avec
l’aimable autorisation de
dwleindecker / iStockphoto
Bien que d’autres chercheurs aient proposé que les résidus hydrophobes jouent un rôle important dans la reconnaissance des cristaux de glace par les PAG de type III, nos résultats sont les premières données expérimentales le confirmant.
C’est intéressant en soi d’en savoir plus sur la façon dont les poissons de l’Arctique survivent dans leur environnement, mais notre recherche peut aussi avoir des applications industrielles. Les PGA de type III ont déjà été incorporées dans des crèmes glacées pour minimiser l’accumulation de larges cristaux de glace et en améliorer la consistance. Les gènes codant pour des PAG pourront dans le futur être insérés dans le génome de plantes pour les empêcher de geler au-dessous de zéro.
En savoir plus sur l’ILL et l’ESRF

L’Institut Laue-Langevin (ILL)w1 est un centre de recherche international à la pointe de la science et de la technologie des neutrons. Il opère une des sources de neutrons les plus intenses du monde, avec des faisceaux de neutrons alimentant une suite de 40 instruments de haute performance et constamment actualisés.
L´ILL est in institut de service et son rôle est de mettre ses installations et son expertise à la disposition des chercheurs visiteurs. Tous les ans, près de 1200 chercheurs venant de plus de 30 pays visitent l´ILL à Grenoble en France. Plus de 800 expériences sont menées chaque année, se concentrant surtout sur de la recherche fondamentale dans des domaines variés : chimie, biologie, physique nucléaire, science des matériaux et physique de la matière condensée.
L´ESRF (Installation Européenne pour la Radiation Synchrotron)w2 est un centre de recherche international, situé sur le même site que l´ILL à Grenoble en France. Cet instrument produit des faisceaux de rayons X extrêmement brillants, qui sont utilisés par des milliers de scientifiques venant de partout dans le monde, tous les ans.
La complémentarité des faisceaux de lumière synchrotron (rayons X) et des faisceaux de neutrons nous permet de comprendre comment fonctionnent des systèmes complexes, comme les PAG présentées dans cet article. Pour exploiter au maximum la synergie entre la neutronique et la radiation synchrotron, l´ESRF et l´ILL ont joué un rôle clé dans la mise en place du partenariat pour la Biologie Structurelle (PSB) ; d´autre partenariat sont prévus dans le futur.
L´ILL et l´ESRF sont membres de EIROforumw3, l´éditeur de Science in School.
References
- Blattmann B, Sticher P (2009) Growing crystals from protein. Science in School 11: 30-36.
- Cornuéjols D (2009) Cristaux biologiques : à l’interface entre physique, chimie et biologie. Science in School 11.
- Howard EI, Blakeley MP et al. (2011) Neutron structure of type-III antifreeze protein allows the reconstruction of AFP–ice interface. Journal of Molecular Recognition 24: 724-732. doi: 10.1002/jmr.1130
Web References
- w1 – Pour en savoir plus sur l´ILL, voir: www.ill.eu
- w2 – Pour en savoir plus sur l´ESRF et PSB, voir www.esrf.eu et www.psb-grenoble.eu
- w3 – Pour plus d´information sur l´EIROforum, voir: www.eiroforum.org
Institutions
Review
Si vous vous demandez comment les poissons font pour survivre dans les océans gelés, vous trouverez la réponse dans cet article intéressant, qui conduit le lecteur à travers une étude de la structure des protéines et de leurs interactions.
Cet article peut être utilisé comme lecture pour préparer un cours sur les biomolécules ou comme base de discussion sur le rôle des protéines dans les organismes vivants. Quelques questions de compréhension:
- Décrivez la façon dont les poissons de l´Arctique se sont adaptés aux eaux gelées de l´Arctique.
- Comment les PAG agissent-elles dans le sang des poissons?
- Quelles sont les limites de la diffraction de rayons X lors de l´analyse des PAG?
- Quelles sont les différences entre la diffusion neutronique et la diffraction des rayons X?
- Décrivez les étapes de l´étude des la structure des PAG.
- En quoi les PAG sont elles différentes des autres protéines?
- Comment le PAG distinguent-elles la glace de l´eau liquide?
Angela Charles, Malta





