Dos enzimas hidrolíticas y un enfoque epistemológico e histórico Teach article
Traducido por I. Carrero, Univ. de Valladolid. ¿Por qué son tan especiales las enzimas? ¿En qué se diferencian de los catalizadores inorgánicos? Isabella Marini, de la Universidad de Pisa, (Italia) nos da un protocolo experimental que permite a los estudiantes responder por sí mismos a…

algunos de sus estudiantes
del Liceo Científico Ulisse
Dini (Pisa)
Imagen cortesía de Isabella
Marini
¿Pueden la historia y la epistemología ayudarnos en la enseñanza de la ciencia?
Cuando los estudiantes empiezan a estudiar las reacciones químicas razonan como alquimistas, no como químicos: interpretan las reacciones como transmutaciones (como hacían los alquimistas) y no como transformaciones (como hacen los químicos actuales). Luego, durante el aprendizaje, reproducen el desarrollo del conocimiento humano; es un proceso evolutivo clave que no se puede subestimar.
Aunque los profesores no necesitan dar obligatoriamente lecciones específicas sobre historia de la ciencia, sí deben ser conscientes de su importancia. La historia de la ciencia y la epistemología (la filosofía del conocimiento) son fundamentales porque, junto con la psicología, nos ayudan a entender los requerimientos de cada etapa del proceso educativo. Tener presente que los humanos han malinterpretado ciertos fenómenos durante siglos y que la solución a esos enigmas constituye la base de la ciencia nos puede ayudar a darnos cuenta de que muchos razonamientos son incomprensibles para nuestros estudiantes sin una aproximación gradual a los nuevos conceptos.
Al presentar las enzimas a los estudiantes de secundaria más jóvenes, quería que descubrieran por ellos mismos lo que hace que estas moléculas sean tan especiales e importantes. Elegí la amilasa y la invertasa, dos enzimas fáciles de obtener y cuya actividad catalítica se puede detectar casi sin necesidad de instrumentos, solo con nuestros ojos.
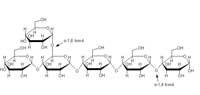
del almidón. La amilasa
cataliza la endohidrólisis de
los enlaces glicosídicos
α(1,4). Haga clic sobre la
imagen para ampliarla. Haga
clic sobre la imagen para
ampliarla
Imagen cortesía de Isabella
Marini
Algunas referencias históricas
En 1812, Kirchoff consiguió hidrolizar el almidón calentándolo con ácido sulfúrico. Sorprendentemente, el pH no se modificaba durante la reacción, lo que sugería que el ácido no participaba en ella; sin embargo, su presencia era imprescindible.
Dos décadas más tarde, Payen y Persoz llevaron a cabo una precipitación etanólica y aislaron de granos de cebada en germinación una sustancia blanca e hidrosoluble (Payen & Persoz, 1833). Esta sustancia se denominó diastasa (del griego «diástasis», separación; N. del T.) porque era capaz de hidrolizar el almidón. Posteriormente la diastasa pasó a llamarse amilasa; sin embargo, el sufijo «-asa» se ha aplicado al nombre de la mayoría de las enzimas que se conocen.
En 1835, Berzelius demostró que el extracto de cebada en germinación catalizaba la hidrólisis del almidón más eficazmente que el ácido sulfúrico. Fue él quien acuñó el término «catálisis»; cantidades muy pequeñas de los catalizadores incrementan la velocidad de reacciones específicas sin consumirse. La velocidad de las reacciones bioquímicas tenía ya su explicación; catalizadores celulares especiales trabajan en las condiciones biológicas. La misma idea subyace en los siguientes experimentos.
Amilasas
Para utilizar los carbonos y la energía almacenados en el almidón, el sistema digestivo humano tiene que romper primero este polímero en moléculas más pequeñas. La amilasa α salival (1,4-α-D-glucano-glucohidrolasa; n.º EC 3.2.1.1 de la Comisión de Enzimas) inicia la digestión de los polisacáridos en la boca (el proceso lo completará la amilasa pancreática en el intestino delgado). La amilasa α es una glicoproteína monomérica que une calcio y que hidroliza aleatoriamente los enlaces glicosídicos α(1,4) del almidón (ver figura).
La amilasa β (1,4-α-D-glucano-maltohidrolasa; EC 3.2.1.2) cataliza la hidrólisis de los enlaces glicosídicos α(1,4) del almidón eliminando unidades de maltosa sucesivas a partir de los extremos no reductores de las cadenas. Esta amilasa es una de las principales proteínas del endospermo rico en almidón de los granos de cebada (Hordeum vulgare) y es una enzima clave en la degradación del almidón durante la producción de cerveza.
Invertasa
La invertasa o sacarasa (sacarosa-α-D-glucohidrolasa; EC 3.2.1.48) cataliza la hidrólisis de sacarosa y de maltosa. La sacarosa, comúnmente conocida como azúcar de caña, es un disacárido formado por una molécula de α-D-glucosa y por otra de β-D-fructosa unidas por un enlace glicosídico α1-β2. Cuando se hidroliza este enlace, se obtiene una mezcla equimolar de glucosa y fructosa (ver figura). En la levadura (Saccharomyces cerevisiae), la invertasa tiene formas tanto intra- como extracelulares.
Protocolo experimental
Materiales
- Tampón fosfato, 50 mM, pH 7 (Tampón A). Se prepara disolviendo en agua destilada 3,55 g de hidrógenofosfato de sodio (Na2HPO4) y ajustando el pH a 7,0 (con pH-metro) utilizando para ello ácido clorhídrico (HCl); después se enrasa a 500 mL con agua destilada.
- Disoluciones en Tampón A: almidón a 10 g/L; sacarosa a 0,1 M; glucosa a 0,1 M y fructosa a 0,1 M.
- Reactivo de Lugol. A 20 g de yoduro potásico (KI) y 12,7 g de yodo (I2) se les añade agua destilada hasta un volumen de 1 L. Esta solución se diluye 1/5 con agua destilada.
- Reactivos de Fehling A (7 g de sulfato de cobre [II] pentahidratado,
CuSO4·5H2O, en 100 mL de agua destilada) y B (34 g de tartrato sódico-potásico hidratado, (CHOHCOO)Na(CHOHCOO)K –N. del T.–, y 12 g de hidróxido sódico, NaOH, en 100 mL de agua destilada). - Hidróxido sódico a 5 M.
- Ácido clorhídrico a 5 M.
- Saliva. En la saliva, la amilasa α ya está disuelta y no requiere homogeneización. Se puede diluir simplemente 1/10 con Tampón A.
- Granos de cebada. Homogeneizar los granos de cebada en germinación (3-5 días tras la siembra) machacándolos en un mortero y recogiéndolos con Tampón A (aproximadamente 1 g de cebada/mL de tampón). Centrifugar el extracto 5 min a 15 000 x g; el líquido obtenido será la muestra de amilasa β. Si no se dispone de centrífuga, filtrar el homogenado y trabajar con el filtrado.
- Levadura a 0,4 g/L en Tampón A (la levadura de panadería se puede conseguir en comercios especializados).
Métodos
Método de Lugol
En solución acuosa, el yodo y el almidón forman un complejo azul-violáceo con gran especificidad y sensibilidad. La maltosa y la glucosa no reaccionan con el yodo.
Método de Fehling
Cuando se calienta una solución alcalina de ión cúprico (Cu2+) pen presencia de azúcares reductores (como glucosa o fructosa, pero no sacarosa o almidón), el ión cúprico se reduce a cuproso (Cu+), y se forma un precipitado rojizo de óxido cuproso (Cu2O).
Procedimientos
Para poner a punto los métodos, probar las cuatro soluciones de carbohidratos (almidón, sacarosa, glucosa y fructosa) con los métodos de Fehling y de Lugol. El almidón es el sustrato de la amilasa; la sacarosa, de la invertasa; glucosa y fructosa son los productos de esta segunda reacción.
Amilasas
La hidrólisis del almidón se demuestra bien por la desaparición del color azul en presencia del reactivo de Lugol o por la formación del precipitado rojizo del test de Fehling.
Tanto para la amilasa α (saliva) como para la β (extracto de cebada), preparar 7 tubos de ensayo y mezclar 2 mL de Tampón A con 400 µL de la disolución de almidón. Después, proceder con cada tubo como se describe en la Tabla 1.
| Tubo | HCl | Saliva o extracto de cebada | Calentar con mechero Bunsen durante: | Dejar a temperatura ambiente durante: |
|---|---|---|---|---|
| 1* | 2 gotas | 5 min | ||
| 2* | 2 gotas | 5 min | ||
| 3 | 5 min | |||
| 4 | 5 min | |||
| 5 | 0.5 mL | 5 min | ||
| 6* | 2 gotas | 0.5 mL | 5 min | |
| 7 | 0.5 mL** | 5 min |
Dividir los contenidos de cada tubo de ensayo en dos partes: probar una parte con 2 gotas de reactivo de Lugol, la otra con 500 µL de Fehling A más 500 µL de Fehling B. Anotar los resultados de las pruebas en la Tabla 3.
Para probar la especificidad de la amilasa, repetir el procedimiento para el tubo 5 reemplazando la saliva por 300 µL de la suspensión de levadura (que no contiene amilasas).
Invertasa
Preparar 7 tubos de ensayo y mezclar 1 mL de Tampón A con 0,5 mL de la disolución de sacarosa. Después, tratar cada tubo como se describe en la Tabla 2.
| Tubos | HCl | Suspensión de levadura | Calentar con mechero Bunsen durante:: | Dejar a temperatura ambiente durante: |
|---|---|---|---|---|
| 1* | 1 gotas | 5 min | ||
| 2* | 1 gotas | 5 min | ||
| 3 | 5 min | |||
| 4 | 5 min | |||
| 5 | 1 mL | 5 min | ||
| 6* | 1 gotas | 1 mL | 5 min | |
| 7 | 1 mL** | 5 min |
Probar cada tubo con 500 µL de Fehling A más 500 µL de Fehling B.
Anotar los resultados en la Tabla 3.
| Tubo | Amilasa α (saliva) | Amilasa β (extracto de cebada) | Invertasa | ||
|---|---|---|---|---|---|
| Test de Lugol | Test de Fehling | Test de Lugo | Test de Fehling | Test de Fehling | |
| 1 | |||||
| 2 | |||||
| 3 | |||||
| 4 | |||||
| 5 | |||||
| 6 | |||||
| 7 | |||||
Para probar la especificidad de la invertasa, repetir el procedimiento para el tubo 5 reemplazando la suspensión de levadura por 500 µL de saliva diluida 1/10.
Seguridad
Estos experimentos no utilizan ni producen ningún producto peligroso con la excepción de HCl y NaOH. La saliva y estos reactivos se deben manejar con guantes.
El yodo se debe pesar con cuidado y llevando puesta una mascarilla de seguridad porque se sublima fácilmente. Se debe tener también cuidado cuando se calienten los tubos con el mechero Bunsen y cuando se disuelva el almidón porque conviene calentarlo.
Resultados esperados
En conjunto, las condiciones extremas que resultan del calentamiento y la adición de ácido clorhídrico permiten que el almidón y la sacarosa se hidrolicen. Sin embargo, ni el calentamiento ni el ácido por sí solos son totalmente efectivos.
Con condiciones suaves (sin calentar y sin añadir ácido), la saliva, el extracto de cebada y la levadura hidrolizan sus sustratos. En estos casos, tanto el calentamiento como la adición de ácido clorhídrico impiden la hidrólisis: los materiales biológicos son termolábiles y sensibles al pH.
Discusión
La comparación de las condiciones más extremas que se requieren para la catálisis química (elevada temperatura y pH extremo) con las condiciones tan suaves en que transcurren los procesos biológicos aporta al estudiante la idea de que en los organismos vivos hay «sustancias especiales y poderosas» que son termolábiles, específicas (a diferencia de los catalizadores inorgánicos) y capaces de catalizar las reacciones biológicas. De esta manera, los estudiantes de secundaria pueden reproducir el desarrollo histórico del conocimiento sobre las enzimas; el término enzima no les parecerá nunca más extraño porque «las palabras solo destacan y tienen sentido si su significado ha estado previamente implicado en nuestra relación directa con las cosas» (Dewey, 1910).
Agradecimientos
Quiero agradecer al profesor Umberto Mura, Departamento de Fisiología y Bioquímica de la Universidad de Pisa, su apoyo constante. Agradecimiento especial a la profesora Rossana Striccoli por la revisión del manuscrito en inglés y también a mis estudiantes por sus valiosas observaciones y dudas.
References
- Dewey J (1910) How we think. Boston, MA, USA: D.C. Heath & Co
- Payen A, Persoz JF (1833) Mémoire sur la diastase, les principaux produits de ses reactions et leur applications aux arts industriels. Annales de chimie et de physique 53: 73-92
Resources
- Marini I (2005) Discovering an accessible enzyme: salivary α-amylase. Prima digestio fit in ore: a didactic approach for high school students. Biochemistry and Molecular Biology Education 33: 112-116. doi:10.1002/bmb.2005.494033022439
- Inhelder B, Piaget J (1958) The Growth of Logical Thinking from Childhood to Adolescence. New York, NY, USA: Basic Books
- Voet D, Voet JG (2004) Biochemistry, 3rd Edition. Hoboken, NJ, USA: J. Wiley & Sons
- van der Maarel MJ et al. (2002) Properties and applications of starch-converting enzymes of the alpha-amylase family. Journal of Biotechnology 94: 137-155. doi: 10.1016/S0168-1656(01)00407-2





